红细胞膜仿生氮化硼纳米球的制备及其作为抗肿瘤药物载体的研究
冯诗倪, 张慧杰, 高晓冬, 中西秀树*
(1.江南大学 糖化学与生物技术教育部重点实验室 /生物工程学院,江苏 无锡 214122;2.江南大学 药学院,江苏 无锡 214122)
恶性肿瘤严重威胁人类的生命健康。化疗药物因其适用于所有肿瘤类型,是目前应用最为广泛的肿瘤治疗方法之一。然而,化疗药物缺乏靶向性,在杀伤肿瘤细胞的同时也会无选择性的杀伤正常组织细胞;且药物在机体内代谢较快,容易被肾脏清除,无法达到良好的治疗效果[1]。为改善化疗药物的治疗效果,近年来药物载体递送系统(Drug delivery system,DDS)的发展提供了一种全新的化疗药物递送方式。DDS可利用肿瘤部位高通透性和滞留(EPR)效应促进化疗药物进入肿瘤细胞,提高肿瘤部位药物浓度,进而增强肿瘤治疗效果[2]。
随着纳米技术的不断发展,具有多种功能的纳米材料被广泛应用于生物医学领域[3]。氮化硼(Boron nitride,BN)纳米材料凭借其优异的抗氧化性、化学稳定性、润滑性能、以及较高的导热性成为研究者关注的热点之一,并被广泛用作复合物材料、光学与电子材料等[4]。BN具有与碳纳米材料相似的结构和性质,它可看成是B原子与N原子交替连接代替C原子的位置而得[5]。研究表明,BN具有比碳纳米材料更优异的生物相容性,是一种在医学上极具潜力的纳米材料[6]。BNNS作为一种新型BN纳米材料,具有均一的球形结构和较低的结构诱导毒性。2011年,Zhi等[7]首先报导了BNNS具有良好的生物相容性,并且较易被细胞摄取。Zhang等[8]曾利用BNNS作为纳米载体递送具有免疫刺激活性的含有CpG基序的寡脱氧核苷酸(CpG oligodeoxynucleotide,CpG ODN)。 实验结果表明,BNNS可以保护CpG ODN在血清中不被酶解,促进其被免疫细胞摄取。BNNS能显著提高CpG ODN的免疫刺激活性,并刺激免疫细胞产生大量抗肿瘤细胞因子。此外,研究发现BN可以递送高浓度硼原子到肿瘤组织中,大大高于血液和其它组织中硼原子含量,使其在硼中子俘获治疗 (Boron neutron capture therapy,BNCT)的应用中极具潜力[9-10]。 BN纳米材料作为药物载体或可实现化疗与BNCT疗法相结合的肿瘤协同治疗。这将有可能为抗肿瘤治疗提供一种安全高效的新策略。正因如此,BNNS在作为抗癌药物载体方面显示了一定的优越性。然而,迄今为止基于BNNS的抗肿瘤药物载体鲜有报导,BNNS在生物医学领域的应用仍待探索和发掘。此外,BNNS的表面疏水性能使其难以充分分散在有机溶剂和水中,易产生团聚现象,极大地限制了其发展与应用[11]。因此,必须对BN纳米材料进行表面功能化修饰。
近年来,受到自然界生物近乎完美的结构、功能启示,仿生技术引起了研究人员的广泛关注[12]。通过对机体内源性功能成分的模仿,仿生药物载体能够与机体实现完美兼容,更加高效地进行药物递送。红细胞是脊椎动物血液中数量最多的一种血细胞,负责向机体各个组织细胞输送氧气并回收二氧化碳等代谢产物。在血液循环系统中,红细胞寿命长达120 d。红细胞优异的系统循环能力得益于其独特的形变能力和细胞膜表面的免疫抑制相关蛋白[13]。Zhang[14]课题组利用低渗处理制得天然红细胞膜,并对金纳米颗粒进行包被。实验结果表明,红细胞膜的包被能帮助金纳米颗粒在血液中维持良好的稳定性,抑制巨噬细胞的吞噬。Rao等人[15]利用微流控电穿孔技术将红细胞膜镀层于磁性纳米粒子外,制备出具有核-壳结构的仿生磁性纳米粒子RBC-MNs。基于纳米粒子优良的磁性、光热性能和红细胞膜的血液长循环特点,RBC-MNs被用于肿瘤增强核磁共振成像和光热疗法。结果表明RBCMNs能够有效逃逸免疫细胞的吞噬,通过EPR效应大量聚集于肿瘤组织中,显示出良好的抗肿瘤效果。
作者拟借助红细胞膜良好的流动性,通过物理挤压的方式将其包覆于BNNS外表面,同时,将疏水性小分子化疗药物DOX嵌插于红细胞膜磷脂双分子层内,构建出红细胞膜包被的,装载DOX的仿生药物递送系统DOX@RBC-BNNS,并对该递送系统进行表征和体外抗肿瘤效果验证(图1)。
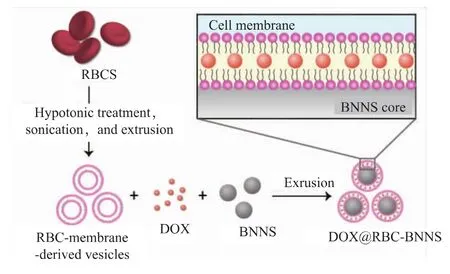
图1 DOX@RBC-BNNS的制备过程Fig.1 Schematic illustration of the preparation process of DOX@RBC-BNNS
1 材料与方法
1.1 实验材料
DOX:上海生工生物工程股份有限公司产品;昆明小鼠(雌性,均6-8周龄):维通利华实验动物技术有限公司产品;人宫颈癌细胞HeLa细胞株:中科院细胞库提供;DMEM培养基和胎牛血清蛋白(FBS): 美国 Gibco 公司产品;Cell-Counting Kit-8(CCK-8)试剂盒:日本Donjindo公司产品;Alexa Fluor®488-鬼笔环肽及DAPI:Invitrogen公司产品。
1.2 实验方法
1.2.1 红细胞小体的制备利用眼球取血法取昆明小鼠全血约2 mL置于5 mL离心管中 (内含0.5 mL质量分数3.8%柠檬酸钠溶液作为抗凝剂)。将上述血液于4℃下3 000 r/min离心20 min,吸除上层血液绒毛层。再将红细胞置于预冷的等渗磷酸盐缓冲液(pH 7.4)中重悬,后于4℃下离心洗涤3次。将洗净后的红细胞置于预冷的0.2×PBS低渗缓冲液中重悬,随后置于4℃冰箱中放置1 h,使之在低渗缓冲液中完全溶血。然后于4℃,9 000 r/min条件下离心15 min,使红细胞膜沉淀,去除血红蛋白。重复离心洗涤3次,经额定功率为60 W的水浴超声20 min后,制得红细胞小体。
1.2.2 RBC-BNNS的构建BNNS采用化学气相沉积法(CVD)制备而成[16]。将制得的红细胞小体和BNNS按质量浓度比为1∶1共混,使用迷你挤压器(Avanti)进行往复的挤压过筛,依次使用孔径为400 nm及200 nm的 Millipore聚碳酸脂膜,连续过膜挤压20次,制得红细胞膜包被的RBC-BNNS。
1.2.3 RBC-BNNS的表征RBC-BNNS的形态表征由JEM-2100透射电子显微镜(JEOL,Japan)在加速电压为80 kV时得到。表面电位及水合粒径由Nano ZS Zetasizer(Malvern,England) 测得。紫外-可见光吸收光谱由Nanodrop 2000分光光度计(Thermo Fisher Scientific) 测得。
1.2.4 细胞培养实验用细胞为人宫颈癌细胞HeLa细胞。HeLa细胞培养于DMEM(含有质量分数10%加热灭活后的FBS及1%链霉素/青霉素双抗)中。置于37℃,环境湿润的体积分数5%CO2培养箱内培养。当细胞贴壁生长大于80%时进行细胞传代。
1.2.5 RBC-BNNS的生物安全性考察利用CCK-8法来检测HeLa细胞的活性。取对数生长期的细胞,稀释成1×l05个/mL单细胞悬液,以每孔100 μL加入96孔细胞培养板中。将培养板置于37℃,体积分数5%CO2培养箱中培养24 h使细胞贴壁。随后向培养板中加入系列质量浓度的BNNS和RBCBNNS,将96孔板放在培养箱内继续培养24 h。最后向每孔加入10 μL CCK-8溶液,孵育约3 h,用酶标仪测定每个孔在450 nm处的吸光度值。
1.2.6 DOX的装载首先以PBS作为缓冲液分别制备1 mg/mL的BNNS和RBC-BNNS溶液,分别取1 mL于离心管中,再向其中加入500 μL DOX溶液(1 mg/mL)。 制备DOX@BNNS时:将BNNS与 DOX的混合液在避光条件下室温震荡24 h。随后,经13 500 r/min离心20 min收集样品并用PBS洗涤数次,离心收集得到DOX@BNNS;制备DOX@RBCBNNS时:将RBC-BNNS与DOX的混合液在避光条件下通过孔径为200 nm的迷你挤压器连续过膜挤压,随后,经13 500 r/min离心20 min后收集样品并用PBS洗涤数次,得到DOX@RBC-BNNS。利用Nanodrop检测上清中游离DOX的量,通过计算得到载体上DOX的装载量。
1.2.7 DOX@RBC-BNNS的细胞摄取将HeLa细胞接种于35 mm的Petri培养皿中,培养24 h使细胞贴壁后向培养液中加入2.5 μg/mL的DOX@RBC-BNNS,37℃下分别孵育0.5 h、2 h及4 h。孵育结束后,用PBS洗涤细胞,加入体积分数3.7%甲醛固定30 min。用PBS洗涤细胞2次后,细胞膜和细胞核分别用Alexa Fluor®488鬼笔环肽和DAPI染色,再用PBS洗涤2次,最后用激光共聚焦显微镜分别在405 nm和488 nm通道观察HeLa细胞对DOX@RBC-BNNS的摄取情况并采集相应的荧光图像。
1.2.8 DOX@RBC-BNNS体外抗肿瘤效果评价取对数生长期的HeLa细胞,质量分数0.25%胰蛋白酶消化成单细胞悬液,以1×104个/mL的细胞密度接种于96孔板中,100 μL/孔。细胞培养24 h后,分别加入终质量浓度为 2 μg/mL的游离 DOX、DOX@BNNS及DOX@RBC-BNNS,继续培养细胞48 h。实验终止前,各孔分别加入CCK-8溶液10 μL,继续培养3 h后,用酶标仪测定每个孔在450 nm处的吸光度值。
1.2.9 统计学分析选用Student检验法对数据进行统计学差异分析。数据的表达方式均为平均值标准偏差。显著性差异分别被标注为*P<0.05,**P<0.01,***P<0.001。
2 结果与讨论
2.1 RBC-BNNS的构建与表征
通过CVD法制备得到的BNNS具有均一的球形结构,通过透射电镜(图2)可以清晰的观察到该纳米球呈现聚集状态,平均粒径约为100 nm。经RBC包被后,BNNS表面的晶体结构消失,边缘可见半透明的膜结构,且RBC-BNNS在透射电镜下呈现出良好的单分散状态,粒径增加为约130 nm。该结果证明RBC膜成功包被于BNNS表面。
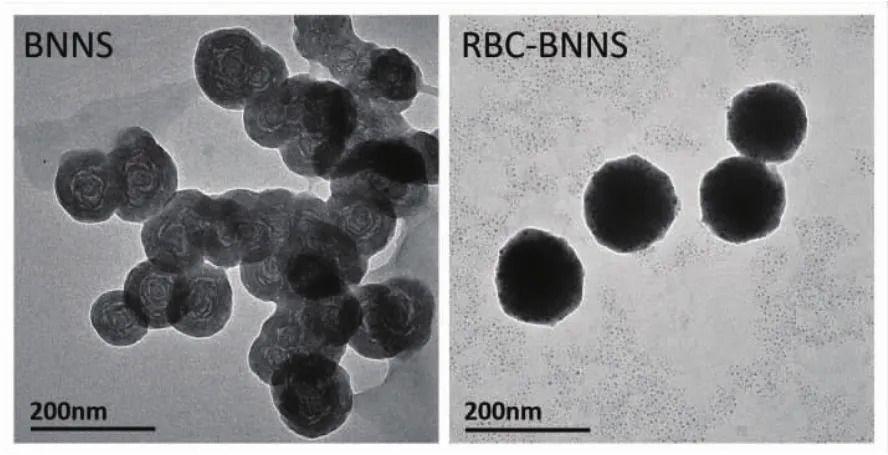
图2 BNNS和RBC-BNNS的透射电镜图片Fig.2TEM images of BNNS and RBC-BMMS
随后,利用动态光散射粒度仪对RBC-BNNS的粒径、Zeta电位及稳定性进行考察。图3显示,BNNS的水合粒径为763 nm,这是由于BNNS在水溶液中的团聚所造成。通过低渗处理制得的红细胞小体的水合粒径为227 nm,将其包被于BNNS表面后,RBC-BNNS的粒径降为150 nm,说明RBC-BNNS在溶液中呈单分散状态。细胞膜磷脂双分子层外部亲水,使RBC-BNNS表面具备亲水性,在溶液中表现出良好的分散性。Zeta电位结果显示,BNNS表面电位约为-32.2 mV,而RBC-BNNS的电位约为-10.6 mV,与红细胞小体的表面电位 (-9.5 mV)相似。以上结果表明,RBC膜的包被改善了BNNS的表面疏水性,极大提升了BNNS的溶液分散性。此外,Zeta电位的变化间接证明了RBC-BNNS的成功制备。
图4显示了RBC-BNNS在PBS缓冲液中的长期稳定性。结果表明RBC-BNNS的粒径在14 d内无显著变化,说明该仿生纳米载体具有良好的分散性和稳定性。这种理想的分散稳定性增加了RBCBNNS的静脉给药可操作性,同时也将有助于维持药物在系统循环过程中的稳定性,避免血管堵塞等不良反应的发生。

图3 BNNS,RBC小体和RBC-BNNS的粒径及表面电位Fig.3 Hydrodynamic size and surface zeta potential of BNNS,RBC-Vesicles and RBC-BNNS
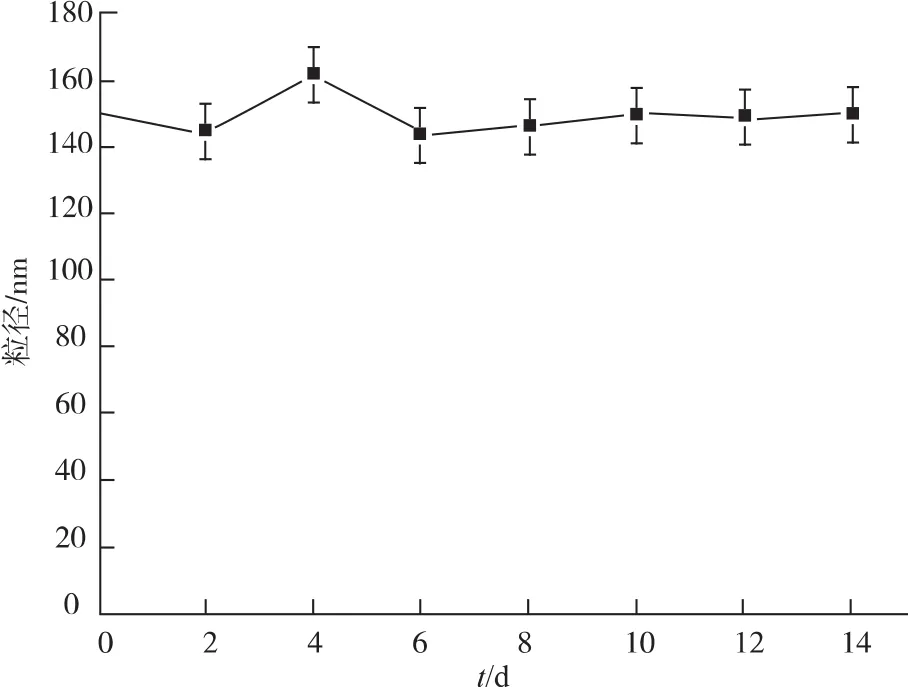
图4 基于粒径变化的RBC-BNNS稳定性考察Fig.4 Stability of RBC-BNNS in terms of particle size
2.2 RBC-BNNS的生物安全性
理想的药物载体必须具备优异的生物安全性。为此,利用CCK-8法对BNNS及RBC-BNNS的生物安全性进行了考察。图5为不同质量浓度的BNNS和RBC-BNNS对HeLa细胞存活率的影响。结果表明BNNS和RBC-BNNS在最高质量浓度100 μg/mL范围内未表现明显的细胞毒性,细胞活性均保持在90%以上,展现出良好的生物相容性。

图5 BNNS和RBC-BNNS的细胞毒性检测Fig.5 Cytotoxicity of BNNS and RBC-BNNS
2.3 DOX@RBC-BNNS的细胞摄取
BN纳米材料与石墨具有相似的结构和性质,可与疏水性小分子药物DOX通过π键相互结合。而RBC-BNNS则通过其外层RBC膜的疏水性磷脂双分子层贮存DOX。DOX在RBC-BNNS上的装载量为214.3 μg/mg,远高于其在BNNS上的装载量(6.7 μg/mg)(图 6),这是由于 RBC-BNNS 增强的溶液分散性提升了载体的比表面积,且药物装载过程中的机械挤压力促进了药物在RBC-BNNS上的装载。

图6 BNNS和RBC-BNNS的DOX装载量Fig.6 DOX loading capacity of BNNS and RBC-BNNS
选择HeLa细胞作为肿瘤细胞模型来评价DOX@RBC-BNNS的细胞摄取情况。DOX在488 nm激发光激发下能产生红色荧光,可通过CLSM考察细胞对药物载体的摄入。CLSM成像结果如图7所示,在0.5 h时,仅有少量DOX@RBC-BNNS进入HeLa细胞;随着培养时间增长至2 h,大量红色荧光定位于细胞质中;共孵育4 h后,HeLa细胞在细胞核区域显示出明亮的红色荧光。该结果证明DOX@RBC-BNNS能够被HeLa细胞快速高效摄取,随后DOX能够从载体上有效释放并进入细胞核发挥作用。
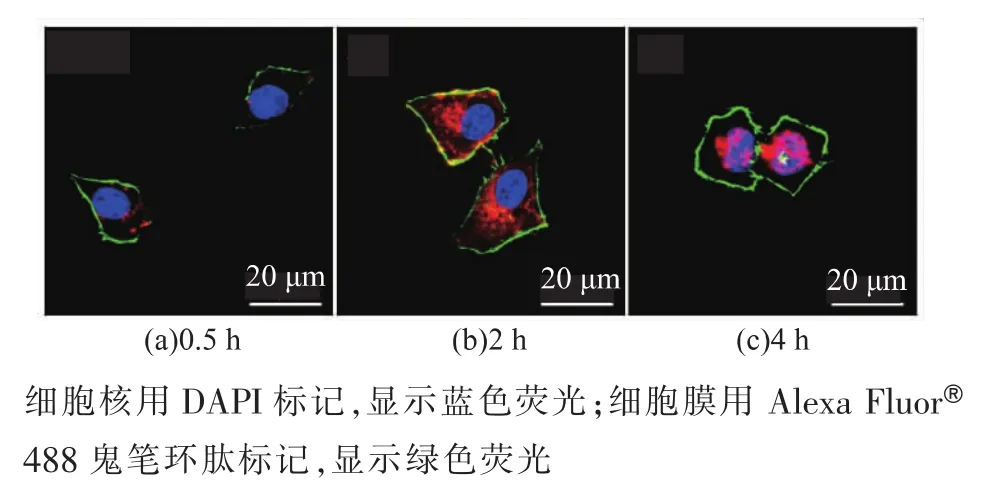
图7 HeLa细胞与DOX@RBC-BNNS共培养0.5 h,2 h及4 h后的共聚焦显微镜图片Fig.7 CLSM images of HeLa cells after incubation with DOX@RBC-BNNS for 0.5 h,2 h and 4 h,respectively
2.4 DOX@RBC-BNNS的体外抗肿瘤效果
最后,利用CCK-8法验证 DOX@RBC-BNNS对肿瘤细胞的杀伤效果。如图8所示,游离DOX与载药纳米粒子均表现出对肿瘤细胞的杀伤作用,但游离DOX及DOX@BNNS对肿瘤细胞的杀伤力相对较弱。这是由于DOX通过被动扩散途径进入细胞且易被泵出;而DOX@BNNS较差的溶液分散性限制了细胞对药物的摄入[17]。DOX@RBC-BNNS对肿瘤细胞的杀伤效果最为明显,或与其优越的分散性和高效的细胞摄取有关。以上结果表明,RBCBNNS在癌症治疗中有很强的药物运载和运输潜力,可被用作有效的药物载体进行深入研究。

图8 HeLa细胞与游离 DOX,DOX@BNNS及 DOX@RBC-BNNS共培养48 h后的相对细胞活性Fig.8 Relative viability of HeLa cells incubated with free DOX,DOX@BNNS and DOX@RBC-BNNS for 48 hours
3 结 语
采用低渗处理分离纯化红细胞膜,通过机械挤压将其包被于BNNS外,制备了一种新型仿生药物运输载体RBC-BNNS。该载体具有均一的粒径及良好的分散性,在PBS中能保持较长时间的稳定。体外毒性实验表明该载体具有优越的生物相容性。该载体的 DOX的装载量为 214.3 μg/mg,远高于BNNS。RBC-BNNS能够有效输送DOX进入肿瘤细胞,并在胞内进行药物释放。此外,细胞毒性实验初步验证了DOX@RBC-BNNS比游离DOX具有更显著的癌细胞杀伤效果。综上,该仿生药物载体在肿瘤治疗中具有潜在的应用前景,为开发安全高效的药物载体提供了新思路。

