液相色谱-串联质谱法同时测定普洱茶中16种真菌毒素
胡 琳,师 真,赵 丽,刘晓松,董玉英,蒋孟圆,*,李文廷,*
(1.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500; 2.昆明市疾病预防控制中心,云南 昆明 650228)
普洱茶出自云南省的大叶种茶,经独特的微生物发酵而成,是国内市场最受欢迎的茶叶品类。近年来,由于普洱茶具有降血脂、抗氧化、减肥、抗菌等多重保健功效而备受欢迎[1],但茶叶在发酵生产加工和保存过程中,有可能被真菌毒素污染,其安全性对消费者健康以及茶叶产业的可持续发展尤为重要[2-3]。
真菌毒素是由真菌次生代谢产生的有毒物质,农产品在生长阶段、收获时节、产品加工及储存期间,均可能被真菌毒素污染,其对人体的健康存在极大的威胁,可使动物出现急性、亚急性、慢性中毒症状[4-5]。黄曲霉毒素是一种天然存在的最强致癌物之一,主要有AFTB1、AFTB2、AFTG1、AFTG2四种,其中以AFTB1毒性最强。伏马毒素是新发现的新型、强毒性的生物毒素,主要包括FB1、FB2、FB3。脱氧雪腐镰刀菌烯醇也是最常见的一类污染性真菌毒素,食用低剂量的脱氧雪腐镰刀菌烯醇会引起食欲下降、呕吐等症状。因此,严格控制茶叶中的真菌毒素含量与百姓的安全健康息息相关。据不完全统计,全世界大约有25%的农产品被真菌毒素污染,造成的损失达数百亿美元。近年来,世界各地已经纷纷高度重视真菌毒素的污染问题,并着手研制相应的测定方法以及限量要求,我国也新出GB 2761—2017《食品安全国家标准食品中真菌毒素限量》标准,增加了真菌毒素的检测范围及相应含量限制[6-7]。
真菌毒素的检测方法主要有酶联免疫吸附法、免疫亲和净化-液相色谱法、免疫亲和柱色谱-酶联免疫吸附法[8-11]、液相色谱-串联质谱法。由于茶叶中存在茶多酚和茶色素等复杂基质的干扰,一般的酶联免疫及液相色谱法在测定真菌毒素时容易产生“假阳性”结果,而液相色谱-串联质谱具有灵敏度高、准确性好、多种组分同时检测等技术优点成为目前较为推广的检测方法[12-14],文献有报道对部分茶叶中几种真菌毒素进行检测分析,但样品检测范围较广且检测项目较少[15-20],本实验主要针对云南在售普洱茶,建立超高效液相色谱-串联质谱同时检测16种真菌毒素的检测方法,以期全面提供更为准确的实验数据,为相关部门对普洱茶的监管提供技术支持。
1 材料与方法
1.1 仪器
超高效液相色谱-串联质谱(美国Agilent Technologies公司1290 Infinity Ⅱ-美国AB SCIEX公司QTRAP 4500),具有电喷雾离子源;十万分之一分析天平(瑞士Mettler Toledo公司XS205DU);数控超声波清洗器(昆山市超声仪器有限公司 KQ-500DE);纯水处理终端机(德国Sartorius公司Arium pro D1);免疫亲和净化柱(Pribolab中国公司PriboFast®Multi-Toxin IAC);智能台式高速冷冻离心机(湖南赫仪器装备有限公司3H16RI)。
1.2 试剂
16种真菌毒素标准物质黄曲霉毒素B1(AFTB1)、黄曲霉毒素B2(AFTB2)、黄曲霉毒素G1(AFTG1)、黄曲霉毒素G2(AFTG2)、雪腐镰刀菌烯醇(NIV)、脱氧雪腐镰刀菌烯醇(DON)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-AcDON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-AcDON)、玉米赤霉烯酮(ZEN)、赭曲霉毒素A(OTA)、伏马毒素B1(FB1)、伏马毒素B2(FB2)、伏马毒素B3(FB3)、T-2毒素(T-2)、HT-2 毒素(HT-2)、杂色曲霉毒素(ST)及15种同位素内标:13C17-AFTB1、13C17-AFTB2、13C17-AFTG1、13C17-AFTG2、13C15-NIV、13C15-DON、13C15-3-AcDON、13C18-ZEN、13C20-OTA、13C34-FB1、13C34-FB2、13C34-FB3、13C24-T-2、13C22-HT-2、13C18-ST购自Pribolab中国公司;已知质控样购自美国Romer Labs公司;色谱纯的甲醇、乙腈购自美国Sigma-Aldrich公司;实验中所用水为去离子水。
1.3 材料
检测茶叶样品由云南各州市疾病预防控制中心进行采集提供,昆明市、大理市及普洱市各26件,德宏州28件,大理市24件,迪庆州、临沧市、玉溪市、曲靖市、保山市、丽江市、楚雄州、红河州、怒江市、文山州、昭通市各4件,共计普洱茶174件,生普洱茶和熟普洱茶各87件,每个地方均按照1∶1数量送样。
1.4 实验方法
1.4.1 标准溶液的配制
分别将16种真菌毒素用乙腈稀释为2.0 μg·mL-1的中间液,依据16种真菌毒素在质谱MRM模式下响应强度的不一致性,移取一定量中间液适度稀释进行质谱参数的寻找及优化,精确量取一定体积的16种真菌毒素单一标准储备液于10 mL容量瓶中,用乙腈定容至刻度,制得不同质量浓度的混合标准储备液,精确量取一定体积的15种各真菌毒素同位素内标准溶液于5 mL容量瓶中,用乙腈稀释定容至刻度,充分混匀后制得不同质量浓度混合真菌毒素同位素内标工作液,黄曲霉毒素系列同位素内标浓度为0.01 μg·mL-1,伏马毒素B2、B3和赭曲霉毒素A的同位素内标浓度为0.2 μg·mL-1,其余真菌毒素的同位素内标浓度均为0.5 μg·mL-1,分别避光储存于-20 ℃条件下。
1.4.2 样品溶液的制备
精确称量2 g普洱茶试样(精确到0.01 g)于50 mL离心管中,加入20 mL甲醇-水-甲酸(70∶29∶1,体积比),涡旋1 min,加入20 μL混合真菌毒素同位素内标工作液,超声提取20 min,涡旋振荡提取30 min,转移至高速冷冻离心机以10 000 r·min-1离心5 min,如溶液出现浑浊,用玻璃纤维滤纸过滤,取10 mL上清液通过PriboFast®Multi-Toxin IAC免疫亲和净化柱,依次用0.5%吐温-水溶液20 mL、去离子水10 mL淋洗柱子,弃去清洗液,加入2 mL甲醇-乙酸(体积比98∶2)洗脱亲和柱,重复操作1次,收集全部洗脱液至试管中,在50 ℃下用氮气缓缓地将洗脱液吹至近干,加入20%的乙腈-水溶液0.5 mL溶解,过0.22 μm滤膜,供测试待用。
1.4.3 色谱条件
色谱柱:Waters HSS T3 C18柱(柱长50 mm,柱内径2.1 mm,填料粒径1.8 μm),柱温设定40 ℃,流动相为梯度洗脱,A相:乙腈,B相:0.2%甲酸水溶液,流速为0.3 mL·min-1,样品进样体积15 μL,检测运行时间8.0 min。
1.4.4 质谱条件
电喷雾离子源正离子模式(ESI+),多离子反应监测模式(multiple reaction monitoring,MRM),离子源温度550 ℃,离子喷雾电压(ion spray voltage)为5 500.0 V,气帘气为30 psi,雾化气为55 psi,辅助气为55 psi。
1.4.5 质谱条件的优化
将16种真菌毒素以及15种同位素内标分别用乙腈稀释至质量浓度400 μg·L-1,以7 μL·min-1的流速在流动注射的方式下分别采取正离子和负离子模式进行一级质谱(Q1 MS)扫描,寻找目标化合物的母离子,二级质谱Product Ion Scan(MS2)扫描选取强度最高的碎片离子作为定量离子,以强度次高的离子作为定性离子。用质谱多反应监测(MRM)模式分别优化目标化合物的锥孔电压(DP)、碰撞能量(CE)等质谱条件,最终得到样品检测的质谱参数,如表1所示。
2 结果与分析
2.1 检测模式的选择
通过对16种真菌毒素和15种同位素内标的母离子及子离子的寻找,脱氧雪腐镰刀菌烯醇及同位素内标只有在负离子模式中有响应,而其余的在正离子模式下有较好的响应,所以脱氧雪腐镰刀菌烯醇及同位素内标选择负离子模式检测,其余真菌毒素选择正离子模式检测。
2.2 色谱条件的选择
流动相分别选择了乙腈、甲醇作为A相有机相,0.2%氨水、0.2%甲酸及纯水作为B相水相,进行组合条件的考察,结果表明,乙腈-0.2%氨水组合作为负离子检测模式流动相,乙腈-0.2%甲酸作为正离子检测模式流动相, 目标分析物的分离效果、质谱信号响应强度以及出峰状况最佳,正负离子模式梯度洗脱程序均为:0~1.0 min,80% B;1.0~2.5 min,80% B~40%B;2.5~4.5 min,40% B~0% B;4.5~5.5 min,0% B;5.5~7.0 min,0% B~80% B;7.0~8.0 min,80% B,流动相只用到A、B两相,A+B为100%。通过优化好的色谱和质谱条件进行分析,真菌毒素及同位素内标的总离子图(TIC)见图1,各真菌毒素的MRM色谱图分别见图2。
表1 十六种真菌毒素及15种同位素内标在MRM模式下检测的质谱参数
Table1Mass spectrum parameters of 16 kinds of mycotoxins and 15 isotope internal standards detected in MRM mode
*为定量离子;DON采用负离子模式。
* represented quantitative ion; DON were detected in negative ion mode.
2.3 线性关系及灵敏度
依据16种真菌毒素在质谱MRM模式下有差异较大的响应强度,测试的标准溶液配制为不同质量浓度范围的混合标准溶液,以各种真菌毒素定量离子峰面积为纵坐标,对应的质量浓度(μg·L-1)为横坐标绘制标准曲线,以3倍信噪比(S/N)计算出检出限(limit of detection,LOD),10倍信噪比计算出定量限(limit of quantity,LOQ),线性关系参数见表2。
2.4 净化方式的选择
由于普洱茶中具有色素等复杂基质干扰,对仪器离子源的污染及样品的检测分析都有较大影响。本文通过16种真菌毒素混合标准物质及普洱茶基质加标考察了PriboFast®Multi-Toxin IAC免疫亲和净化柱、PriboFast®M226多功能净化柱及0.22 μm滤头的对比实验,混合标准物质通过三种净化方式处理,其柱效均在95%以上无明显差异,但基质加标溶液经多功能净化柱及滤头净化后,色谱峰受基质影响分离效果较差,TIC如图3所示,而免疫亲和柱具有特异吸附功能,样品经0.5%吐温 PBS稀释后过柱,用纯水、0.5%的吐温水溶液及纯水3次清洗杂质,洗脱净化后的样品各真菌毒素的色谱峰分离情况良好,TIC如图1所示,实验表明,普洱茶的样品处理应采取免疫亲和柱净化。

图1 除DON外的15种真菌毒素的TIC图


图2 十六种真菌毒素的MRM色谱图
表2 十六种真菌毒素的线性关系、检测限
Table2Linear relationship and detection limit of 16 mycotoxins
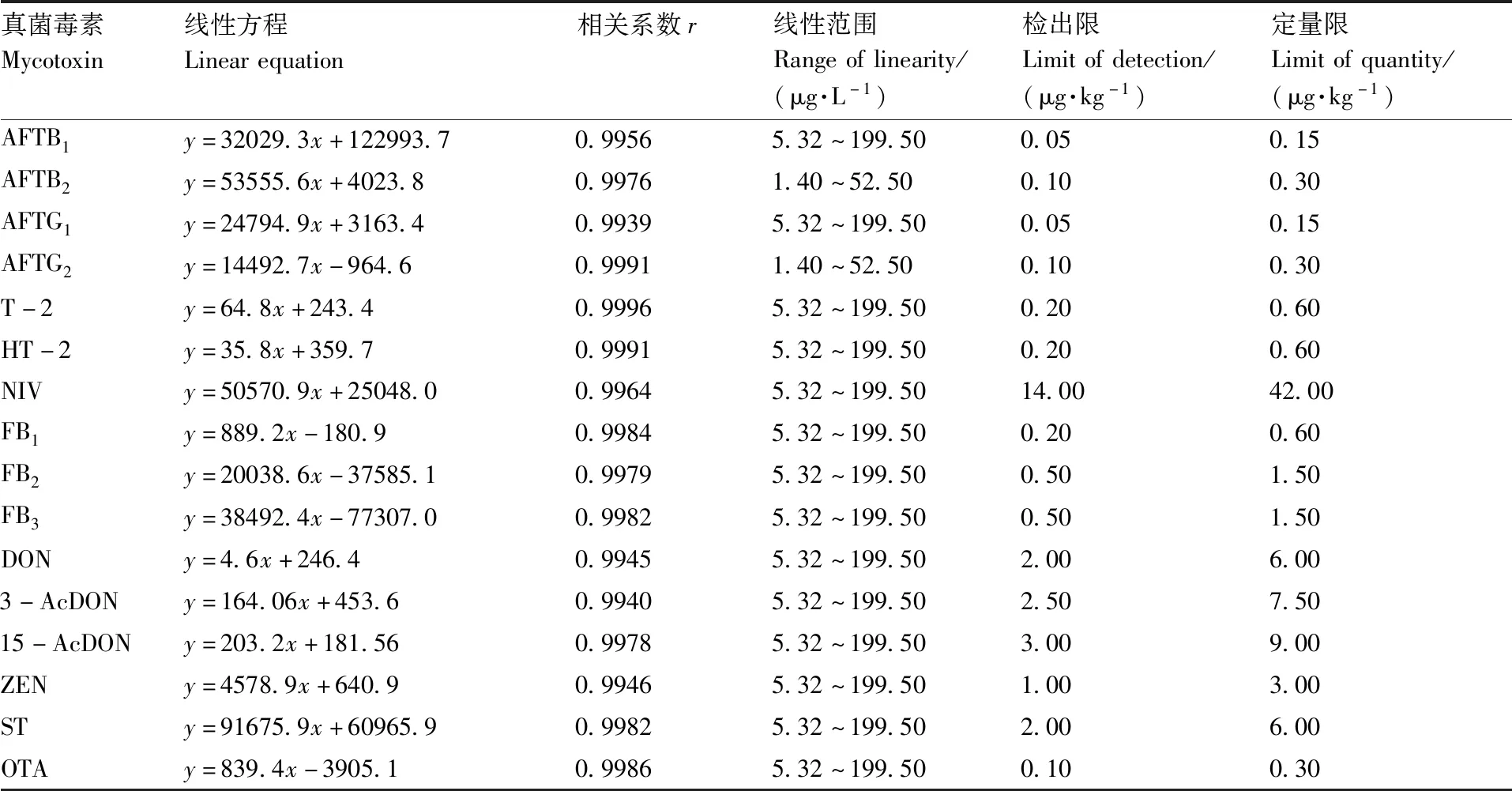
真菌毒素Mycotoxin线性方程Linearequation相关系数r线性范围Rangeoflinearity/(μg·L-1)检出限Limitofdetection/(μg·kg-1)定量限Limitofquantity/(μg·kg-1)AFTB1y=32029.3x+122993.70.99565.32~199.500.050.15AFTB2y=53555.6x+4023.80.99761.40~52.500.100.30AFTG1y=24794.9x+3163.40.99395.32~199.500.050.15AFTG2y=14492.7x-964.60.99911.40~52.500.100.30T-2y=64.8x+243.40.99965.32~199.500.200.60HT-2y=35.8x+359.70.99915.32~199.500.200.60NIVy=50570.9x+25048.00.99645.32~199.5014.0042.00FB1y=889.2x-180.90.99845.32~199.500.200.60FB2y=20038.6x-37585.10.99795.32~199.500.501.50FB3y=38492.4x-77307.00.99825.32~199.500.501.50DONy=4.6x+246.40.99455.32~199.502.006.003-AcDONy=164.06x+453.60.99405.32~199.502.507.5015-AcDONy=203.2x+181.560.99785.32~199.503.009.00ZENy=4578.9x+640.90.99465.32~199.501.003.00STy=91675.9x+60965.90.99825.32~199.502.006.00OTAy=839.4x-3905.10.99865.32~199.500.100.30

图3 未用免疫亲和柱净化的TIC色谱图
2.5 回收率及精密度
称取18份2.0 g普洱茶样品,根据16种真菌毒素在质谱中的响应强度,样品添加10、30、50 μg·kg-1三种浓度水平进行真菌毒素的基质加标回收实验,按照样品溶液的制备条件处理,每种进行6个水平测定,计算出相对标准偏差进行方法精密度考察,16种真菌毒素的回收率范围为84.2%~102.7%,相对标准偏差范围为2.18%~4.78%,实验结果见表3所示。
2.6 质量控制
分别称取5 g(精确到0.01 g)真菌毒素质控样各3份,依据样品前处理方法进行处理,检测值均符合标准证书要求,结果见表4。实验数据表明,普洱茶样品按照此种方法提取净化分析,具有较高的提取效率,准确度较好。
表3 真菌毒素的加标回收率(n=6)
Table3Recoveries of mycotoxins (n=6)

真菌毒素Mycotoxin10μg·kg-1回收率Recoveryrate/%RSD/%30μg·kg-1回收率Recoveryrate/%RSD/%50μg·kg-1回收率Recoveryrate/%RSD/%AFTB190.43.5190.83.2591.33.08AFTB291.24.3191.54.4292.83.94AFTG189.54.5890.14.4391.24.03AFTG290.33.2492.43.7492.22.45T-284.24.1286.34.3788.63.85HT-284.63.5485.14.2088.73.62NIV86.42.5288.93.5791.52.58FB194.53.6396.03.54102.74.24FB291.14.2593.84.3295.24.78FB391.23.6892.13.7194.54.30DON90.34.2591.54.0894.13.513-AcDON91.33.6292.03.1693.33.6215-AcDON87.54.2689.14.0690.24.42ZEN92.62.8694.72.5897.33.05ST87.34.0387.94.2389.54.07OTA92.53.2595.62.1895.32.84
表4 准确度数据
Table4Accuracy data

μg·kg-1
2.7 实际样品检测
174件普洱茶样品中有4种真菌毒素检出,其余为未检出,检出的项目分别为雪腐镰刀菌烯醇、伏马毒素B1、伏马毒素B2、伏马毒素B3,4种真菌毒素的检测值范围为0.2~6.0 μg·kg-1,所检测的普洱茶样品的总检出率为6.21%,根据食品安全国家标准食品中真菌毒素限量标准[21]以及部分国家的标准的限量要求[22],普洱茶中虽有真菌毒素检出,但都符合限量标准要求,说明普洱茶可以放心饮用,真菌毒素含量检出情况见表5。
2.8 样品确认
由于茶叶中基质较为复杂,普通的样品净化方式杂质引入较多,对目标化合物存在较大的干扰,甚至出现假阳性结果,因此,确认样品时,样品的定性定量离子、离子对相对丰度比及保留时间均应与标准溶液进行比较,确认是否与标准品一致。
表5 真菌毒素含量检出详情
Table5Detecting details of mycotoxins content
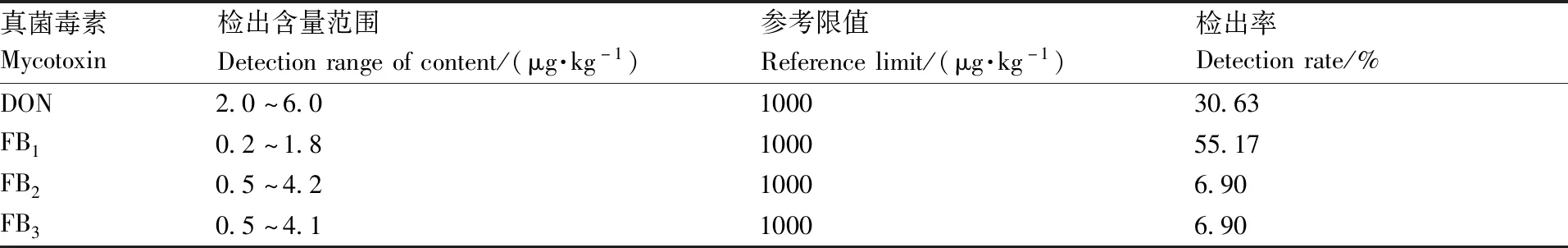
真菌毒素Mycotoxin检出含量范围Detectionrangeofcontent/(μg·kg-1)参考限值Referencelimit/(μg·kg-1)检出率Detectionrate/%DON2.0~6.0100030.63FB10.2~1.8100055.17FB20.5~4.210006.90FB30.5~4.110006.90
3 结论
本实验采取甲醇水提取,通过免疫亲和柱净化,建立了用LC-MS/MS同时检测普洱茶叶中多种真菌毒素的方法,具有较便捷的前处理条件、较好的净化效果、良好的加标回收率、较高的准确度等特点,实际样品检测数据表明,该方法可以满足普洱茶中多种真菌毒素同时检测分析,可应用于茶叶特别是大批量样品中多种真菌毒素的快速检测。

