let7a在非小细胞肺癌顺铂耐药中的作用及相关机制研究
彭微 刘求梅 刘洁 袁桂
412000湖南中医药高等专科学校基础医学部,湖南 长沙
肺癌在我国城市人口恶性肿瘤死亡原因排在第一位,发病率与死亡率呈逐年上升趋势。肺癌可以分为非小细胞肺癌和小细胞肺癌两大类[1]。非小细胞肺癌可分为鳞癌、腺癌、大细胞癌,约占总体的80%。非小细胞肺癌与小细胞肺癌相比,癌细胞生长分裂比较慢,扩散转移相对较晚,因而大多数非小细胞肺癌患者就诊时已经是晚期,失去手术的机会。对于晚期不能手术的患者,首选采用铂类药物治疗。尽管非小细胞肺癌的早期诊断和治疗已经取得了一定的成就,但是目前5年生存率仍≤15%,即使早期发现,复发率仍旧很高[2],并且在治疗中细胞易对铂类药物产生耐药性。本文就let7a在非小细胞肺癌顺铂耐药中的作用及相关机制报告如下。
资料与方法
A549 与A549/DDP 细胞均采用含10%胎牛血清、100 μg/mL 链霉素和100 IU/mL青霉素的双抗1640培养基,放置于饱和适度85%、37℃、5%CO2条件下培养。其中A549/DDP 培养基中含有2 μg/mL 的顺铂以维持细胞耐药性。所选取的实验细胞均处于对数生长期。
方法:将A549 和A549/DDP 细胞分别接种于含5 mL 1640完全培养基的培养瓶中,待细胞生长到85%融合时,提取总RNA。A549 细胞在转染前24 h 按1.5×105的细胞数接种到6 孔细培养板中,生长到80%左右转染,并对处理前后A549 和A549/DDP 细胞let7a 表达水平进行PCR 验证。分别用lipofectamine RNAimax对Let7a抑制物和阴性对照组进行转染,采用细胞计数试剂盒(cck-8),将细胞接种至试剂盒的96 孔板内,2 500~3 500/孔,细胞与壁贴合24 h 后每孔均 加入100 μL 含DDP 的1640 培 养基,A549 细胞系DDP 浓度为0.25、0.5、0.75、 1.0、 1.25、 1.5、 2.0 μ g/mL,A549/DDP 细胞系浓度梯度为2.4、4.0、6.0、8.0、10.0、12.0、16.0 μg/mL。同时设置对照组为孔板只加入单细胞悬液。酶标检测仪检测450 nm 波长的吸收值,并计算细胞的ic50。取对数生长期的细胞制成单细胞悬液,并将其在孔板中进行稀释,使细胞均匀分布。置于饱和适度85%、37℃、5% CO2条件下培养,待出现肉眼可见的克隆时,终止培养,进行计数克隆。流式细胞检测:将A549 和A549/DDP 单细胞悬液分别接种在6 孔板中,转染并且加药维持培养,当细胞长满时,消化成单细胞悬液,离心、漂洗后染色上机分析细胞凋亡率(凋亡率=早起凋亡率+晚期凋亡率)。实验均重复3次,避免存在偶然性。
观察指标:记录分析细胞凋亡率、克隆集落数量、细胞增殖情况、细胞存活情况、ic50。
统计学方法:数据应用SPSS 18.0 软件分析;计数资料以[n(%)]表示,采用χ2检验;计量资料以(±s)表示,采用t检验;参数之间相关性采用直线相关分析。P<0.05为差异有统计学意义。
结 果
通过分析比较细胞凋亡率:A549 转染let7a 抑制物后,细胞凋亡率明显低于对照组,差异有统计学意义(P<0.05);A549/DDP转染let7a抑制物后,细胞凋亡率明显高于对照组,差异有统计学意义(P<0.05)。见表1。
分析比较细胞ic50 值:A549 转染let7a 后抑制物后细胞ic50 值增高,差异有统计学意义(P<0.05);表示A549 对顺铂的敏感性下降,耐顺铂性增加;A549/DDP 转染let7a 后细胞ic50 值降低,差异有统计学意义(P<0.05);表示A549/DDP对顺铂的敏感性增加,顺铂耐药性降低。见表2。
表1 A549与A549/DDP转染后细胞凋亡率比较(±s,%)

表1 A549与A549/DDP转染后细胞凋亡率比较(±s,%)
组别 凋亡率转染前 转染后A549 11.4±0.8 3.5±0.6 A549/DDP 12.1±1.1 14.2±1.3对照组 12.3±1.4 11.2±0.9 P<0.05 <0.05
表2 A549与A549/DDP转染前后细胞的ic50对比(±s)
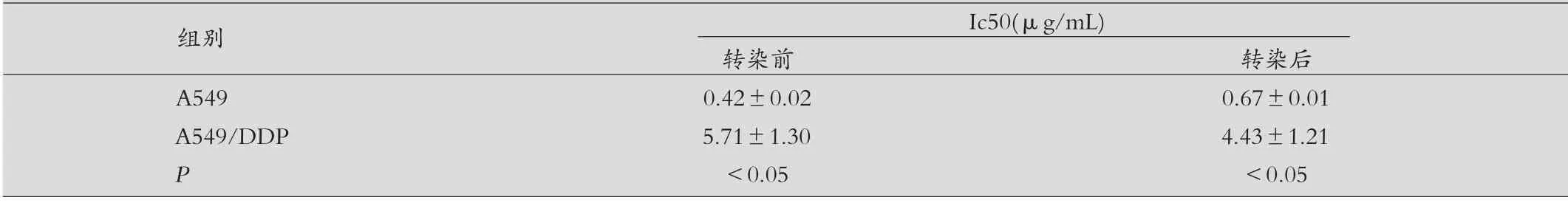
表2 A549与A549/DDP转染前后细胞的ic50对比(±s)
组别 Ic50(μg/mL)转染前 转染后A549 0.42±0.02 0.67±0.01 A549/DDP 5.71±1.30 4.43±1.21 P<0.05 <0.05
实时荧光定量PCR 检测转染前后细胞株let7a 表达结果:A549 细胞和A549/DDP 细胞总RNA 经提取后,经紫外分光光度检测其纯度。结果A260/A280 的比值为1.58 和1.55,说明总RNA 纯度较高。RT-PCR 检测转染前后let7a 在NSCLC 细胞株的表达结果显示,转染后let7a在A549/DDP细胞中的表达水平显著低于在A549 中的表达水平,A549/DDP细胞表达水平是A549 细胞的(25.54±2.90)%,差异有统计学意义(P<0.05)。
讨 论
肺癌居我国恶性癌症发生率的榜首,发病率、死亡率均逐年升高,肺癌中又以非小细胞肺癌最为多见,占肺癌发生的80%[3]。非小细胞肺癌早期症状并不典型,主要表现为胸部胀痛、低热、反复咳嗽,易与呼吸道疾病混淆,故患者常忽略症状,待发现时癌细胞已向其他器官扩散,错过治疗的最佳时机。
临床上现用于治疗非小细胞肺癌的药物主要为铂类药物,包括一代顺铂,二代卡铂、奈达铂、环铂,三代奥沙利铂、洛铂[4]。顺铂是多种实体瘤的一线用药,是化疗药物中高效高毒的典范,居化疗药物第一位,疗效客观,抗癌谱广。顺铂是铂的无机金属络合物,顺铂进入细胞后与氯离子发生水合,增加了对靶细胞的攻击性,通过与细胞核DNA碱基的结合,破坏DNA 基本结构,导致DNA 不能进行正常的复制,抑制细胞的增殖。有相关研究表明,顺铂还可以诱导细胞产生ROS,浓度的增高,会氧化细胞,破坏其正常的生物学功能[5]。顺铂药物在使用前期治疗效果非常好,但是后期容易产生继发性耐药,导致相同剂量的顺铂治疗效果不佳,但是增加剂量又会对多个脏器产生严重的毒性,包括肾毒性、消化道反应、耳毒性、骨髓抑制等。因而如何降低顺铂药物继发性耐药是我们未来亟需解决的问题[6]。
Let7 是2000年Reinhart 在秀丽隐杆线虫中发现的一种微小RNA(miRNA),是一个具有茎环折叠结构的核苷酸前体分子,具有高度的时序性、保守性和特异性,一共存在13 种家族[7]。在调节肿瘤细胞基因表达上起着重要的作用。Let7可以作为肿瘤诊断标记物之一,也可以在治疗、用药、预后等方面作为参考标准。在不同的肿瘤中let7发挥作用不同,目前在非小型肺癌中主要参考let7a。let7a重点应用于对肺癌的早期诊断与治疗[8]。已有相关研究表明,let7a 的高表达可以增强肿瘤细胞对药物的敏感性,减少大剂量药物对正常细胞的杀伤性。Let7a在肺癌早期即能检测到其表达水平的降低,并在治疗过程中发挥对肿瘤的抑制作用,并增加对药物的敏感性[9]。
本研究中,通过对比A549 与A549/DDP 转染前后let7a 表达现象以及细胞的增殖能力和细胞克隆数目可得出,A549内let7a低表达会导致A549细胞ic50值升高,对顺铂的敏感性下降,A549 产生耐药性。A549/DDP 内let7a 高表达会导致A549/DDP细胞ic50值下降,对顺铂的敏感性增加。在细胞平台克隆实验中,A549/DDP的let7a高表达会使细胞克隆数减少,细胞增殖能力降低;而A549 中let7a 的低表达会使细胞克隆数增加,细胞增殖能力增加。上述结果证明let7a 作为抑癌基因,其表达水平能够影响细胞的增殖、凋亡以及顺铂的耐药性。
综上所述,let7a 在非小细胞肺癌顺铂耐药中可能起着非常关键的作用。let7a 有可能成为肺癌治疗的介入靶点,为肺癌的治疗提供全新用药模式,也为研究非小细胞肺癌顺铂耐药中的作用及相关机制提供了新的思路和途径。

