暗纹东方鲀抗苗勒氏管激素Ⅱ型受体基因的克隆、生物信息学及表达分析
高莹莹,胡 鹏,刘新富,黄 滨,刘 滨
(1.中国水产科学研究院黄海水产研究所,山东青岛 266071;2.上海海洋大学水产与生命学院,上海 201306;3.内江师范学院,四川内江 641100)
暗纹东方鲀(Takifugu obscurus)又名河鲀,是我国长江中下游地区重要淡水养殖种类,其营养价值丰富、肉质鲜美,名列长江“四大名鱼”之首。过去因受国内市场禁止销售的限制,大多数养殖河鲀以出口贸易的方式进行销售,因此养殖产量多年以来一直在10 000 t左右徘徊[1],但随着人工养殖技术的不断优化,养殖规模越来越大,2015年养殖产量首次突破23 000 t[2]。2016年9月农业部办公厅和国家食品药品监督管理总局联合发布《关于有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀加工经营的通知》,解除了自1990年开始实施的暗纹东方鲀不准市场流通的禁令,国内市场的开放为暗纹东方鲀产业的二次创业和可持续发展提供了新的契机。
暗纹东方鲀雌雄个体体长生长规律相似,但在2.5龄前雄鱼体质量生长速度大于雌鱼[3],且雄鱼精巢被认为是难得的珍贵食材,有“西施乳”的美誉。一对精巢的价值甚至超过雄鱼本身,养殖全雄苗种的利润是养殖普通苗种的1.5倍以上。因此,生产和养殖全雄暗纹东方鲀,可以大幅度提高我国暗纹东方鲀的养殖经济效益。但目前有关暗纹东方鲀的性别调控机制及其性控技术的研究还较少。
抗苗勒氏管激素Ⅱ型受体(anti-Müllerian hormone receptorⅡ,Amhr2)基因属于 β-转化生长因子(transforming growth factor-β,TGF-β)超家族成员,其编码的是一种丝氨酸/苏氨酸激酶受体。Amhr2在抗苗勒氏管激素(anti-Müllerian hormone,Amh)信号传递通路中起到关键的介导作用[4-6],Amh只有与具有丝氨酸/苏氨酸激酶活性的Amhr2结合后才能进一步结合并激活下游信号Smad蛋白,从而发挥生理功能[6-7],如在哺乳动物中参与早期性别决定和性别分化的调控 等 过 程[4,8-9],在 日 本 鳗 鲡 (Anguilla japonica)[10]、青 鳉 (Oryzias latipes)[11]和 黑 鲷(Sparus macrocephlus)[12]等鱼类中通过抑制生殖细胞增殖和类固醇激素的合成等过程参与性腺的发育。在红鳍东方鲀(Takifugu rubripes)的研究中进一步发现,amhr2基因激酶结构域中的一个SNP位点与其性别决定相关,雌性个体为纯合子 (His/His384),雄 性 个 体 为 杂 合 子 (His/Asp384)[13]。本课题组前期研究也发现,暗纹东方鲀amhr2基因同样存在一个类似的与性别相关的SNP位点,并据此建立了暗纹东方鲀的雌雄幼鱼性别鉴定技术[14]。金武等[15]的研究也证实了在暗纹东方鲀1龄成鱼的amhr2中,该SNP位点与性别表型存在显著的相关性,雌性个体基因型为纯合子CC,雄性个体基因型为杂合子CG。在此基础上,本实验以暗纹东方鲀为研究对象,应用RACE克隆技术,克隆得到amhr2的全长cDNA序列,并通过对暗纹东方鲀amhr2基因的序列结构、相关生物信息学特征及不同组织和不同发育期中mRNA表达情况的研究,为进一步研究其功能奠定基础,同时为暗纹东方鲀性别调控过程中的分子机制研究提供参考依据。
1 材料与方法
1.1 实验材料
实验用暗纹东方鲀样本来源于江苏省南通市中洋集团股份有限公司,暗纹东方鲀亲鱼促熟培育后,采用LHRHa催产,人工授精获得受精卵,受精卵在17.5~18.5℃水温孵化7 d后,将孵化的仔鱼布池培育,培育水温为18.0~22.0℃。采用车间内循环水系统养殖,每日投喂2~3次,水温为22~26℃。分别采集孵化后60、90、120、150日龄幼鱼,每个日龄各取3尾鱼,体长分别为(7.2±0.8)cm、(8.5±0.6)cm、(10.3±0.9)cm和(14.4±1.1)cm,分别剖取卵巢和精巢组织,保存在RNA Store液中备用,另外每个个体(或每尾鱼)取少量肌肉组织,-20℃冷冻保存,用于DNA提取。
此外,随机选取1龄雌鱼和雄鱼各3尾,分别剖取下丘脑 、脑、垂体、性腺、心脏、肝脏 、胆、胃、肠、肌肉、眼等组织,保存在RNA Store液中备用。
1.2 暗纹东方鲀遗传性别鉴定
采用天根TIANamp Marine Animals DNA kit提取样品肌肉的基因组DNA,利用NanoDrop2000超微量分光光度计测量DNA的浓度和OD260/OD280比值,1.0%琼脂糖电泳检测DNA的完整性。根据暗纹东方鲀amhr2激酶结构域内存在一个与性别连锁的错义突变SNP位点,分别设计了扩增雌雄性别差异基因序列的引物和含有针对SNP位点的错配碱基的下游PCR引物,上游引物为 5′-GATGTTCCGCCATCCTGCATTC-3′,下游引 物 为 5′-CTGCCTGCTGCACAGAGCACCTG-3′,含错配碱基的下游引物为 5′-GATACCATTTGTTGTGAAACTC-3′,采用双重 PCR方法鉴定暗纹东方鲀幼鱼的遗传性别,其中第一轮PCR扩增得到的基因片段送至上海生工生物工程有限公司进行测序,第二轮PCR产物经过琼脂糖凝胶电泳后,雄性个体在270 bp处出现条带,而雌性个体不存在条带(图1),以此来判断各个样品的遗传性别。
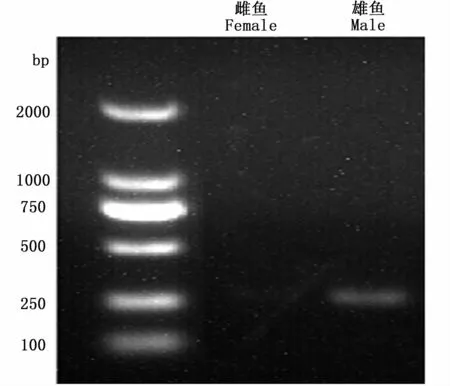
图1 暗纹东方鲀PCR产物的电泳图Fig.1 The electrophoresis of PCR products in T.obscures
1.3 暗纹东方鲀amhr2全长cDNA序列的克隆
提取精巢组织总RNA,琼脂糖凝胶电泳检测总RNA的完整性,NanoDrop2000超微量分光光度计测量RNA的浓度。根据已知鱼类amhr2的保守序列,利用DNAMAN软件设计扩增引物,上游 引 物 为 5′-GGCTACCAGAGAAGCTACAAC-3′,下游引物为 5′-TCCCAGCTCAGAGACAGATGGC-3′,克隆得到暗纹东方鲀amhr2基因的核心片断序列。根据获得的片段设计特异性引物,5′-RACE 的 特 异 性 引 物 为 5′-TCCCAGCTCAGAGACAGATGGC-3′, 5′-TGGACTGGATGGCAACAATCA-3′,3′-RACE的特异性引物为 5′-GATGTTCCGCCTTCCTGCATTC-3′,5′-ACGTTGCGCTACATGTCCCCTG-3′,进行全长序列扩增。PCR产物进行琼脂糖凝胶电泳,根据胶回收试剂盒(天根,北京)说明书对目的条带切胶后进行纯化回收。切胶回收的PCR产物与pEASY-T3载体(全式金生物,北京)连接,采用热激法将5μL连接产物转化至20μL Trans1-T1感受态细胞(全式金生物,北京),在含氨苄的LB固体培养基中,37℃过夜培养,挑取单一克隆菌落继续培养2 h。菌液PCR鉴定后,将含有目的条带的菌液送至上海生工生物工程有限公司测序。
采用DNAstar软件将5′-RACE、保守片段和3′-RACE的测序结果进行拼接,获得暗纹东方鲀amhr2基因的cDNA全长序列。
1.4 暗纹东方鲀Amhr2序列分析
采用BLAST程序对获得的全长序列进行同源性分析并推断其开放阅读框序列;借助ExPASy ProtParam工具推断Amhr2蛋白质的基本理化性质,包括相对分子质量、等电点、氨基酸组成和总平均亲水性等;利用PSORTⅡ Prediction工具定位蛋白质的亚细胞;利用SignalIP 4.1程序预测信号肽结构;利用NetPhos 3.1 Server程序预测磷酸化位点;利用NetNGlyc 1.0程序预测糖基化位点;采用ExPASy ProtScale工具分析Amhr2蛋白质的疏水性;采用TMHMM Server 2.0工具分析跨膜区;采用SMART和PROSITE工具分别分析氨基酸序列的保守结构域及其功能域位点;借助SOPMA和SWISS-ODLE工具分别预测Amhr2蛋白质的二级结构和三级结构。使用DNAMAN软件进行编码蛋白质的氨基酸多重序列比对分析;利用MEGA 5.1软件基于邻位相接法(1 000 runs)构建系统进化树。
1.5 暗纹东方鲀amhr2基因表达分析
采用Real-Time PCR方法检测amhr2在暗纹东方鲀雌鱼和雄鱼不同组织和不同发育期性腺组织中的表达量。取出RNA Store保存液中保存的雌鱼和雄鱼各组织及不同发育期的性腺组织,提取总RNA,反转录生成第一链cDNA。设计特异 性 引 物, 上 游 引 物 为 5′-GTGCTTGTGAGAGCCGATG-3′,下游 引 物 为 5′-AACTGATGCCGTGGAGGAG-3′,以第一链 cDNA稀释梯度作模板,β-actin作内参基因,内参基因上游引物为 5′-CAGGGAGAAGATGACCCAGA-3′,下游引物为 5′-CATCACCAGAGTCCATGACG-3′,做模板cDNA稀释倍数的标准曲线,寻找最佳模板稀释倍数,随后以最佳稀释倍数cDNA为模板,检测amhr2在暗纹东方鲀雌鱼和雄鱼不同组织和不同发育期中的表达变化。实验步骤参照SYBR®Premix Ex TaqTM(TaKaRa)试剂盒实验操作说明,在Line Gene 9600型实时荧光定量PCR仪上进行。
实时荧光定量PCR获得一系列CT值,数据分析采用2-ΔΔCT法,用 SPSS 16.0软件进行数据的统计分析,分析方法为单因素方差分析,即当P<0.05时为差异显著,结果表示为平均值±标准误。
2 结果与分析
2.1 暗纹东方鲀amhr2基因全长cDNA序列克隆
通过PCR反应得到336 bp长度的CDS片段,采用RACE技术获得暗纹东方鲀amhr2基因的5′和3′序列,序列拼接后得到 1 868 bp的cDNA全长序列。此序列编码513个氨基酸,包括5′非编码区133 bp和3′非编码区193 bp,开放阅读框1 542 bp(图2)。且雄性个体amhr2H384是一个SNP位点,在第384位氨基酸处由组氨酸突变为天冬氨酸,位于激酶结构域内(图3)。预测的蛋白相对分子量为56.87 Ku,等电点为6.73,分子式为C2497H3952N706O753S30。成熟蛋白质中含有带负电荷的酸性氨基酸(Asp+Glu)和带正电荷的碱性氨基酸(Arg+Lys)分别为52和49个。不稳定系数为52.14,属于不稳定蛋白。GRAVY(grand average of hydropathicity)为 -0.118,属于亲水性蛋白。
2.2 暗纹东方鲀Amhr2蛋白质的结构特征及功能预测
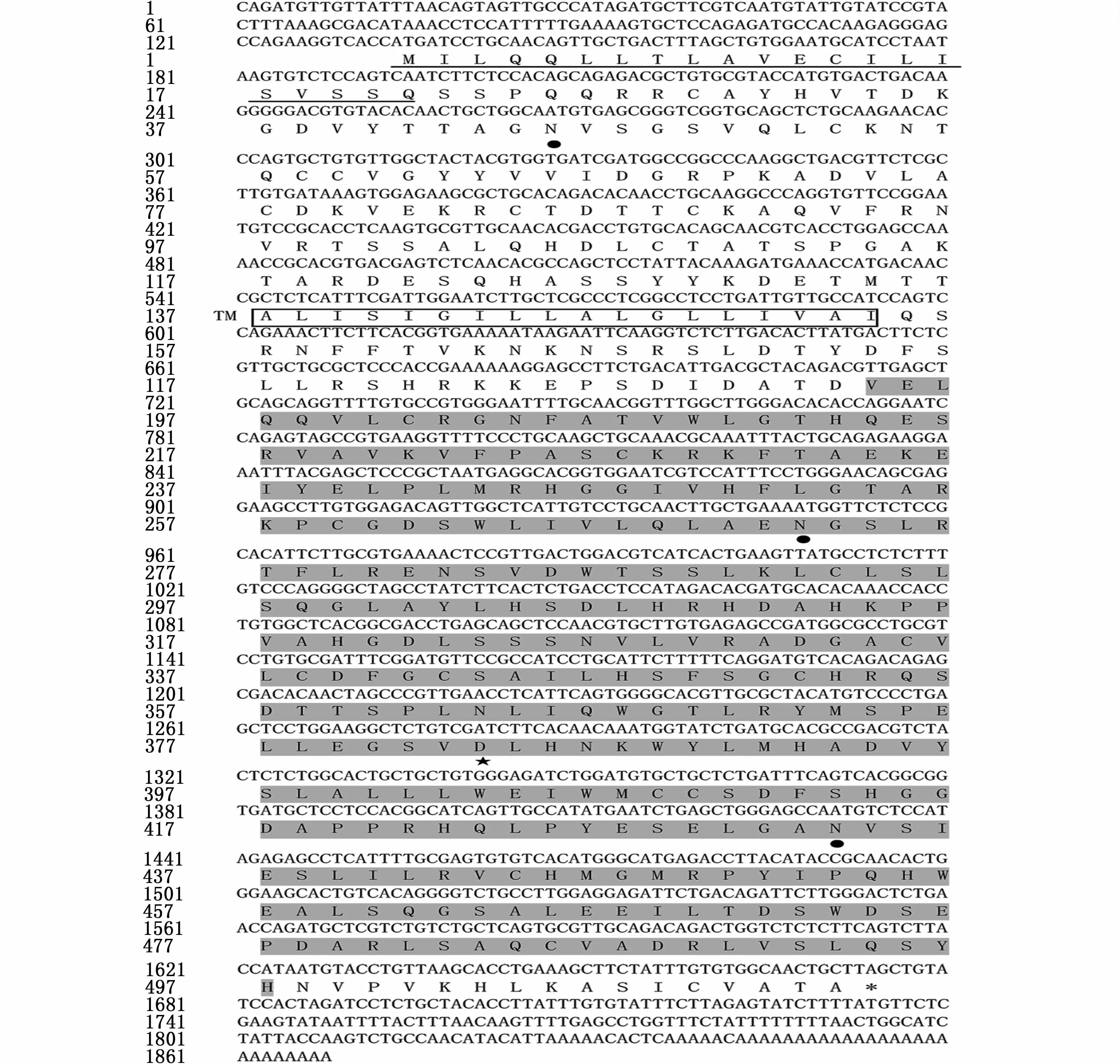
图2 暗纹东方鲀amhr2基因cDNA及其编码的氨基酸序列Fig.2 The cDNA sequence and deduced amino acid sequence of amhr2 gene in T.obscures
亚细胞定位结果发现,Amhr2蛋白质定位于内质网、高尔基体、线粒体、分泌系统小泡、细胞膜、细胞外(包括细胞壁)的概率分别为44.4%、11.1%、11.1%、11.1%、11.1%、11.1%,由此可推测Amhr2蛋白质最有可能定位于内质网,属于分泌蛋白。信号肽预测结果显示,Amhr2蛋白质在近N-端含有长度为21个氨基酸(1aa~21aa)的信号肽结构(图4-a)。糖基化位点预测的结果表明,其可能存在3个潜在的N-糖基化位点。磷酸化位点预测的结果表明,43个丝氨酸(Ser)、16个苏氨酸(Thr)和8个酪氨酸(Tyr)可能会成为蛋白激酶磷酸化的位点。疏水性预测结果显示,Amhr2蛋白质在100~200氨基酸处含有1个典型的疏水性区域。跨膜区结构预测结果显示,该蛋白在137~154氨基酸处含有1个跨膜结构域,1~136位氨基酸在胞内,155~513位氨基酸在胞外(图4-b)。
保守结构域预测结果表明,Amhr2蛋白在1~21、137~154和194~490氨基酸残基处分别存在信号肽、跨膜区域和STYKc保守结构域(图5-a)。功能域预测结果表明,194~497氨基酸残基处为蛋白激酶区域;200~208氨基酸处为核苷酸磷酸盐结合位点;221位氨基酸为ATP配体结合位点;321位氨基酸为质子受体活性位点(图5-b)。
二级结构预测结果显示,Amhr2二级结构中α-螺旋(h)占38.40%,β-折叠(e)占 14.81%,β-转角(t)占 5.46%,无规卷曲(c)占 41.33%(图6),这种二级结构组成可使得Amhr2蛋白的构象多样化。三级结构同源建模分析结果显示,建模范围为188~498位氨基酸,覆盖率为60%,这表明该结构域的保守性比较高。由于到目前为止数据库中还没有其他物种Amhr2蛋白的三维模型,因此将暗纹东方鲀Amhr2蛋白的三维模型(图7-a)与属于同一家族的人骨形态发生蛋白BMPR2的三维模型(图7-b)相比较,发现其构型比较相似,这说明Amhr2具有类似于BMPR2构型的三级结构,且在不同的物种中具有保守性。
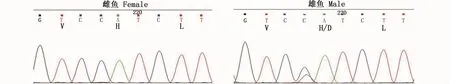
图3 暗纹东方鲀PCR产物的测序峰图Fig.3 The PCR product sequencing peak figures of T.obscures
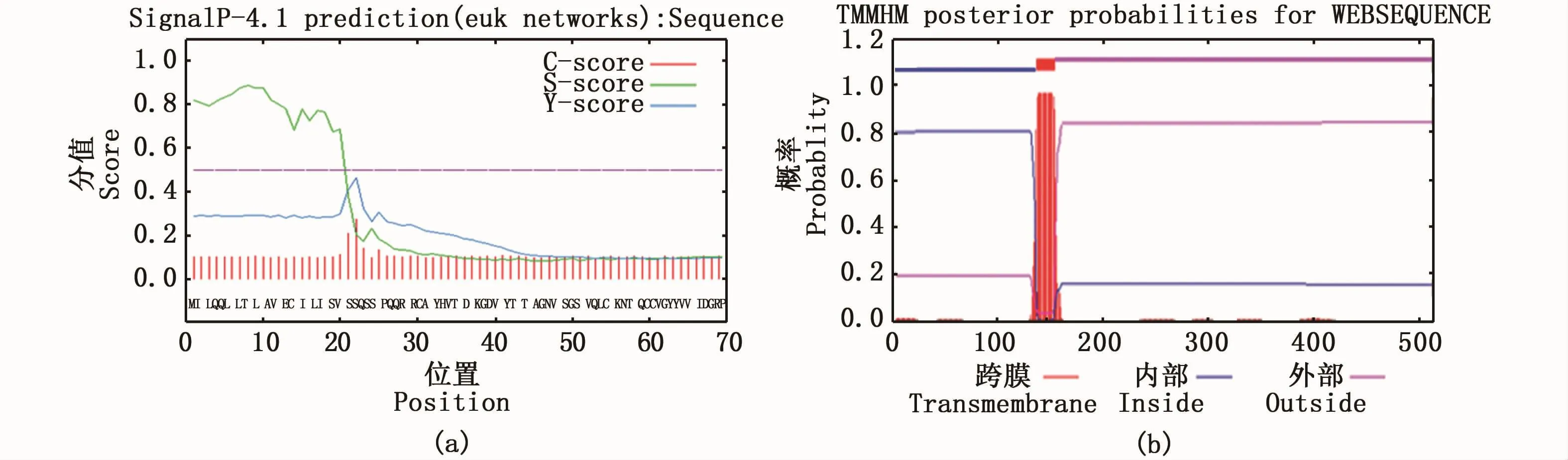
图4 暗纹东方鲀Amhr2蛋白质的信号肽剪切位点(a)和跨膜区域(b)Fig.4 Signal peptide splice site(a)and transmembrane region(b)of Amhr2 protein in T.obscures
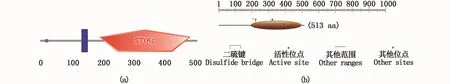
图5 暗纹东方鲀Amhr2蛋白质的保守结构区域(a)和功能域(b)Fig.5 Amhr2 protein conserved domain(a)and functional domain(b)in T.obscures
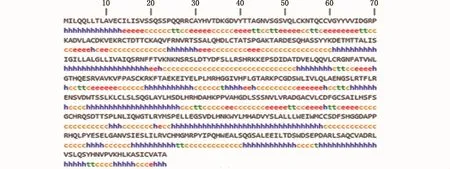
图6 暗纹东方鲀Amhr2蛋白质的二级结构Fig.6 Secondary structure of Amhr2 protein in T.obscures
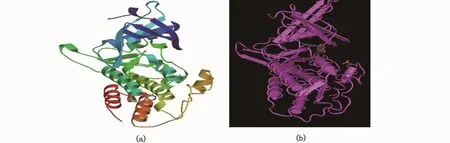
图7 暗纹东方鲀Amhr2蛋白质(a)和人类BMPR2蛋白质(b)的三级结构模型Fig.7 Amhr2 protein of T.obscures(a)and BMPR2 protein of Homo sapiens(b)tertiary structure
2.3 暗纹东方鲀amhr2基因的同源性分析及系统发育分析
登录NCBI数据库,将暗纹东方鲀amhr2的核苷酸序列与已知鱼类的序列进行BLAST比对,结果显示暗纹东方鲀amhr2与红鳍东方鲀(GeneBank: NM_001280009.1)、舌 齿 鲈(Dicentrarchus labrax,GeneBank:JQ801443.1)和青鳉(GeneBank:NM_001104896.1)的相似度分别为99%、73%和69%,这说明克隆得到的序列是amhr2基因。同时利用DNAMAN软件对暗纹东方鲀amhr2编码的氨基酸序列与GeneBank上其他8种动物的序列进行氨基酸多重序列比对与分析,结果发现近C-末端区域内的氨基酸序列比较保守,这表明此区域可能与amhr2生理功能的发挥有关(图8)。根据暗纹东方鲀和其他物种的Amhr2氨基酸序列进行系统发育分析,结果表明,系统进化树可分为两个大支:哺乳类聚为一大支,所有鱼类聚为另一大支,其中暗纹东方鲀位于鱼类这个分支中,且与红鳍东方鲀紧密聚为一个小分支,亲缘关系最近,与人和鼠等较高等脊椎动物的亲缘关系最远,这表明暗纹东方鲀amhr2基因的系统进化地位与传统的物种进化基本一致(图9)。
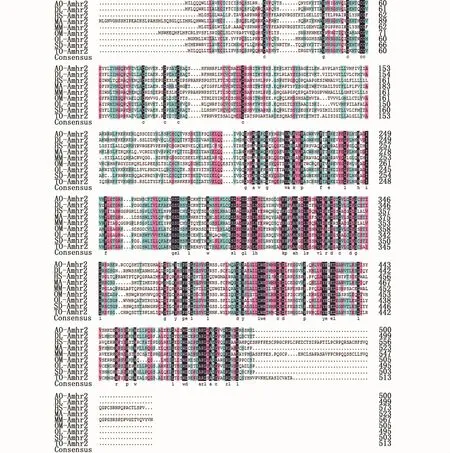
图8 暗纹东方鲀Amhr2与其他物种氨基酸序列比对图Fig.8 Multiple alignment of the deduced amino acid sequence of T.obscures Amhr2 with the corresponding sequences from other species

图9 不同物种Amhr2氨基酸序列的系统进化树Fig.9 Phylogenetic tree of Amhr2 amino acid sequence from different species
2.4 暗纹东方鲀amhr2基因的表达特征分析
本研究对暗纹东方鲀amhr2的组织表达分析发现,amhr2仅在性腺中表达,与其他组织有显著性差异(P<0.05),且卵巢中的表达量明显高于精巢(图10)。进一步对不同发育期性腺中amhr2的表达水平进行分析,结果表明,amhr2的表达量在幼鱼不同发育期精巢和卵巢中均呈现出先降低再迅速升高的表达趋势,不同之处在于体长为60日龄和120日龄时精巢中amhr2的表达量大于卵巢中的表达量,90日龄和150日龄时的情况则相反(图11)。
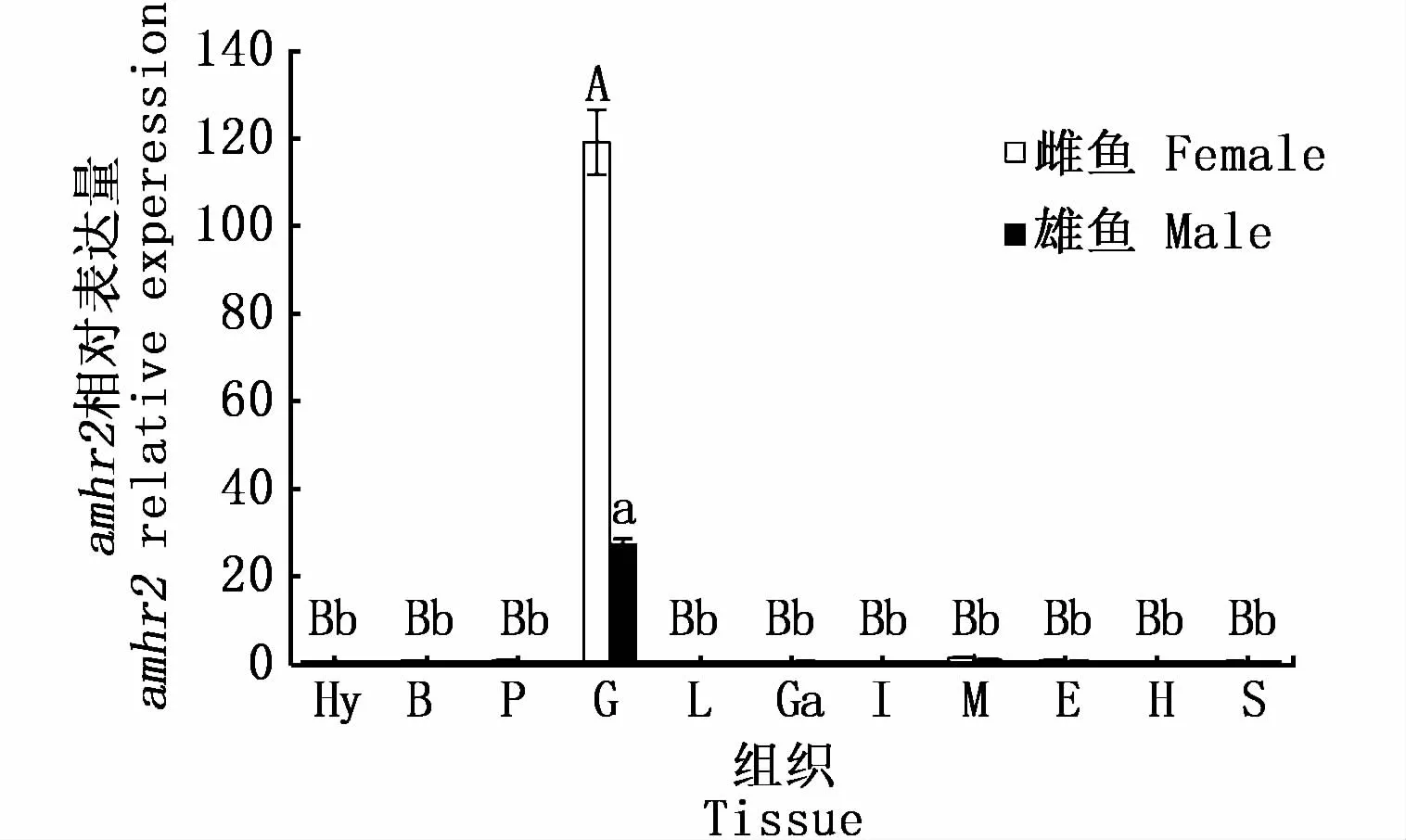
图10 暗纹东方鲀amhr2在不同组织中的相对表达Fig.10 Relative expression of amhr2 in different tissues of T.obscures

图11 暗纹东方鲀amhr2基因在不同发育期性腺组织的相对表达Fig.11 Relative expression of amhr2 in gonad tissues at different developmental stages of T.obscurus
3 讨论
3.1 暗纹东方鲀Amhr2蛋白的功能域分析
Amhr2是 β-转化生长因子(TGF-β)超家族的Ⅱ型受体,包含一个结合Amh的N末端胞外结构域(ECD)、跨膜结构域和具有丝氨酸/苏氨酸激酶活性的胞内结构域[16]。Amh信号通路在雄性性别分化过程中发挥着十分重要的作用,主要通过具有丝氨酸/苏氨酸激酶活性的两种类型的受体(Ⅰ型和Ⅱ型受体)及两种细胞质效应物R-Smads(受体调节型蛋白Smads)和Smad4(普通型蛋白Smad)调控靶器官、组织和细胞的发育、分化以及凋亡等生物学过程[7]。其作用机理是Amhr2与配体Amh结合后,结合并磷酸化I型受体,进一步激活下游信号R-Smads蛋白,使得RSmads蛋白发生磷酸化并与Smad4蛋白相互作用,形成异源寡聚体,将Amh信号转导至核内,与靶基因启动子上的Smad结合元件(SBE)结合,从而调节哺乳动物下游基因的转录[16-20]。据报道,Amh/Amhr2信号通路可能存在两种决定性别的调控机制,一种机制是通过减少生殖细胞的数量,来促进睾丸的发育[21],与这一假设相一致的是高温诱导的河豚生殖细胞退化与卵巢体细胞的雄性化有关[22];另一种机制是对芳香化酶活性产生拮抗作用[23],众所周知芳香化酶是一种雌性激素合成酶,对鱼类卵巢分化具有十分重要的作用,因此,Amh/Amhr2信号通路抑制芳香化酶活性可能导致河豚的睾丸形成。经过本研究的生物信息学分析,暗纹东方鲀的Amhr2蛋白含有一个十分保守的STYKc蛋白激酶结构域(serine/threonine/tyrosine protein kinase domain),位于第194~497位氨基酸残基处,在此结构域内含有23个丝氨酸、6个苏氨酸和3个酪氨酸磷酸化位点以及2个潜在的N-糖基化位点,200~208氨基酸处为核苷酸磷酸盐结合位点,221位氨基酸为ATP配体结合位点,321位氨基酸为质子受体活性位点,383位氨基酸为性别相关SNP位点,这些位点构成了STYKc蛋白激酶结构域的功能元件,可能使amhr2基因的STYKc蛋白激酶结构域在Amhr2与配体Amh结合的过程中发挥重要的作用,从而调控暗纹东方鲀性别分化和性别特征维持的过程。目前为止尚未有文献报道过STYKc蛋白激酶结构域的作用机制,这需要更进一步的探索和研究。
3.2 暗纹东方鲀amhr2基因的表达分析
通常情况下,目的基因的组织表达模式能够在一定程度上反映该基因的生物学功能。据报道,amhr2位于睾丸的支持细胞(sertoli cells)和卵巢的颗粒细胞上,主要在胚胎发育时期苗勒氏管周围的间质细胞、胎儿性腺的管状和卵泡结构以及成人睾丸的支持细胞和间质细胞中表达[24-28];Amh/Amhr2信号通路参与卵巢中卵泡发育的关键性阶段[29];amhr2可能在雄性黄颡鱼(Pelteobagrus fulvidraco)的性腺发育过程中发挥重大作用[30],这说明 amhr2基因可能在胚胎发育、性别分化、性腺发育和性别特征维持过程中发挥重要的作用。本研究使用荧光定量PCR法检测了暗纹东方鲀amhr2基因的组织表达谱,结果发现amhr2的表达模式具有组织特异性,即无论是在雄鱼还是在雌鱼中,amhr2仅在性腺中表达,且卵巢中的表达量远远高于精巢中的表达量,这说明amhr2主要在性腺中发挥作用。据报道在金钱鱼(Scatophagus argus)[16]、日本青鳉[31]和尼罗罗非鱼[32]中amhr2仅在性腺中表达,这种表达模式与暗纹东方鲀的表达模式相同,唯一不同的是,amhr2在这些鱼类精巢中的表达量明显高于卵巢中的表达量,这种表达模式与黑鲷性腺分化期的表达结果一致[33];而高长富[4]的研究结果表明,红鳍东方鲀amhr2基因在卵巢中的表达量最高,约为精巢表达量的40倍,故此推断amhr2在不同鱼类性腺中的表达差异可能与鱼的种类和发育期有关。进一步对暗纹东方鲀不同发育期性腺中amhr2的表达水平进行分析,结果表明暗纹东方鲀amhr2在幼鱼不同发育期精巢和卵巢中的表达量均呈现出先降低再迅速升高的趋势,且在60日龄和120日龄时卵巢amhr2的表达量低于精巢,而90日龄和150日龄时卵巢amhr2的表达量则高于精巢,这种情况与红鳍东方鲀中的报道结果相似,红鳍东方鲀在23~40日龄时卵巢amhr2的表达量略低于精巢,60~80日龄甚至3龄成鱼时卵巢amhr2的表达量显著高于精巢[5]。本研究中amhr2在暗纹东方鲀不同组织和不同发育期的表达谱分析显示,amhr2可能参与暗纹东方鲀的早期性腺发育及性腺生理功能的发挥等过程,但amhr2在性别分化过程中的调控机制仍需进一步研究。
综上所述,本实验首次克隆得到了暗纹东方鲀amhr2的cDNA全长序列,并利用生物信息学方法分析了其序列结构、蛋白质的结构特点、相关的生物信息学特征以及基因的表达特征,这为深入探索amhr2在暗纹东方鲀性腺发育和性别分化过程中的生物学功能奠定了重要基础,也为人工繁育中的性别控制工作提供了重要参考依据。

