22%氟虫腈悬浮种衣剂在玉米和土壤中的残留动态
朱晓丹 贾春虹 赵尔成

摘要:为了评价22%氟虫腈悬浮种衣剂在玉米中的残留动态和环境安全性。2014—2015年在北京市郊区和河南省新乡市郊区进行22%氟虫腈悬浮种衣剂在玉米上的残留试验。消解动态试验结果表明,氟虫腈在玉米植株和土壤中的消解符合一级动力学方程,植株上的降解半衰期为6.6~7.5 d,土壤中的降解半衰期为20.7~24.2 d。土壤样品中能检测到代谢物氟虫腈砜和氟虫腈硫醚,玉米植株样品中没有检测到代谢物的残留。2年2地的最终残留试验结果无明显差异,收获的玉米中氟虫腈及其代谢物的残留量均低于0.01 mg/kg。
关键词:氟虫腈;代谢物;超高效液相色谱-串联质谱;玉米;土壤;残留
中图分类号: TQ450.2 文献标志码: A 文章编号:1002-1302(2019)13-0226-04
GB/T 2763—2016《食品安全国家标准 食品中农药最大残留限量》[1]中规定,氟虫腈的残留物为氟甲腈、氟虫腈砜和氟虫腈硫醚之和,以氟虫腈表示。关于氟虫腈的检测分析,蔬菜、谷物、油料和油脂作物上参照SN/T 1982—2007《进出口食品中氟虫腈残留量检测方法 气象色谱—质谱法》[2]方法,水果、糖料和食用菌则参照NY/T 1379—2007《蔬菜中334种农药及多残留的测定 气相色谱质谱法和液相色谱质谱法》[3]方法。但SN/T 1982—2007和NY/T 1379—2007仅仅规定了母体氟虫腈的检测方法,没有包含3个代谢物的测定分析。部分文献报道的气相色谱[4-7]、气质联用[8-9]、液相色谱[10-11]、液质联用[12-13],均未涉及代谢物分析。Cheng等报道了氟虫腈及其代谢物的残留检测方法,主要采用QuEChERS前处理技术,共萃取物对目标化合物的干扰较大,有较强的基质效应[14-16]。玉米样品含水量不高,玉米植株色素较多,鲜食玉米和老玉米含有较多蛋白质、脂肪等,采用复合固相萃取小柱能排除更多的杂质,减少共萃取物对目标化合物的干扰。为此,本研究利用石墨化炭黑复合乙二胺基-N-丙基固相萃取小柱净化,超高效液相色谱-串联质谱开展了玉米和土壤中氟虫腈及其代谢物的残留检测分析,并于2014—2015年,在北京市郊区、河南省新乡市郊区进行了氟虫腈22%悬浮种衣剂在玉米上的残留试验,以期为该药剂的残留风险和环境安全性评估提供科学依据。1 材料与方法
1.1 试验材料
试验农药:氟虫腈22%悬浮种衣剂,以色列马克西姆化学公司生产;试验作物:玉米,品种为郑单958。
1.2 施药方法
施药方法为玉米播前种子包衣处理,施药次数为1次。
1.3 试验时间和地点
2014—2015年的田间试验,在北京市房山区石楼镇夏村、河南省新乡市平原新区王村进行;室内分析试验由北京市农林科学院植物保护环境保护研究所农药与农田环境研究室完成。
1.4 田间试验方法
试验设计参照NY/T 788—2004《农药残留试验准则》[17]进行,分为最终残留试验和消解动态试验2个部分。试验均设空白对照区、高剂量试验区、低剂量试验区、消解动态试验区。采样方法、样品制备、储存等按照《农药登记残留田间试验标准操作规程》执行。
1.4.1 消解动态试验 在有代表性的玉米田设置试验小区,植株消解动态按300 mL/100 kg种子(75 g a.i./100 kg种子)用药。将药剂加水至药液量为10 mL/kg种子,倒入种子中充分搅拌,混匀后晾干,机械播种。玉米播种后,玉米苗长至 10 cm 高时开始动态试验样品采样,此为第1天,并在随后的第2、3、7、14、21、30、45天采集玉米植株。设对照区,每个处理3次重复,每个小区面积30 m2。随机在试验小区内6~12个采样点采集2 kg生长正常、无病害的玉米植株,切碎、混匀后,用四分法分取150 g样品2份,分别装入封口样品袋中,并外贴标签,贮存于-20 ℃冰柜中保存。小区边行和每行距离两端0.5 m内不采样。
在玉米试验的同一地块进行土壤消解动态试验。从试验田中0~15 cm取土样约30.0 kg,捣碎过筛,每0.5 kg为1份,每份加入上述处理好的种子10粒,与土充分混匀,装入牛皮纸袋中,外套80目纱网(以免纸袋破碎后土壤散落),埋入试验田中(在未处理玉米地行间挖沟埋入,让土袋四面均与土壤接触)。于埋入后每间隔6 d取样1次,共采样15次,另设空白对照。每次取3袋土,捡出种子后混匀土壤,用四分法分取100 g样品2份,分别装入封口样品袋中,并外贴标签,贮存于-20 ℃冰柜中保存。
1.4.2 最终残留试验 在有代表性的玉米田设置小区。处理剂量分别为推荐剂量200 mL/100 kg种子(50 g a.i./100 kg种子)和高剂量300 mL/100 kg种子(75 g a.i./100 kg种子),玉米播前种子包衣处理1次。每个处理设3次重复,小区面积30 m2,分别于玉米收获期前1个月(青玉米)和玉米成熟期采集玉米、植株和土壤样品。在试验小区分8~10点取青玉米或玉米8~10穗,玉米地上植株 8~10株,分別装入样本容器中包扎妥当。土壤样品于玉米行间随机取点5~10个,采集0~15 cm的耕作层土壤1 kg。同时采集玉米和土壤对照样品,样品带回实验室处理。
1.5 实验室样品制备与保存方法
田间样本在采集后8 h内运回实验室,并立即制备成实验室样品冷冻保存。植株样本剪切成1 cm以下的小段或切碎,混匀后,用四分法分别取150 g 2份,装入样品袋中,并外贴标签。玉米样品先脱粒(应有1 kg籽粒),然后将玉米粒充分混匀,取100 g样品2份,分别装入样品袋中,并外贴标签。土壤样本碾碎后过筛,收集于搪瓷盘或其他适宜容器中,充分混匀,用四分法分别取200 g样品2份,分别装入封口样品袋中,并外贴标签;剩余的土壤样品另取100 g,装入封口样品袋中外贴标签,用于土壤样品含水率的测定。含水量较高不能过筛的土壤样本,可不过筛,直接混匀后取样。
1.6 检测方法
1.6.1 仪器与试剂 超高效液相色谱-串联质谱(UPLC-MS/MS,美国沃特斯公司);應用软件为Masslynx4.1质谱工作站;1/10万和1/100电子天平,康式振荡机、BUCHI 215旋转蒸发浓缩仪、高速离心机、超声波清洗器、各种玻璃器皿等。
色谱纯乙腈、甲醇、甲酸,百灵威试剂公司购买;水为娃哈哈纯净水;氟虫腈标准品,纯度99.0%,以色列马克西姆化学公司提供;氟甲腈标准品,100 μg/mL,百灵威试剂公司购买;氟虫腈砜标准品,纯度98.3%,百灵威试剂公司购买;氟虫腈硫醚标准品,纯度99.4%,百灵威试剂公司购买;石墨化炭黑复合乙二胺基-N- 丙基固相萃取柱,月旭(上海)股份有限公司购买。无水硫酸钠使用前在130 ℃烘烤6 h。
1.6.2 样品的前处理
1.6.2.1 提取 称取样品20 g(精确至0.01 g)置于250 mL具塞三角瓶中,加入7 g氯化钠摇匀,加入100 mL乙腈避光浸泡过夜,过无水硫酸钠脱水,收集50 mL滤液,旋转蒸发浓缩近干,氮吹仪吹干,加入1 mL乙酸乙酯待净化。
1.6.2.2 净化 采用石墨化炭黑复合乙二胺基-N-丙基固相萃取小柱净化。用5.0 mL乙酸乙酯活化固相萃取柱,然后将上述制备好的1.0 mL样品转入小柱内,用10.0 mL乙酸乙酯-丙酮(体积比1 ∶ 1)的混合溶液分5次洗脱小柱,收集洗脱液于平底烧瓶中,旋转蒸发仪上浓缩至近干,乙腈和水(体积比1 ∶ 1)的混合溶液准确定容至2.0 mL,过0.22 μm滤膜后,转入预切口进样小瓶中,待UPLC-MS/MS检测分析。
1.6.3 样品的分析测试条件
1.6.3.1 液相色谱条件 Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm),柱温40 ℃,样品室温度10 ℃,进样量3 μL。流动相A为乙腈,流动相B为0.1%甲酸水溶液,流速0.3 mL/min。流动相梯度洗脱程序:0~2.0 min,流动相A由15%线性变化至90%;2.1~4.0 min,流动相A保持90%的比例等度洗脱;4.1~5.0 min,流动相A由90%线性变化至15%。
1.6.3.2 质谱条件 电喷雾负离子电离源(ESI-),扫描方式为多反应离子监测模式(MRM),毛细管电压0.5 kV,离子源温度为150 ℃,去溶剂气温度为500 ℃;去溶剂气、锥孔气体为高纯液氮,去溶剂气流速1 000 L/h,锥孔气体流速 50 L/h;碰撞气为高纯氩气;4个化合物质谱参数见表1。
2 结果与分析
2.1 方法的准确度、灵敏度和精密度
设定3个添加浓度水平,每个浓度设5个重复,按照上述分析步骤开展添加回收率试验, 另设空白对照。试验结果见注:*指定量离子对。
2.2 氟虫腈在土壤上的消解动态
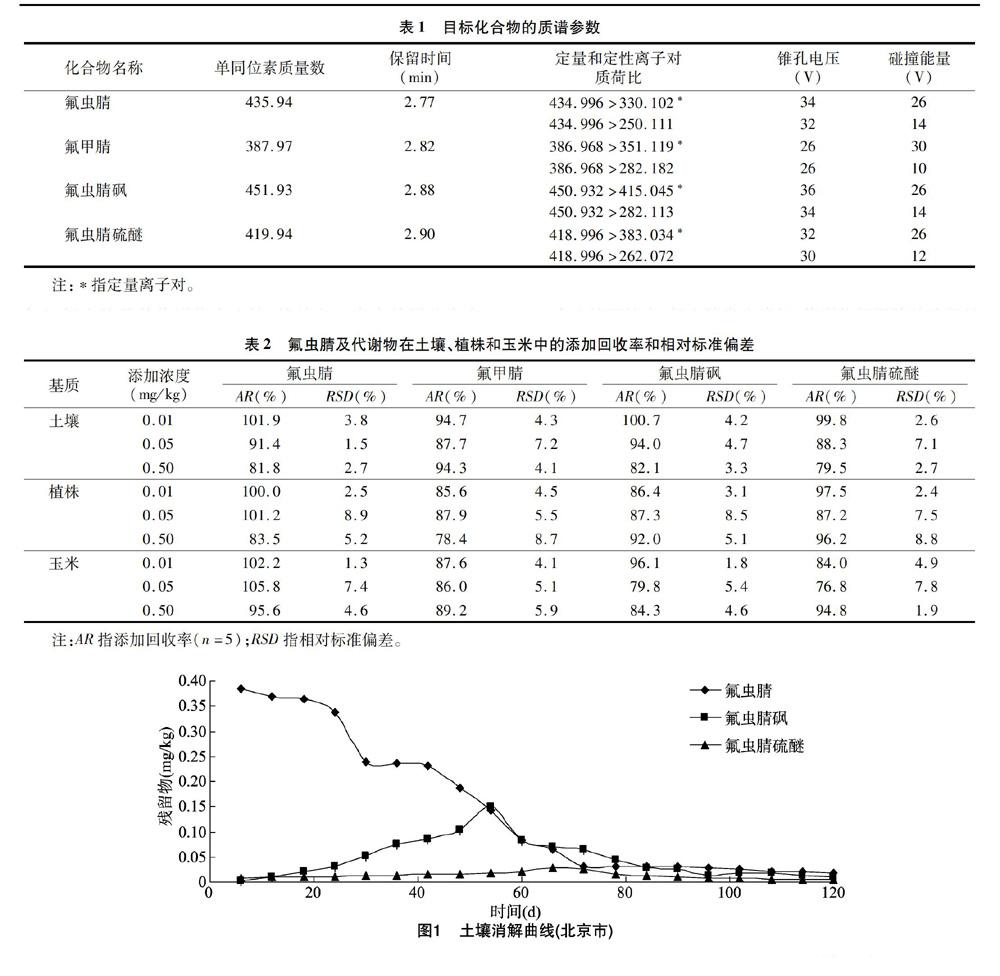
氟虫腈在北京市土壤的原始沉积量为0.384 mg/kg,其消解规律符合一级动力学模型,消解方程为C=0.520 5e-0.028 6t,R2=0.951 0,半衰期(T1/2)=24.2 d。氟虫腈在河南省土壤中的原始沉积量为0.202 mg/kg,其消解规律符合一级动力学模型,消解方程为C=0.380 0e-0.033 5t,R2=0.970 5,半衰期(T1/2)=20.7 d。
在土壤环境中,氟虫腈发生降解,代谢物氟甲腈的残留量均低于0.01 mg/kg。由图1、图2可知,氟虫腈砜和氟虫腈硫醚能在土壤样品中检测到,采样间隔期内,氟虫腈砜的残留量从低到高缓慢增加,北京市试验点在54 d达到最大残留量0.150 mg/kg,河南试验点在60 d时达到最大残留值 0.086 mg/kg,之后残留量逐步减少,90 d时残留量均低于0.01 mg/kg。代谢物氟虫腈硫醚的残留量也是从低到高缓慢增加,66 d达到最大残留量 0.029 mg/kg(北京市)和 0.027 mg/kg (河南省),之后残留量逐步减少,90 d时残留量均低于0.01 mg/kg。
2.2 氟虫腈在土壤上的消解动态
氟虫腈在北京市土壤的原始沉积量为0.384 mg/kg,其消解规律符合一级动力学模型,消解方程为C=0.520 5e-0.028 6t,R2=0.951 0,半衰期(T1/2)=24.2 d。氟虫腈在河南省土壤中的原始沉积量为0.202 mg/kg,其消解规律符合一级动力学模型,消解方程为C=0.380 0e-0.033 5t,R2=0.970 5,半衰期(T1/2)=20.7 d。
在土壤环境中,氟虫腈发生降解,代谢物氟甲腈的残留量均低于0.01 mg/kg。由图1、图2可知,氟虫腈砜和氟虫腈硫醚能在土壤样品中检测到,采样间隔期内,氟虫腈砜的残留量从低到高缓慢增加,北京市试验点在54 d达到最大残留量0.150 mg/kg,河南试验点在60 d时达到最大残留值 0.086 mg/kg,之后残留量逐步减少,90 d时残留量均低于0.01 mg/kg。代谢物氟虫腈硫醚的残留量也是从低到高缓慢增加,66 d达到最大残留量 0.029 mg/kg(北京市)和 0.027 mg/kg (河南省),之后残留量逐步减少,90 d时残留量均低于0.01 mg/kg。
2.3 氟虫腈在玉米植株上的消解动态
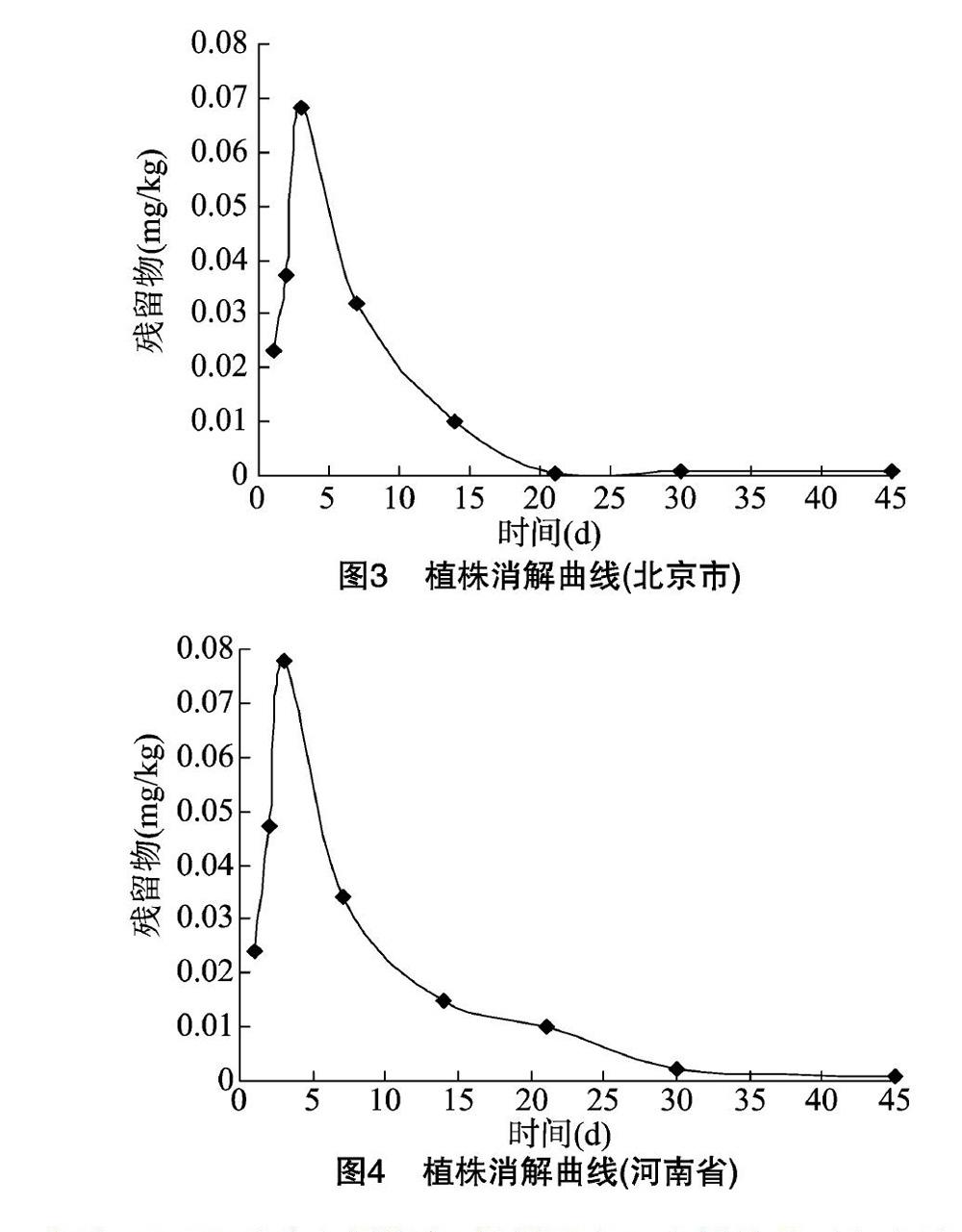
氟虫腈在北京市郊区玉米植株中的原始沉积量为 0.023 mg/kg,14 d消解率98.88%,其消解规律符合一级动力学模型,消解方程为C=0.037 2e-0.104 8t,R2=0.732 7,半衰期(T1/2)=6.6 d。氟虫腈在河南省郊区玉米植株中的原始沉积量为0.024 mg/kg,21 d消解率98.80%,其消解规律符合一级动力学模型,消解方程为C=0.055 0e-0.093 0t,R2=0.918 3,半衰期(T1/2)=7.5 d。在玉米植株中,氟虫腈的3个代谢物的残留量均低于0.01 mg/kg。北京市、河南省玉米植株的消解曲线见图3、图4。
2.4 氟虫腈在土壤和玉米中的最终残留量
2014—2015年氟虫腈在玉米上的最终残留结果表明, 氟虫腈22%悬浮种衣剂按高、低剂量在玉米播前种子包衣处理1次,收获期玉米样品和土壤样品中氟虫腈及其代谢物的残留量均低于0.01 mg/kg。北京市、河南省2地的检测结果无明显差异。
3 结论
氟虫腈在土壤和玉米植株上降解较快,土壤中的降解半衰期为20.7~24.2 d,植株上的降解半衰期为6.6~7.5 d。我国规定氟虫腈在玉米上的最大允许残留限量为 0.1 mg/kg[1],本试验中以色列马克西姆化学公司生产的22%氟虫腈悬浮种衣剂,在北京、河南2地以 200 mL/100 kg 种子(50 g a.i./100 kg种子)和高剂量300 mL/100 kg种子(75 g a.i./100 kg种子)于玉米播前种子包衣处理1次,收获玉米和土壤中氟虫腈的残留量均低于 0.01 mg/kg,收获玉米是安全的。严格按照标签规定的使用程序合理用药,该药剂对人类健康和环境安全带来的负面影响很小。
参考文献:
[1]中华人民共和国卫生部,中华人民共和国农业部. 食品安全国家标准 食品中农药最大残留限量:GB/T 2763—2016[S]. 北京:中国标准出版社,2016.
[2]国家质量监督检验检疫总局. 进出口食品中氟虫腈残留量检测方法 气相色谱-质谱法:SN/T 1982—2007[S]. 北京:中国标准出版社,2007.
[3]中华人民共和国农业部. 蔬菜中334种农药及多残留的测定 气相色谱质谱法和液相色谱质谱法:NY/T 1379—2007[S]. 北京:中国农业出版社,2007.
[4]陈志涛,丁立平,吴文凡,等. 分散固相萃取-气相色谱法测定水产品中氟虫腈和丁烯氟虫腈的残留[J]. 农药,2014,53(12):904-905,926.
[5]赵 丽,洪雪花,荣国琼,等. 气相色谱法测定水果中氟虫腈农药残留[J]. 食品安全质量检测学报,2017,8(10):3921-3924.
[6]吕 磊,何 力,甘金华,等. 分散固相萃取-气相色谱法测定水产品中氟虫腈残留[J]. 分析试验室,2015,34(7):847-849.
[7]叶 倩,邓义才,路大海,等. 气相色谱法测定蔬菜水果中氟虫腈等6种农药残留[J]. 农药,2016,56(1):51-54.
[8]徐振球,成 强,王龙根,等. GC-MS法对芹菜中氟虫腈残留量的测定[J]. 江苏农业科学,2016,44(12):329-331.
[9]沈伟健,柳 菡,张 睿,等. 气相色谱-负化学源质谱法测定禽蛋及蛋制品中氟虫腈及其代谢物[J]. 色谱,2017,35(12):1224-1228.
[10]白宝清,李美萍,张生万. QuEChERS-DLLME-高效液相色谱法测定蔬菜中溴虫腈和氟虫腈残留[J]. 食品科学,2014,35(24):254-258.
[11]王玉玲,史常春,李自华,等. 氟虫腈高效液相色谱分析方法优化[J]. 農药,2014,53(8):577-578,593.
[12]成 婧,王美玲,朱绍华,等. 固相萃取-高效液相色谱-串联质谱法测定茶叶中啶虫脒、吡虫啉和氟虫腈残留量[J]. 食品安全质量检测学报,2016,7(1):131-137.
[13]胡贝贞,蔡海江,宋伟华. 茶叶中氟虫腈等8种农药残留的液相色谱-串联质谱法测定及不确定度评定[J]. 色谱,2012,30(9):889-895.
[14]Cheng Y P,Dong F S,Liu X A,et al. Simultaneous determination of fipronil and its major metabolites in corn and soil by ultra-performance liquid chromatography-tandem mass spectrometry[J]. Analytical Methods,2014,6(6):1788-1795.
[15]贺 敏,宋 丹,董丰收,等. UPLC-MS/MS快速检测韭菜和土壤中氟虫腈及其代谢物残留[J]. 环境化学,2016,36(5):925-932.
[16]堵燕钰,罗漪涟,王洁琼,等. 在线净化-液相色谱串联质谱技术测定蔬菜中氟虫腈及其代谢物残留[J]. 环境化学,2017,36(4):928-930.
[17]中华人民共和国农业部. 农药残留试验准则:NY/T 788—2004[S]. 北京:中国标准出版社,2004.

