二甲双胍对百草枯中毒大鼠急性肺损伤的保护作用
吴潦章,岑遗芳,冯梦龙,周满红
0 引 言
百草枯是一种非选择性触杀型除草剂,对人类和家畜具有很强的毒性,且目前缺乏特效解毒药,因此中毒后病死率居高不下,可达60%~70%[1-2]。百草枯进入机体后迅速分布在许多重要器官,肺是其损伤的主要靶器官[3],早期表现为急性肺损伤(acute lung injury,ALI),晚期则引起肺泡和肺间质进行性纤维化[4],是百草枯中毒患者死亡的主要原因。百草枯中毒机制复杂,已有研究证实,氧化应激和炎症反应在百草枯导致急性肺损伤中起着重要的作用[5-7]。
二甲双胍(metformin,MET)是2 型糖尿病的一线治疗药物[8],研究发现MET 除具有降血糖作用外,还具有多种生物学功能,如抗炎、减轻氧化应激及抗纤维化作用等[9-13]。因此,MET 在脓毒症、脂多糖诱导的ALI 及肺纤维化的治疗中具有应用价值[13-15]。但MET 在百草枯诱导的急性肺损伤中是否具有同样的作用尚不清楚。本研究通过构建大鼠百草枯中毒致急性肺损伤模型,予大鼠灌胃MET溶液进行干预,比较干预组和造模组大鼠的肺湿干重比、肺泡炎症程度和血浆中IL-1β、IL-6、TNF-α、MDA 及SOD的含量,观察二甲双胍对百草枯致大鼠急性肺损伤是否起保护作用。
1 材料与方法
1.1 实验动物成年SPF 级雄性SD 大鼠90 只,体重(200±20)g,购自长沙市天勤生物技术有限公司,实验动物许可证号:SCXK(湘)2014-0011。饲养于遵义医科大学实验动物中心,饲养环境:20~25 ℃,(50±5)%相对湿度,12 h昼夜循环光照,给与标准食水喂养,开始实验前至少饲养1 周。除外实验过程中死亡共有78 只大鼠纳入。所有实验动物在饲养及实验过程中均符合遵义医科大学动物伦理要求。
1.2 主要材料20%百草枯溶液(中国,南京红太阳生物化学有限责任公司);盐酸MET(美国,Sigma-Aldrich 公司);HE 染色试剂(中国,遵义医学院附属医院病理科);鼠IL-1β、IL-6、TNF-α ELISA 试剂盒(中国,武汉三鹰生物技术有限公司);SOD、MDA 试剂盒(中国,南京建成生物工程研究所);BCA 蛋白浓度测定试剂盒(中国,北京索莱宝科技有限公司);全自动多功能酶标仪(美国,Thermo Fisher Scientific公司)。
1.3 动物分组将78 只大鼠随机数字表法分为5组:对照组(n=6)、百草枯组(n=18)、MET低剂量组(n=18)、MET中剂量组(n=18)和MET高剂量组(n=18)。
1.4 模型建立将20%百草枯溶液加0.9%等渗盐水稀释为2%的溶液(浓度20 mg/mL),避光保存。按30 mg/kg 抽取2%的百草枯溶液并用0.9%等渗盐水稀释为1 mL一次性腹腔注射,制备百草枯中毒的实验模型。不同剂量的MET 干预组从染毒后2 h 开始,分别给予MET 100、400、800 mg/kg 灌胃,1 次/d,共7 d。百草枯组每日灌入等量0.9%等渗盐水。对照组用等量0.9%等渗盐水一次性腹腔内注射,并每日灌入等量0.9%等渗盐水。各组大鼠均按照时间点(1、3、7 d)每次处死6只,对照组处死2只,分别收集血浆和肺组织标本。
1.5 大鼠血浆中氧化指标的检测大鼠予10%水合氯醛(3.0 mg/kg)腹腔注射麻醉充分后,仰面固定于恒温手术台上,采用腹主动脉采血法采血约5 mL,离心半径8 cm、3000 r/min,离心10 min,取上清于-80 ℃保存待测。按照SOD 和MDA 试剂盒说明书,分别采用黄嘌呤氧化酶法测定SOD 的活力和硫代巴比妥酸法检测MDA 的含量。
1.6 大鼠血浆中炎症指标的检测按照ELISA试剂盒说明书对各样本进行操作,分别检测IL-1β、IL-6、TNF-α 的含量,实验中设置空白对照孔和标准品孔,选择450 nm 波长检测吸光度,并根据标准品的吸光度值及相应的浓度值,制作标准曲线。根据标准曲线计算出待测样品的浓度值。
1.7 肺组织湿干重比大鼠处死后,取右肺上叶用灭菌等渗盐水冲洗3 次,滤纸吸干称湿重后,置80 ℃烤箱干燥48 h,称取干重,计算肺湿/干重比,以反映肺水肿的严重程度。
1.8 肺组织病理学检查取大鼠右下叶肺组织,用4%多聚甲醛固定72 h,石蜡包埋、切片,脱蜡后,切片用苏木精伊红液染色,在光学显微镜下观察各组肺组织病理学变化。
1.9 统计学分析采用SPSS 17.0 软件进行统计分析,定量资料用均数±标准差(xˉ±s)表示,多组计量资料比较用单因素方差分析(One-way ANOVA),组间两两比较如方差齐用最小显著性差异(LSD)进行分析,如方差不齐采用Dunnett t3 检验。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 肺组织湿/干重比与对照组相比,百草枯组和MET低、中、高剂量组在第1、3、7天时均明显增加了肺的湿/干重比(P<0.05),以第3天最重;与百草枯组比较,MET 组中、高剂量组第7 天湿/干重比明显降低(P<0.05),而MET 中、高剂量组差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠肺组织湿/干重比变化Table 1 Wet/dry weight ratio of the pulmonary tissue in different groups of rats at different time points

表1 各组大鼠肺组织湿/干重比变化Table 1 Wet/dry weight ratio of the pulmonary tissue in different groups of rats at different time points
与对照组比较,*P<0.05;与百草枯组第7天比较,#P<0.05
组别n第1天 第3天 第7天对照组25.13±0.135.13±0.135.13±0.13百草枯组66.34±0.25*7.32±0.32*7.16±0.33*MET低剂量组66.36±0.46*7.28±0.62*7.13±0.58*MET中剂量组66.38±0.43*7.26±0.46*6.08±0.48*#MET高剂量组66.34±0.33*7.31±0.33*6.17±0.42*#
2.2 大鼠血浆中MDA 和SOD 的水平变化经SOD 和MDA 试剂盒检测,与对照组相比,百草枯组和MET 低、中、高剂量组大鼠血浆中MDA 含量在第1、3、7 天时均明显升高(P<0.05),而SOD 均明显降低(P<0.05);与百草枯组比较,MET 中、高剂量大鼠血浆中MDA含量均显著降低(P<0.05),而SOD均明明显升高(P<0.05),但MET 中、高剂量组差异无统计学意义(P>0.05)。见表2。
2.3 大鼠血浆中IL-1β、IL-6 和TNF-α 的水平变化经ELISA试剂盒检测,与对照组比较,百草枯组和MET低、中、高剂量组大鼠血浆中IL-1β、IL-6、TNFα含量在第1、3、7天均明显升高(P<0.05);与百草枯组比较,MET中、高剂量组大鼠血浆中IL-1β、IL-6、TNFα 含量均显著降低(P<0.05),但MET 中、高剂量组间差异无统计学意义(P >0.05)。见表3。
2.4 肺组织病理学观察对照组大鼠各观察时间点无明显变化,肺组织结构清晰,间质血管无扩张,无出血点,无炎性浸润,肺泡壁未见增厚;百草枯组和MET低、中、高剂量组大鼠第1天时可见炎性细胞浸润,肺泡轻微塌陷,部分肺泡间隔增厚;第3天时可见大量炎性细胞浸润,弥漫性肺出血,肺泡塌陷和广泛的肺泡间隔增厚;在第7天时,百草枯组和MET低剂量组仍可见大量炎性细胞浸润和弥漫性肺出血,肺泡塌陷和肺泡间隔增厚更明显,而MET中、高剂量组肺泡炎症较同时期百草枯组明显减轻。见图1。
表2 各组大鼠血浆MDA和SOD的变化(xˉ±s)Table 2 Contents of MDA and SOD in the plasma of different groups of rats at different time points

表2 各组大鼠血浆MDA和SOD的变化(xˉ±s)Table 2 Contents of MDA and SOD in the plasma of different groups of rats at different time points
与对照组比较,*P<0.05;与百草枯组比较,#P<0.05
组别n 第1天MDA(第n3m天o l/mL)第7天 第1天SOD第(3U天/mL)第7天对照组22.53±0.362.53±0.362.53±0.36256.18±18.18256.18±18.18256.18±18.18百草枯组63.68±0.26*4.65±0.44*5.18±0.56*229.24±18.26*191.31±20.81*152.06±17.03*MET低剂量组63.57±0.52*4.59±0.51*5.09±0.88*224.65±19.27*186.93±10.05*150.76±18.18*MET中剂量组63.56±0.83*4.52±0.67*3.80±0.91*#223.20±19.37*192.42±16.39*205.95±13.16*#MET高剂量组63.68±0.60*4.64±0.85*3.96±0.78*#226.45±11.62*195.76±14.15*208.37±12.23*#
表3 各组大鼠血浆IL-1β、IL-6 和TNF-α的变化(xˉ±s)Table 3 Expressions of IL-1β,IL-6 and TNF-α in the plasma of different groups of rats at different time points
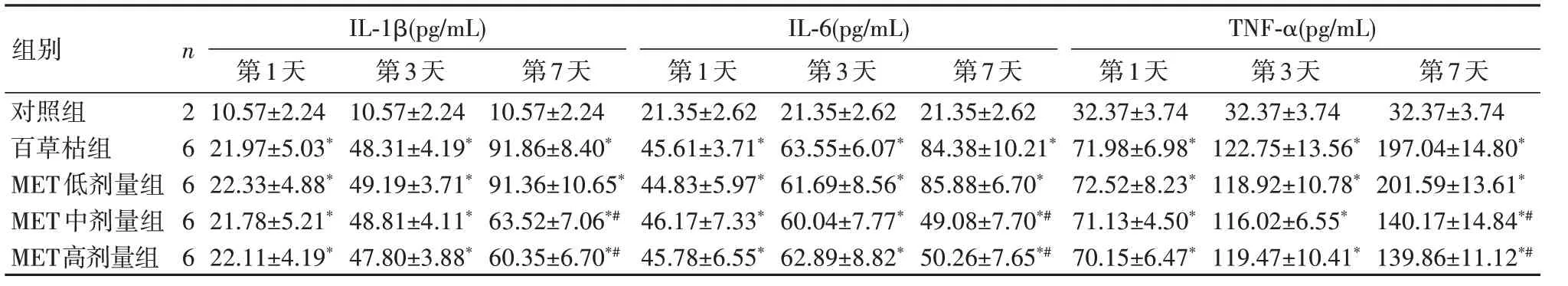
表3 各组大鼠血浆IL-1β、IL-6 和TNF-α的变化(xˉ±s)Table 3 Expressions of IL-1β,IL-6 and TNF-α in the plasma of different groups of rats at different time points
与对照组比较,*P<0.05;与百草枯组比较,#P<0.05
组别n 第1天IL-第1β 3(p天g/mL)第7天 第1天IL第-6(3 pg天/mL)第7天 第1天TN第F-3 α 天(pg/mL)第7天对照组210.57±2.2410.57±2.2410.57±2.2421.35±2.6221.35±2.6221.35±2.6232.37±3.7432.37±3.7432.37±3.74百草枯组621.97±5.03*48.31±4.19*91.86±8.40*45.61±3.71*63.55±6.07*84.38±10.21*71.98±6.98*122.75±13.56*197.04±14.80*MET低剂量组622.33±4.88*49.19±3.71*91.36±10.65*44.83±5.97*61.69±8.56*85.88±6.70*72.52±8.23*118.92±10.78*201.59±13.61*MET中剂量组621.78±5.21*48.81±4.11*63.52±7.06*#46.17±7.33*60.04±7.77*49.08±7.70*#71.13±4.50*116.02±6.55*140.17±14.84*#MET高剂量组622.11±4.19*47.80±3.88*60.35±6.70*#45.78±6.55*62.89±8.82*50.26±7.65*#70.15±6.47*119.47±10.41*139.86±11.12*#

图1 不同时间各组大鼠肺组织病理变化(HE×200)Figure 1 Pathological images of the pulmonary tissue in different groups of rats at different time points(HE×200)
3 讨 论
百草枯中毒导致急性肺损伤机制不明,其中氧化应激在百草枯引起的肺损伤中起着重要的作用[16]。百草枯一旦进入人体后,可以逆浓度梯度差的主动重吸收到肺部,并通过NADPH 依赖反应形成氧化还原循环,导致各种有毒高活性氧自由基激增[17]。由于内源性抗氧化物活性的降低和NADH等还原当量的耗尽,便会发生氧化应激,引发抗氧化防御能力失衡[18],从而诱导脂质过氧化反应,造成体内MDA累积。另一方面,炎症反应在百草枯引起的肺损伤中同样起着重要的作用。Yang 等[19]证实,百草枯暴露可导致小鼠血清的炎性因子如TNFα、IL-1β 和IL-6 和肺组织内NF-κBp65 表达增高。本实验通过建立百草枯中毒大鼠急性肺损伤模型[20],光学显微镜下观察了大鼠肺组织急性损伤的病理变化,并检测了不同时期相应的氧化和炎症因子指标变化,以及肺的湿干重比。
通过研究发现,百草枯染毒大鼠肺组织HE 染色可见炎性细胞浸润、弥漫性肺出血、肺泡塌陷和广泛的肺泡间隔增厚,血浆中氧化产物MDA和炎性因子(IL-1β、IL-6、TNF-α)的含量均明显升高,且随着时间呈逐渐加重趋势,而抗氧化物SOD 明显降低,且随着时间呈逐渐下降趋势。通过检测肺的湿干重比发现,大鼠在染毒第1 天就出现明显的肺水肿,至第3 天时达高峰,到第7 天时仍存在肺水肿。而经过MET干预后,上述情况均有所改善。
MET 作为治疗2 型糖尿病的一线降糖药,已经在临床应用多年[21]。近年来研究发现,MET 发挥降糖作用的同时,也具有显著的抗炎效应和减少氧化应激能力[10,22]。Yang 等[23]研究表明,在草酸盐诱导的MDCK细胞和HK-2细胞损伤中,二甲双胍能明显降低MDA 含量和提高SOD 水平。Wu 等[15]的研究则证实了,在脂多糖诱导的小鼠ALI中,二甲双胍可以降低小鼠血浆和肺组织匀浆中IL-6和TNF-α的含量,并减轻肺组织病理学改变。我们为了探讨MET在百草枯诱导ALI 中发挥的作用,在前期进行了多次预实验和查阅相关文献的基础上,选定MET100、400 和800mg/kg 作为实验干预剂量,以观察MET 在百草枯诱导的ALI 中可能发挥的抗炎及抗氧化保护效应。
本实验观察到,各种剂量MET干预后,在第1天和第3 天时对百草枯引起的肺水肿、肺组织的病理改变以及血浆中各种氧化和炎症指标均没有明显的改善,而在第7 天时,400 mg/kg 和800 mg/kg MET能明显改善百草枯引起的肺水肿及肺组织的病理变化,并减轻氧化应激和减少炎症因子水平,但这两个干预剂量间并没有统计学意义。提示MET 对百草枯诱导大鼠ALI 具有保护作用,其保护作用与MET 的剂量和疗程有关,小剂量以及疗程短无效,在剂量达到一定程度后,继续增加治疗剂量并不能带来更好的治疗效果,相反会增加药物副作用的风险。
综上所述,我们从动物实验证实了MET 可以通过减少氧化应激和抑制炎症因子对百草枯诱导的ALI 起保护作用,其保护作用与MET 的剂量和疗程有关。但是本实验也存在一定的局限,MET 发挥作用的具体机制尚不清楚,需要我们进一步去研究。