EZH2、MMP-2及MMP-9在肝癌侵袭转移中的作用及关系
张淑群,张 莹,杨 鑫,王敏聪,韩丽丽
(1. 西安交通大学第二附属医院肿瘤病院;2. 西安交通大学组织部;3. 西安交通大学第二附属医院药剂科,陕西西安 710004)
原发性肝癌(hepatocelluar carcinoma, HCC)是世界范围内的第5大肿瘤[1],也是我国常见的恶性肿瘤,严重威胁人民的健康[2]。由于HCC起病隐匿、侵袭转移能力强、疾病发展迅速,大多数患者确诊时已处于晚期,丧失了手术时机。化疗、放疗或介入治疗在HCC中的应用均比较局限。探索、筛选与HCC侵袭转移相关的有效生物标记物,明确HCC侵袭转移机制对提高HCC预后至关重要,普遍引起人们关注。
基质金属蛋白酶(matrix metalloproteinases, MMPs)家族是一系列降解细胞外基质的重要肽链内切酶酶类,参与多种人类肿瘤的侵袭转移[3]。基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)是由肝细胞分泌,通过破坏分解细胞外基质促进肿瘤的生长、浸润和转移[4-5]。果蝇zeste基因增强子的人类同源物2(enhancer of zeste homolog 2, EZH2)具有DNA甲基转移和组蛋白脱乙酰化酶的调控作用,调控癌症进展和干细胞的多潜能性等生命活动[6-9]。在肝癌中EZH2表达也有明显升高,其过表达与肝癌患者的复发和预后不良密切相关[10],但EZH2在肝癌侵袭转移中发挥的作用尚需阐明,并且EZH2在肝癌组织中与MMP-2、MMP-9的关系目前尚不清楚。故本研究检测EZH2、MMP-2、MMP-9在肝癌组织中的表达情况及在HCC中的临床病理价值,并分析EZH2与MMP-2、MMP-9表达的相关性,以及EZH2对肝癌细胞侵袭的影响,明确EZH2是否通过MMP-2、MMP-9发挥调控肝癌侵袭转移作用,从而更好地理解肝癌侵袭转移机制。
1 材料与方法
1.1 研究对象及组织标本随机选择2010年3月至2011年3月在西安交通大学第二附属医院接受外科切除术的原发性肝癌患者120例。纳入标准:①临床及病理资料完整;②术前未接受放化疗;③无严重肝肾疾病;④未合并其他肿瘤;⑤所有组织标本均经病理医师检查证实。外科切除手术标本,包括新鲜的肝癌组织和配对的癌旁组织样本(距离边缘2 cm),术中切除后立即保存在液态氮中,以备后续研究。
1.2 qRT-PCR法检测EZH2、MMP-2和MMP-9的表达应用Trizol试剂(美国Invitrogen公司)提取HCC组织及癌旁组织或HCC细胞中总RNA,利用紫外分光光度计检测RNA浓度;将RNA反转录为cDNA(反转录试剂盒购于日本TaKaRa公司)。qRT-PCR条件:95 ℃预热15 min;95 ℃ 20 s,60 ℃ 8 s,重复40个周期。EZH2、MMP-2及MMP-9相对表达采用2-△△Ct法对比GAPDH表达进行数据分析,所有实验重复3次。EZH2、MMP-2及MMP-9引物购自TaKaRa公司,引物序列如表1所示。
表1 EZH2、MMP-2、MMP-9和GAPDH引物序列
Tab.1 Primer sequences of EZH2, MMP-2, MMP-9 and GAPDH for qRT-PCR analysis

Gene Forward primer (5'-3') Reverse primer (5'-3')EZH2GTGGAGAGATTATTCTCAAGATGCCGACATACTTCAGGGCATCAGCCMMP-2GATACCCCTTTGACGGTAAGGACCTTCTCCCAAGGTCCATAGCMMP-9TTGACAGCGACAAGAAGTGGGCCATTCACGTCGTCCTTATGAPDHCCATCTTCCAGGAGCGAGATCGCCTTCTCCATGGTGGTGAA
1.3 细胞培养及转染SMMC-7721细胞培养人肝癌细胞株和LO2细胞购自美国ATCC生物资源中心。应用含150 mL/L胎牛血清(四季青公司)的DMEM培养基(美国Thermo Fisher)培养细胞,1.25 g/L胰酶消化细胞进行传代,3 d传代1次。
小干扰RNA由上海吉凯制药技术有限公司合成,针对EZH2基因提供3个靶点供筛选:
Target1:5′-CCAGGACACGAGGAAACUG-3′ 5′-AAAUCUCGGUGCACUAGGA-3′
Target2:5′-GCACCAGUCCAGUAUUGGC-3′ 5′-CGAGACUUCUGCGGAUUGC-3′
Target3:5′-GAUGCAGUUCCGCUCCAUU-3′ 5′-GGCUUUUGUCCCAGCCAUC-3′
1.4 Transwell小室实验测定细胞迁移、侵袭Transwell迁移实验:重悬2×104个肝癌细胞接种于Transwell小室上层,加入100 μL无血清DMEM培养基培养,设3个复孔;Transwell小室下层加入500 μL含150 mL/L胎牛血清的DMEM培养基;细胞培养箱培养48 h后吸出上室内培养基,轻轻用棉签拭去小室上层未迁移过膜的肝癌细胞;固定细胞15 min,结晶紫染色30 min;室温风干过夜,于光镜下随机观察10个视野计数。
Transwell侵袭实验:按照3∶1比例用无血清DMEM稀释Matrigel胶,每小室取100 μL稀释好的胶铺满上层,置于37 ℃细胞培养箱中孵育6 h;余步骤同迁移实验。
1.5 统计学分析应用SPSS 20.0软件进行数据分析。两组间差异用独立样本t检验进行比较。EZH2、MMP-2及MMP-9与临床病理参数的关系采用Logistic回归进行分析。EZH2与MMP-2、MMP-9相关性首先应用TCGA公共数据库的数据进行分析,然后应用Pearson相关分析120例临床组织标本中EZH2与MMP-2、MMP-9表达的相关性。本研究先对EZH2、MMP-2及MMP-9在HCC中表达进行t检验,根据cutoff值分别分成高、低表达组进行进一步研究。比较3种小干扰RNA在SMMC-7721细胞系中对EZH2表达抑制作用先采用方差分析,并进行两两比较。双侧P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的基本情况临床及病理资料完整的肝癌组织以及配对癌旁组织标本120例。患者年龄34~66岁,平均(45.15±10.73)岁;其中男性患者97例,女23例;甲胎蛋白(AFP)<400 ng/mL患者99例,AFP≥400 ng/mL 21例;中/高分化49例,低分化-未分化71例;肿瘤数目为单个的患者77例,肿瘤数目为多个的患者43例;肿瘤大小<5 cm患者53例,肿瘤大小≥5 cm患者67例;无微血管侵犯39例,有微血管侵犯81例;Ⅰ~Ⅱ期患者76例,Ⅲ~Ⅳ期44例。
2.2 EZH2和MMP-2、MMP-9在HCC和配对癌旁组织中的表达情况qRT-PCR检测结果显示,EZH2在70.8%(85/120)HCC组织中表达高于癌旁对照组织,EZH2在HCC组织的相对表达水平为5.26±0.35,而在癌旁组织中相对表达水平为2.56±0.28,EZH2在HCC组织中表达高于癌旁组织(P<0.001,图1A);MMP-2在63.53%(76/120)的HCC患者中表达高于癌旁对照组织,MMP-2在HCC组织中表达(4.58±0.29)高于癌旁组织(2.02±0.18,P=0.013,图1B);MMP-9在66.7%(80/120)的HCC患者中表达高于癌旁对照组织,MMP-9在HCC组织中表达水平(5.56±0.32)高于癌旁组织(2.71±0.24,P=0.021,图1C)。

图1 EZH2、MMP-2和MMP-9在肝癌组织中均高表达
Fig.1 EZH2, MMP-2 and MMP-9 were increased in HCC tissues
与癌旁组织比较,**P<0.01。
2.3 EZH2、MMP-2和MMP-9表达与HCC临床病理参数的关系在HCC组织中EZH2表达与年龄、性别、肿瘤数目及肿瘤大小无关,但与AFP水平、肿瘤病理分级、微血管侵犯及临床分期密切相关。HCC组织中EZH2的表达,临床分期为Ⅲ、Ⅳ期患者高于Ⅰ、Ⅱ期患者(OR=0.197,P=0.002);有微血管侵犯的HCC患者高于没有微血管侵犯的患者(OR=2.077,P<0.001);AFP≥400 ng/mL者高于AFP<400 ng/mL的患者(OR=3.437,P=0.013);病理分级为低分化-未分化的高于中/高分化患者(OR=0.553,P=0.001,表2)。
MMP-2在HCC组织中的表达与年龄、性别、AFP水平、肿瘤大小、肿瘤分期无明显相关,但与微血管侵犯、肿瘤数目及病理分级密切相关。相比于无微血管侵犯、肿瘤数目为单个及病理分级好的HCC组织,MMP-2在有微血管侵犯(OR=2.530,P=0.023)、肿瘤数目为多个(OR=2.963,P=0.008)及病理分级差(OR=2.400,P=0.032,表2)的HCC组织中高表达。
MMP-9在HCC组织中的表达与年龄、性别、AFP水平、肿瘤数目、肿瘤大小均无关,但与临床分期、微血管侵犯及病理分级密切相关。相比于临床分期在Ⅰ、Ⅱ期,无微血管侵犯及病理分级好的HCC组织,MMP-9在临床分期为Ⅲ、Ⅳ期(OR=0.057,P<0.001)、有微血管侵犯(OR=0.171,P<0.001)及病理分级差(OR=0.429,P=0.034,表2)的HCC组织中高表达。EZH2、MMP-2和MMP-9与肝癌微血管侵犯均有相关性,说明三者均在肝癌侵袭转移中发挥重要作用。
表2 EZH2、MMP-2和MMP-9表达与HCC临床病理特征的相关性
Tab.2 Association of EZH2, MMP-2 and MMP-9 expressions with clinicopathological features in HCC
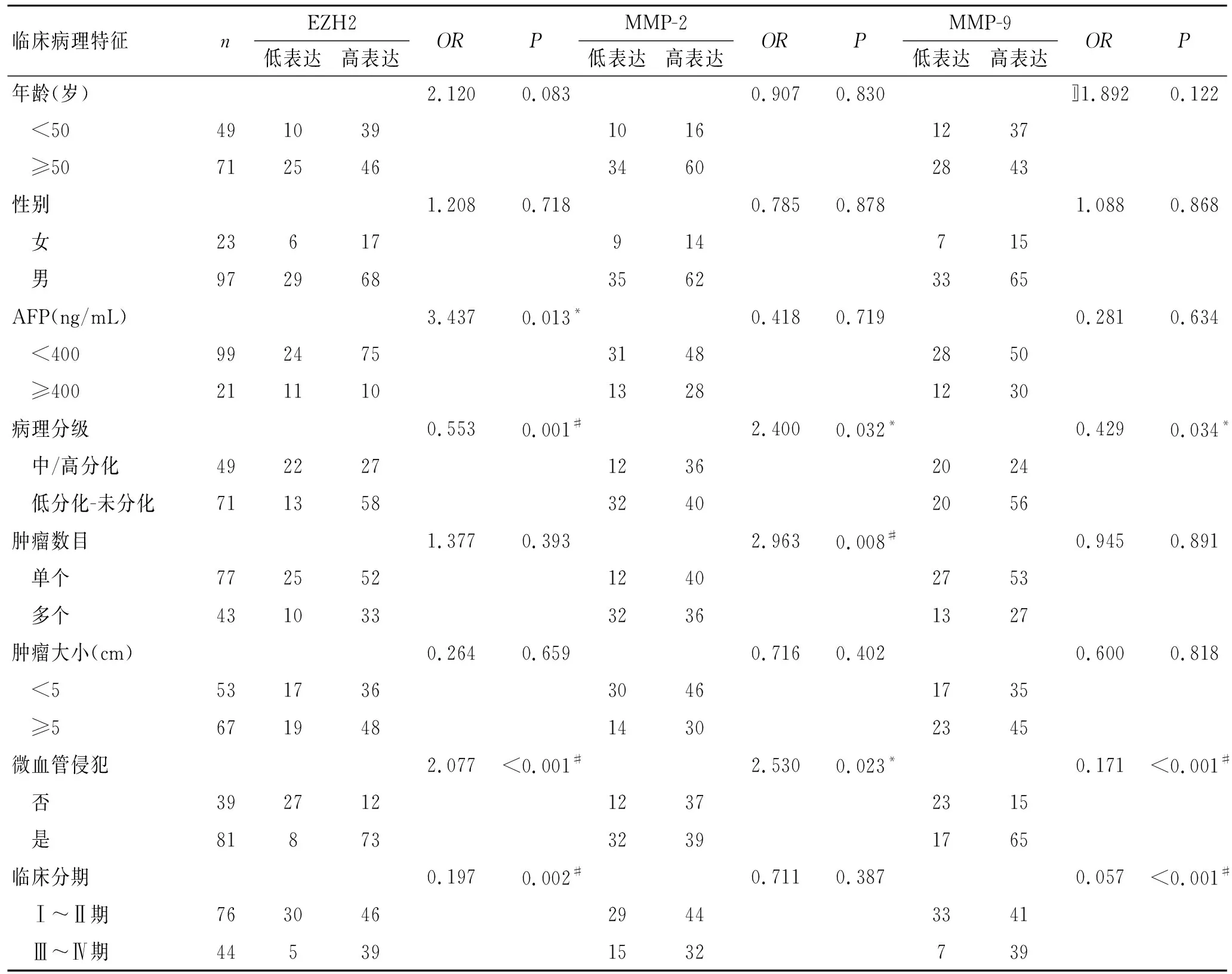
临床病理特征nEZH2低表达高表达ORPMMP-2低表达高表达ORPMMP-9低表达高表达ORP年龄(岁)2.120 0.0830.9070.830〛1.892 0.122 <5049103910161237 ≥5071254634602843性别1.2080.7180.7850.8781.0880.868 女23617914715 男97296835623365AFP(ng/mL)3.4370.013*0.4180.7190.2810.634 <40099247531482850 ≥40021111013281230病理分级0.5530.001#2.4000.032*0.4290.034* 中/高分化49222712362024 低分化-未分化71135832402056肿瘤数目1.3770.3932.9630.008#0.9450.891 单个77255212402753 多个43103332361327肿瘤大小(cm)0.2640.6590.7160.4020.6000.818 <553173630461735 ≥567194814302345微血管侵犯2.077<0.001#2.5300.023*0.171<0.001# 否39271212372315 是8187332391765临床分期0.1970.002#0.7110.3870.057<0.001# Ⅰ~Ⅱ期76304629443341 Ⅲ~Ⅳ期445391532739
*P<0.05,#P<0.01。
2.4 TCGA数据库中EZH2和MMP-2、MMP-9表达的相关性分析TCGA数据库数据分析显示,EZH2和MMP-2表达无相关性(r=-0.052,P=0.315,图2A),而与MMP-9表达存在相关性(r=0.288,P<0.001,图2B)。
2.5 HCC组织中EZH2和MMP-2、MMP-9表达的相关性分析对120例患者HCC组织中EZH2和MMP-2、MMP-9表达进行Pearson相关性分析,其结果与TCGA数据库分析结果一致:EZH2和MMP-2表达在统计学上没有明显的相关性(r=0.126,P=0.172,图3A),而与MMP-9表达水平呈正相关,具有统计学意义(r=0.598,P<0.001,图3B)。
2.6 转染小干扰RNA下调SMMC-7721细胞中EZH2表达qRT-PCR检测原发性肝癌细胞株HepG2、SMMC-7721、MHCC-97H、Bel-7402及正常肝细胞LO2中EZH2表达,结果显示,EZH2在SMMC-7721细胞中表达最高(图4A)。转染EZH2-siRNA完成24 h后qRT-PCR检测筛选3个小干扰RNA中最佳靶点,选择干扰效果最佳3号小干扰RNA转染SMMC-7721细胞系(P<0.01,图4B)。qRT-PCR检测转染3号小干扰RNA后24、48、72 h EZH2的mRNA表达水平,结果显示,转染24 h开始EZH2的mRNA表达水平与对照组比较明显下降,转染48 h EZH2进一步降低,转染72h EZH2表达趋于稳定(图4C)。

图2 利用TCGA数据库分析EZH2与MMP-2、MMP-9相关性
Fig.2 The correlation between EZH2 and MMP-2, EZH2 and MMP-9 was analyzed by TCGA database

图3 在HCC临床组织中检测分析EZH2与MMP-2、MMP-9相关性
Fig.3 The correlation of EZH2 with MMP-2 and MMP-9 in HCC tissues was analyzed by Pearson correlation analysis
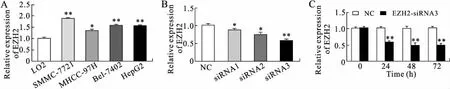
图4 转染小干扰RNA下调SMMC-7721细胞中EZH2表达
Fig.4 Down-regulated expression of EZH2 in SMMC-7721 cells
A:肝癌细胞系和LO2细胞中EZH2表达;B:3号小干扰RNA抑制EZH2明显;C:qRT-PCR结果显示小干扰RNA转染SMMC-7721细胞24、48、72 h后EZH2表达。与对照组比较,*P<0.05,**P<0.01。
2.7 EZH2表达下调对肝癌细胞侵袭和迁移能力的影响Transwell小室结果显示,与对照组(SMMC-7721-NC)相比,抑制EZH2表达的SMMC-7721细胞侵袭和迁移细胞数目减少,差异有统计学意义(P<0.01,图5)。
2.8 肝癌细胞中EZH2对MMP-2,MMP-9表达的影响qRT-PCR结果显示,与对照组(SMMC-7721-NC)比较,EZH2表达下调明显抑制MMP-9表达水平(P<0.01,图6),但对MMP-2表达无明显影响。结合临床组织标本检测的结果,提示EZH2可能通过促进MMP-9表达调控肝癌侵袭和转移。
3 讨 论
本研究首次揭示EZH2与MMP-2、MMP-9在肝癌组织中表达的相关性,通过分析EZH2,MMP-2和MMP-9在HCC中的临床病理价值,初步探讨了EZH2、MMP-2和MMP-9与HCC发生发展的关系。原发性肝癌是一种预后较差的恶性肿瘤,其5年生存率不足5%。一方面,由于HCC早期通常无典型临床表现,生长发展迅速,大多数患者确诊时已处于晚期,丧失了手术时机;而另一方面,由于HCC高侵袭和转移的特性,导致HCC患者在手术治疗后较短时间即发生复发和转移,从而HCC预后不良。EZH2是polyeomb group(PcG)基因家族的核心成员,与其他PcG成员蛋白共同组成PRC2核心复合物,从而发挥组蛋白甲基转移酶活性,催化组蛋白甲基化修饰[11]。EZH2同样是新近发现的与人类恶性肿瘤发生密切相关的重要癌基因,目前已在多种癌细胞中检测到了EZH2的过表达或突变,并且其变化与胆囊癌、卵巢癌、乳腺癌等多种癌症发生发展密切相关[12-14]。本研究结果表明,同癌旁正常肝组织相比,EZH2在HCC组织内呈高表达。更重要的是,本研究结果证实在HCC组织中EZH2表达与AFP水平、肿瘤病理分级、微血管侵犯及临床分期密切相关。进一步提示EZH2在肝癌发生发展,尤其是侵袭转移中发挥重要作用。
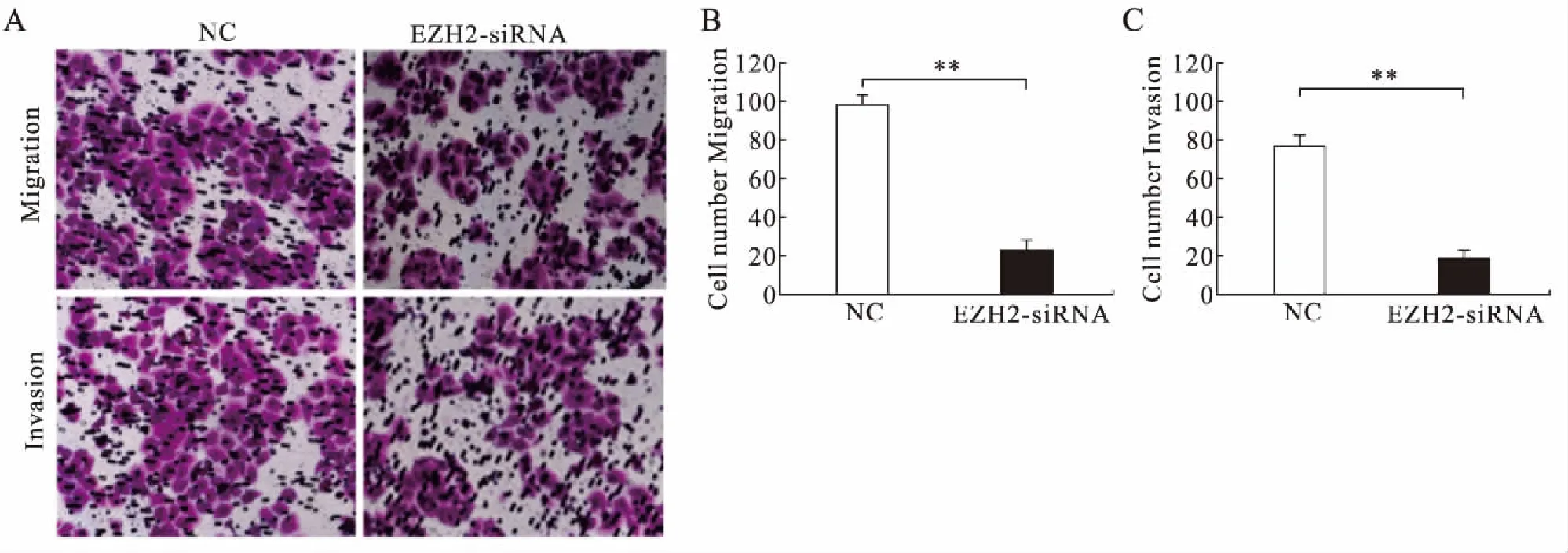

图5 转染EZH2-siRNA明显抑制SMMC-7721细胞迁移和侵袭Fig.5 Deletion of EZH2 inhibited SMMC-7721 invasion and migration与对照组SMMC-7721-NC细胞相比,**P<0.01。
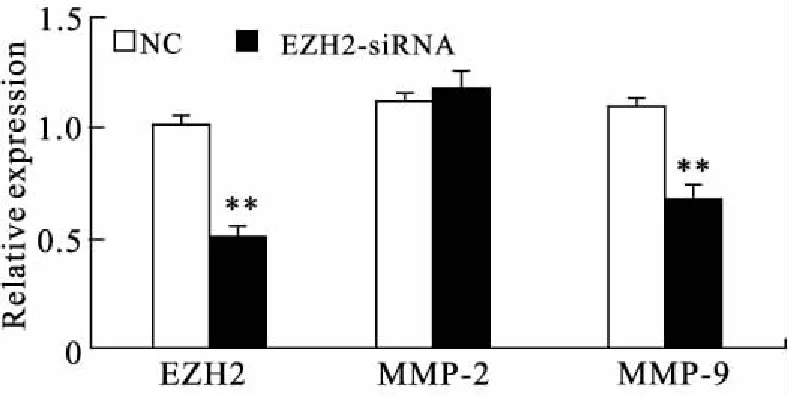
图6 SMMC-7721细胞中下调EZH2对MMP-2和MMP-9的影响
Fig.6 Decreased EZH2 inhibited MMP-9 expression but not MMP-2 expression
MMP-2、MMP-9属于MMPs家族成员Ⅳ型胶原酶,核心功能是分解基底膜胶原和明胶[15-17],在恶性肿瘤侵袭转移过程中发挥重要作用。WANG等[18]证实了MMP-2在肝癌组织和正常肝组织中表达存在明显差异性,MMP-2与HIF-1α协同作用与原发性肝细胞癌发生发展密切相关。MMP-9与S100A4、miR155-SOCS1共同构成作用轴促进HCC转移[19]。我们的数据支持这些研究结果:同癌旁正常肝组织相比,MMP-2、MMP-9在HCC组织内呈高表达;进一步分析结果显示,MMP-2在HCC组织中与微血管侵犯、肿瘤数目及病理分级密切相关,MMP-9在HCC组织中的表达与临床分期、微血管侵犯及病理分级密切相关。提示MMP-2和MMP-9表达升高和原发性肝癌的发生,转移和侵袭密切相关。
值得注意的是,本研究还暗示了EZH2很可能通过MMP-9而不是MMP-2参与HCC转移过程。既往研究提示,EZH2通过诱导H3K27三甲基及启动子甲基化,在转录水平上调控下游基因E-cadherin、P16INK4和p57等基因异常表达[20-22],促进恶性肿瘤发展,并且与恶性肿瘤侵袭和转移密切相关。VARAMBALLY等[23]报道,在转移前列腺癌中EZH2表达明显上调。EZH2还被证实通过沉默p57表达促进乳腺癌转移[24]。既往研究虽然提示EZH2与肝癌的发生发展有关[25],但回顾文献对于EZH2如何在HCC侵入迁移过程中发挥作用尚存在疑问。MMPs家族成员中,MMP-2、MMP-9通过破坏基底膜屏障和对细胞外基质的改造促进HCC新生血管的生成,从而促进HCC的侵袭和迁移。在本研究中发现,HCC组织中EZH2表达上调与MMP-2在HCC中的表达水平无明显相关性,而与MMP-9较高表达水平密切相关。细胞学实验同样证实了EZH2表达变化不影响MMP-2表达,但可以影响MMP-9表达。这些结果提示我们EZH2可能通过MMP-9而不是MMP-2发挥促进HCC迁移和侵袭的作用。EZH2与MMP-9可能协同促进HCC的发生发展,但是二者间相互调控机制尚需进一步的研究证实。
综上所述,HCC组织中EZH2、MMP-2和MMP-9呈高表达,三者表达上调均与HCC患者微血管侵犯及病理分级相关,提示EZH2、MMP-2和MMP-9参与HCC的分化和转移。此外,EZH2表达与HCC患者AFP水平及临床分期密切相关;MMP-2与肿瘤数目相关;MMP-9与临床分期密切相关,进一步提示三者在HCC发生、发展中有重要作用。Transwell小室实验证实了EZH2可促进肝癌细胞侵袭和迁移。相关性分析提示在HCC组织中EZH2与MMP-2无明显相关,而与MMP-9表达密切相关;EZH2在肝癌细胞中影响MMP-9表达,但不影响MMP-2表达。这些结果为筛选新的HCC有效的生物标记物及潜在治疗靶点提供了前期的实验依据。

