褪黑素通过Nrf2/HO-1信号通路减轻大鼠脑缺血再灌注损伤
巩敏杰,安佳琪,吴 锋,唐永兰,祁 艺,袁惠婕,罗国刚
(1. 西安交通大学第一附属医院神经内科,陕西西安 710061;2. 西安交通大学医学部,陕西西安 710061)
缺血性脑卒中是我国最常见的脑卒中类型,具有高病死率、致残率。目前治疗缺血性脑卒中最有效的方法是血管再通治疗[1],但血管再通后存在缺血再灌注损伤[2]。褪黑素是松果体释放的色氨酸代谢产物,除了调节睡眠外,还是一种高效的自由基清除剂[3]。研究发现,脑缺血后给予褪黑素可以明显减少梗死体积[4]。目前的研究发现,褪黑素对脑缺血再灌注的保护作用主要是直接对氧自由基的清除和间接提高抗氧化应激蛋白的表达,但具体机制仍不明确[5]。核因子-E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)是内源性抗氧化防御的关键调控因子之一,可以促进多种抗氧化基因转录,包括血红素氧化酶-1(heme oxygenase-1, HO-1)[6]。研究发现,Nrf2能减轻脑缺血再灌注损伤,且Nrf2对脑缺血再灌注的保护作用也是通过调控下游抗氧化蛋白实现的[7],但褪黑素对Nrf2/HO-1调控的研究甚少。因此,本研究旨在探讨脑缺血再灌注损伤后褪黑素处理的保护作用及褪黑素对Nrf2/HO-1的调控机制。
1 材料与方法
1.1 实验动物及分组250~300 g雄性SD大鼠99只,由西安交通大学医学部实验动物中心提供,并获得西安交通大学动物实验管理委员会批准。实验中大鼠饲养于室温(24±1)℃、相对湿度(45±5)%、日光灯照射12 h明暗交替的标准动物房,动物自由摄食、饮水。将99只SD大鼠编号并按随机数字表法分为假手术组、脑缺血再灌注组、褪黑素处理组,每组33只。
1.2 主要试剂及器材线栓(北京西浓科技有限公司),尼氏染液(西安赫特生物),Nrf2(Abcam公司),HO-1(Proteintech公司),β-actin(博奥森生物技术有限公司),褪黑素(Sigma公司)
1.3 脑缺血再灌注模型的制作及评价参照LONGA等[8]的造模方法,70 g/L水合氯醛5 mL/kg腹腔注射全身麻醉,分离颈总动脉、颈内动脉、颈外动脉,结扎颈外动脉及颈总动脉近心端,从颈总动脉远心端将线栓从颈总动脉分叉处送至颈内动脉(18±2)mm,90 min后拔出线栓造成再灌注损伤。假手术组暴露并结扎血管但未插入线栓。动物麻醉清醒后,参照longa5级评分法选取模型动物:0分,无神经损伤;1分,提尾时对侧前肢内收屈曲;2分,爬行时向对侧旋转;3分,站立或爬行时向对侧倾倒;4分,无自主活动伴意识丧失。选取1~2分的大鼠为成功的动物模型。
1.4 给药方法褪黑素溶于3.43 mol/L无水乙醇生理盐水溶液中,褪黑素处理组在灌注即刻和12 h后按5 mg/kg体质量腹腔注射褪黑素,脑缺血再灌注组腹腔注射3.43 mol/L无水乙醇生理盐水溶液,药物处理至1、3、7 d。
1.5 神经功能评分实验动物在褪黑素处理1、3、7 d后采用改良Garcia JH评分评价大鼠神经功能缺损情况,改良Garcia JH评分包括自主运动、体态、前肢伸展运动、抓持和攀爬铁笼的能力、两侧身体触觉反射和两侧胡须触碰反应6部分内容,可以全面评估大鼠神经功能情况。得分越高神经功能越好,最高分18分。
1.6 尼氏染色二甲苯2次10 min脱蜡,无水乙醇2次5 min,16.3 mol/L乙醇和14.6 mol/L乙醇各3 min,自来水冲洗后用蒸馏水漂洗,后用37 ℃预热的尼氏染色液染色8 min,蒸馏水漂洗后脱水、透明中性树胶封片。
1.7 HE染色将大鼠用PBS灌注后用40 g/L多聚甲醛固定,脑组织后固定48 h后常规石蜡包埋后切片,依次脱蜡、脱水、苏木素及伊红染色,后脱水透明中性树胶封片。
1.8 免疫组化法检测Nrf2及HO-1的表达将大鼠用PBS灌注后用40 g/L多聚甲醛固定,后固定48 h后常规石蜡包埋后切片,依次脱蜡、脱水后,30 mL/L H2O2溶液浸泡20 min,自来水冲洗,柠檬酸抗原微波修复20 min,自然冷却至室温后,BSA室温封闭30 min,一抗4 ℃过夜,PBS 3次5 min漂洗,二抗37 ℃孵育30 min,PBS 3次5 min漂洗后DAB显色,苏木素复染、氨水返蓝,梯度脱水,二甲苯透明,中性树胶封片,镜下观察。
1.9 Western blot方法检测Nrf2及HO-1的表达将大鼠用预冷的PBS灌注后,断头取脑,参照ASHWAL等[9]的方法取大鼠脑缺血半暗带,在距额叶前端3 mm和9 mm处做冠状切割,取中间6 mm厚的脑组织块,然后沿此脑块矢状缝两侧旁开2 mm处切去中间区域,后沿矢状切面旁开2 mm处,并和矢状切面呈30度夹角斜切,内侧皮层即为缺血半暗带。冰上裂解30 min提取蛋白,测定蛋白浓度后煮样。设置80 V、30 min,110 V、120 min进行电泳,转膜后50 g/L脱脂奶粉封闭80 min,用TBST稀释一抗(Nrf2,1∶1 000;HO-1,1∶2 000),4 ℃过夜孵育,3次10 min洗膜后加二抗(1∶5 000)室温孵育80 min,3次10 min洗膜后,使用ECL发光系统显像。使用Image J软件进行灰度值(DPI)分析。
1.10 统计学处理本研究中所有数据用SPSS 18.0进行统计分析,用Graphpad Prism6.0绘制所有图表,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 各组大鼠改良Garcia JH评分褪黑素处理1 d、3 d和7 d时根据GARCIA等[10]的神经缺损评分法对3组大鼠进行神经缺损评分,对3组数据进行单因素ANOVA分析。对比3组数据可见,褪黑素处理组在3个时间的神经评分均较缺血再灌注组高(P<0.05,图1)。
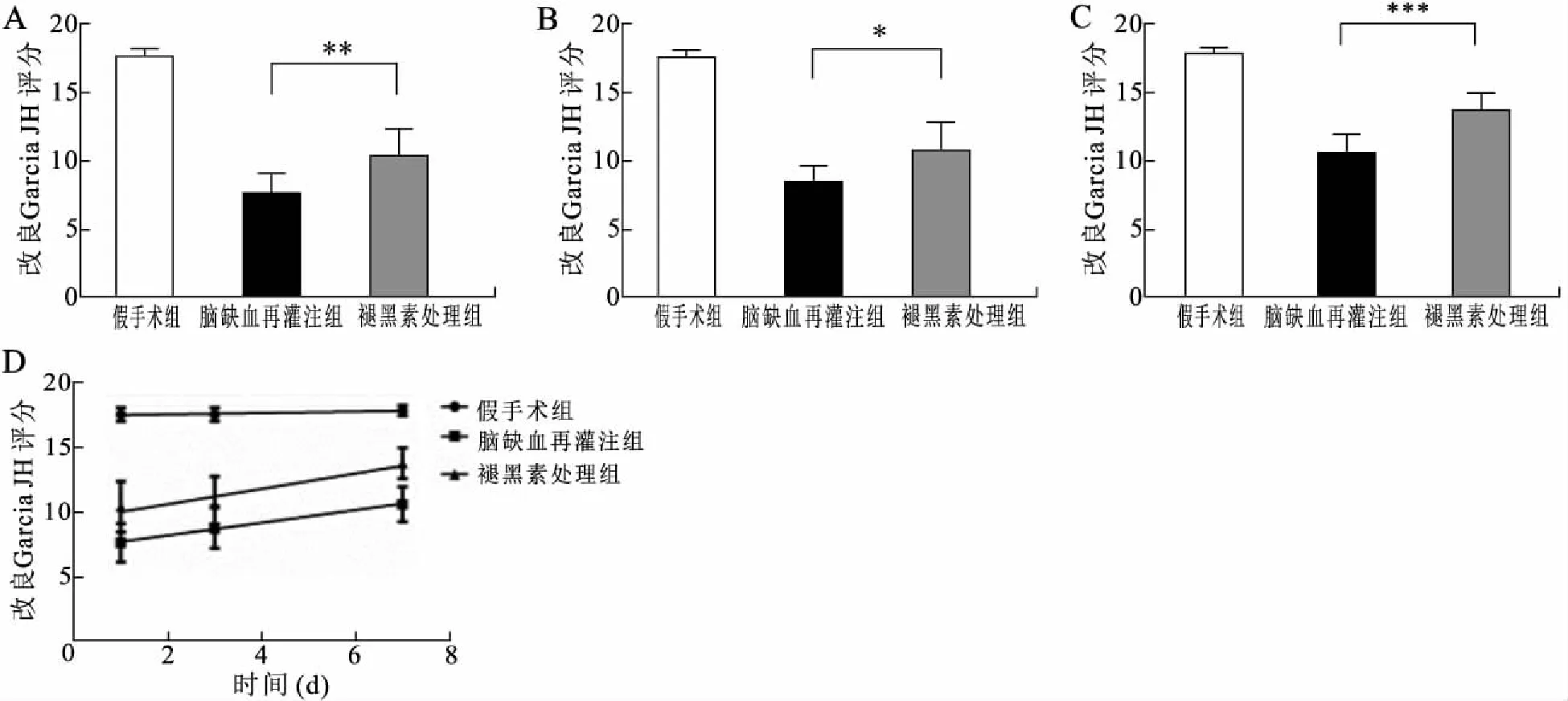

图1 改良Garcia JH评分Fig.1 Modified Garcia JH scoreA:1d时,与脑缺血再灌注组比较,**P<0.01;B:3d时,与脑缺血再灌注组比较,*P<0.05;C:7d时,与脑缺血再灌注组比较,***P<0.001;D:各组大鼠神经功能评分变化趋势。
2.2 各组大鼠脑梗死面积的比较在1 d时用尼氏染色法观察脑梗死面积,用梗死面积比同侧总脑面积发现,与脑缺血再灌注组相比,褪黑素处理组梗死面积占病灶侧脑面积比值较小(图2)。
2.3 脑梗死灶神经元形态的变化低倍镜下假手术组无梗死组织,脑缺血再灌注组和褪黑素处理组可见染色较浅的梗死灶区和染色较深的正常区域。高倍镜下可见假手术组神经元形态完整及尼氏体;而缺血再灌注组梗死灶神经元正常结构消失,神经元皱缩,树突及尼氏体消失;褪黑素处理组神经元正常结构消失但大体形态仍存在,神经元皱缩较缺血再灌注组程度轻(图3)。
2.4 褪黑素处理24 h后各组Nrf2和HO-1表达变化各组大鼠在24 h后,Western blot检测Nrf2、HO-1和β-actin蛋白含量,并进行灰度值分析(DPI),进一步分别计算Nrf2、HO-1的相对表达量。结果显示,在24 h时与脑缺血再灌注组相比,褪黑素处理组Nrf2表达量较高,但无统计学意义;褪黑素处理组的HO-1较脑缺血再灌注组表达量高(P<0.05,图4)。

图2 梗死面积
Fig.2 Area of cerebral infarction
A:假手术组;B:脑缺血再灌注组;C:褪黑素处理组。白色虚线框选的区域为梗死区域。

图3 大鼠脑梗死灶神经元形态的变化
Fig.3 Morphological changes of neurons in cerebral infarction
A~C分别为假手术组、脑缺血再灌注组、褪黑素处理组10×10倍镜下的组织形态;D~F分别为假手术组、脑缺血再灌注组、褪黑素处理组10×40倍镜下的组织形态。△为梗死灶区,↑为神经元。

图4 各组大鼠脑缺血半暗带Nrf2和HO-1的表达变化
Fig.4 Expression levels of Nrf2 and HO-1 in cerebral ischemic penumbra of rats
A:各组大鼠缺血半暗带HO1和Nrf2的表达,1~3分别为假手术组、脑缺血再灌注组、褪黑素处理组;B:各组大鼠脑缺血半暗带Nrf2的相对表达比较,ns:组间差异无统计学意义;C:3组大鼠脑缺血半暗带HO-1相对表达比较,与脑缺血再灌注组相比较,*P<0.05。
2.5 HO-1表达情况用免疫组化的方法检测HO-1表达情况,结果显示,假手术组在低倍镜下可见较少散在的阳性细胞,而脑缺血再灌注组和褪黑素处理组在低倍镜下可见HO-1主要表达在梗死灶与正常组织交界处,而褪黑素处理组后增加了阳性细胞的表达范围(图5)。
2.6 褪黑素处理3 d后各组Nrf2和HO-1表达变化各组大鼠在3 d后,用Western blot方法检测Nrf2、HO-1和β-actin蛋白含量,并进行灰度值分析(DPI),进一步分别计算Nrf2、HO-1相对表达量。结果显示,3 d时在梗死核心区褪黑素处理组Nrf2较脑缺血再灌注组表达量高(P<0.05);3 d时在梗死核心区褪黑素处理组HO-1较脑缺血再灌注组表达量高(P<0.001,图6)。而在梗死灶周围褪黑素处理组HO-1较脑缺血再灌注组表达量高(P<0.001),Nrf2表达量较脑缺血再灌注组表达量高,但无统计学意义(图7)。
2.7 各组GFAP和NF200的表达情况在3 d和7 d两个时间点,假手术组GFAP可见散在的阳性细胞,脑缺血再灌注组可见大量GFAP阳性细胞,这些阳性细胞胞体肥大、突起增粗、延长,褪黑素处理组也可见大量GFAP阳性细胞,但阳性细胞数量较脑缺血再灌注组少,阳性细胞胞体肥大、突起增粗、延长不如脑缺血再灌注组明显(图8)。假手术组3 d和7 d两个时间点NF200阳性细胞较少,脑缺血再灌注组和褪黑素处理组在3 d和7 d可见大量NF200阳性细胞,但脑缺血再灌注组在3 d和7 d的阳性细胞较褪黑素处理组少(图9)。

图5 大鼠脑组织HO-1的表达情况
Fig.5 HO-1 expression in rat brain tissues
A~C分别为假手术组、脑缺血再灌注组、褪黑素处理组10×10倍镜下HO-1阳性细胞;D~F分别为假手术组、脑缺血再灌注组、褪黑素处理组10×20倍镜下HO-1阳性细胞。△和分别为梗死灶区和正常区域,↑为阳性细胞。

图6 各组大鼠3 d时梗死核心区Nrf2、HO-1表达变化
Fig.6 The expression levels of Nrf2 and HO-1 in the infarct area of rats at 3 d
A:褪黑素处理3 d后各组的梗死核心区HO-1和Nrf2表达,1~3分别为假手术组、脑缺血再灌注组、褪黑素处理组;B:3组大鼠Nrf2的相对表达比较,与脑缺血再灌注组比较,*P<0.05;C:3组大鼠HO-1的相对表达,与脑缺血再灌注组比较,***P<0.001。

图7 各组大鼠3 d时的梗死核心区与正常组织交界处Nrf2、HO-1表达
Fig.7 The expression levels of Nrf2 and HO-1 at the junction of infarct and normal tissues after 3 d
A:3 d时各组的梗死核心区与正常组织交界处HO-1和Nrf2表达,1~3分别为假手术组、脑缺血再灌注组、褪黑素处理组;B:3组大鼠Nrf2的相对表达比较,ns:组间差异无统计学意义;C:3组大鼠HO-1的相对表达比较,与脑缺血再灌注组相比,***P<0.001。

图8 褪黑素处理3 d和7 d时3组大鼠脑组织梗死灶周围GFAP表达情况
Fig.8 The expression of GFAP after melatonin treatment for 3 and 7 days (×400)
A、B、C分别为假手术组、脑缺血再灌注组和褪黑素处理组在3 d时的GFAP的表达情况;D、E、F分别为假手术组、脑缺血再灌注组和褪黑素处理组在7 d时GFAP的表达情况。↑为GFAP阳性细胞。

图9 褪黑素处理3 d和7 d时各组大鼠脑组织梗死灶周围NF200表达情况
Fig.9 The expression of NF200 after melatonin treatment for 3 and 7 days (×200)
A、B、C分别为假手术组、脑缺血再灌注组和褪黑素处理组在3 d时的NF200的表达情况;D、E、F分别为假手术组、脑缺血再灌注组和褪黑素处理组在7 d时NF200的表达情况。↑为NF200阳性细胞。
3 讨 论
缺血性脑卒中是因颅脑血管阻塞引起脑血流供应障碍,进而造成脑组织缺血缺氧性坏死,出现突发神经功能缺损的疾病,血管再通后往往会发生再灌注损伤[11]。目前认为,再灌注损伤与氧化应激、兴奋性氨基酸释放等有关[12]。研究表明,Nrf2在氧化应激造成的再灌注损伤中具有重要的保护作用。ZHAO等[13]发现,小鼠永久性脑梗死模型中缺血区皮质的Nrf2和下游蛋白HO-1等的表达量在24 h时明显上升;然而,TANAKA等[14]发现,在小鼠脑缺血再灌注模型中Nrf2的表达是一个动态变化过程,半暗带Nrf2在2 h时表达增高,在8 h时达到顶峰,而在24 h和72 h时已经表达量开始下降。在正常情况时,Nrf2位于细胞质中与keap1而很快被降解,当细胞在脑缺血过程中受到氧化应激时,Nrf2与Keap1分离,进入细胞核,并与ARE序列结合,从而上调其靶基因的表达,保护脑组织[15]。HO-1是Nrf2的下游蛋白。研究发现,HO-1在脑缺血再灌注损伤中具有重要作用。CUI等[16]发现在脑缺血再灌注24 h时HO-1表达量上升,而LIU等[17]发现,永久性脑梗死模型中HO-1的高表达可持续至少3 d。本研究发现,在24 h时脑缺血再灌注组Nrf2表达减低,在3 d的表达量与假手术组无差异,这与TANAKA等的研究一致,而脑缺血再灌注组HO-1的高表达持续至3 d,这与LIU等[17]的研究一致。
褪黑素是松果体分泌的一种神经激素,它具有广泛的调节和保护作用,如同步昼夜节律,防止氧化应激,调节能量代谢,调节免疫系统,延缓衰老过程等[18]。此外,许多研究发现,不同剂量的褪黑素对缺血性脑卒中均有保护作用。LI等[19]研究发现,褪黑素可通过降低再灌注后Nox2和Nox4的表达抑制ROS生成,减轻氧化应激损伤,保护脑组织;BHATTACHARYA[20]等发现,褪黑素保护缺血性脑卒中可能与梗死区AQP4下调后减轻脑水肿有关;WEI等[21]的研究提示,褪黑素通过激活Yap-Hippo通路,降低脑再灌注应激保护脑组织。然而,褪黑素保护脑缺血再灌注损伤的机制仍不明确。目前对于褪黑素参与调控脑缺血后Nrf2/HO-1的研究甚少。本研究在再灌注即刻和再灌注12 h后对模型大鼠腹腔注射5 mg/kg褪黑素7 d发现,褪黑素能够改善模型大鼠的神经功能,同时褪黑素能增加1 d和3 d时Nrf2和HO-1的表达量,提示褪黑素对脑缺血再灌注损伤的保护作用可能通过Nrf2/HO-1信号通路。
神经胶质纤维酸性蛋白(GFAP)反映星形胶质细胞增生活化,但大量GFAP的堆积是星形胶质细胞参与胶质瘢痕形成的重要物质基础[22]。星形胶质细胞的过度增殖活化会促进胶质瘢痕形成,对轴突的再生具有阻碍作用,不利于神经功能的恢复[23]。WANG等[24]研究发现,褪黑素能减轻星形胶质细胞的活化。本研究发现,褪黑素处理至3 d和7 d时能减少GFAP的生成,这与上述研究结果一致。中枢神经系统中NF200反映神经轴突的生长[25]。我们发现,星形胶质活化程度较低时,反应轴突生长的NF200生成较多,说明褪黑素处理可以减轻脑卒中后星形胶质细胞的增殖活化,促进神经轴突生长。
综上所述,本研究认为,在脑缺血再灌注时即刻5 mg/kg褪黑素处理,对脑缺血再灌注有保护作用,可能是因为提高了内源性抗氧化防御调控因子Nrf2和下游蛋白HO-1的表达量;同时发现,褪黑素处理3 d和7 d后可以减轻星形胶质细胞的增殖活化,促进神经功能的恢复。

