姜黄素通过增强心肌自噬活性改善自身免疫性心肌炎大鼠的心功能
郜珊珊,霍建华,王 晨,邓伏雪,王丽君,强 华
(1. 西安交通大学第一附属医院心内科,陕西西安 710061;2. 陕西省分子心脏病学重点实验室,陕西西安 710061;3. 环境与疾病相关教育部重点实验室,陕西西安 710061)
心肌炎(myocarditis, MC)是一种以心肌细胞坏死、变形及心肌间质广泛炎症细胞浸润为主要特点的心肌疾患,也是扩张型心肌病(dilatedcardio-myopathy, DCM)和猝死的常见原因,自身免疫反应是其重要的病理机制[1]。自噬是细胞的“自我吞噬”,它是将坏死的蛋白质、残留的细胞器、细胞内的病毒及细菌病原体输送到溶酶体并降解或者回收,使因此形成的大分子进行再循环的一个过程。自噬已被证实在多种疾病的发生及进展过程中发挥保护性作用[2-3],并且有研究显示增强自噬活性能起到改善心脏功能的作用[4-5]。
姜黄素是从植物姜黄中提取而来,具有抗炎、抗氧化、抗肿瘤、免疫调节等作用[6]。本课题组前期研究发现,姜黄素能够通过诱导巨噬细胞向其抗炎亚型(M2型)分化、抑制心肌炎症并改善自身免疫性心肌炎(experimental autoimmune myocarditis, EAM)大鼠心脏功能[7]。另有研究发现姜黄素能够通过促进自噬和减轻细胞凋亡而预防糖尿病性心肌病的发生[8]。姜黄素能否通过诱导EAM大鼠心肌细胞的自噬活性从而改善其心功能,目前相关文献报道较少。本研究以EAM大鼠为研究对象,观察姜黄素干预后能否通过激活自噬活性改善模型大鼠心脏功能。
1 材料与方法
1.1 材料体质量230~280 g的健康雄性Lewis大鼠,共21只,购自北京维通利华实验动物有限公司。实验用姜黄素、猪心肌肌球蛋白、弗氏佐剂均购自美国Sigma公司;玉米油购自中国长寿花食品股份有限公司;兔抗大鼠LC3抗体购自美国Cell Signaling Technology公司;GAPDH购自中国Proteintech公司;抗兔二抗购自美国Abbkine公司;其余常规试剂均为国产分析纯;Real-time PCR引物序列均由上海捷瑞基因公司合成。免疫大鼠所用抗原佐剂乳化液由猪心肌肌球蛋白和弗氏完全佐剂乳化后获得。
1.2 动物模型建立与分组EAM大鼠模型的建立按照本课题组之前建立的造模方法进行。将大鼠随机分组(n=7),即对照组(Con组)、模型组(EAM组)及姜黄素处理组(Cur组)。在实验第0天和第7天时,于大鼠左右后足垫处皮下注射弗氏完全佐剂(Con组)或抗原佐剂乳化液(EAM组和Cur组)各0.1 mL,并以等量玉米油(Con组和EAM组)或姜黄素50 mg/(kg·d)(Cur组)灌胃。灌胃干预21 d。大鼠饲养在西安交通大学医学部实验动物中心SPF级实验动物房,给予普通SPF级无菌饲料喂养直至实验结束,期间不限制大鼠摄食及饮水[9]。
1.3 心动超声检查实验第22天(干预结束后次日),用90 mg/kg氯胺酮+10 mg/kg甲苯噻嗪混合溶液腹腔注射麻醉大鼠,使用PHILIPS B型超声诊断仪(iE33)行心动超声检查,检测如下指标:心率(heart rate, HR)、射血分数(ejection fraction, EF)、左室收缩末内径(left ventricular end-systolic diameter, LVEDs)、左室舒张末内径(left ventricular end-diastolic diameter, LVEDd)、室间隔厚度(left ventricular diastolic interventricular septum thickness, LVS)、左室短轴缩短率(left ventricular fractional shortening, LVFS)、左室后壁厚度(left ventricular posterior wall thickness, LVPW);各项测量值均选取5个连续心动周期采样后获得的平均值。
1.4 Western blot检测行心动超声检查后,处死大鼠并获取心肌组织。从大鼠心肌组织中提取蛋白进行Western blot检测。一抗选用兔抗大鼠LC3抗体,稀释比为1∶1 000;二抗选用辣根过氧化酶标记山羊抗兔抗体,稀释比为1∶2 000,使用GAPDH作为内参,稀释度为1∶5 000。运用Image-Pro Plus 5.0图像分析软件测定条带的灰度值。
1.5 Real-time PCR检测从大鼠心肌组织中提取总RNA,使用Fermentas逆转录试剂盒将总RNA逆转录为cDNA。以GUSB为内参,采用SYBR Green荧光嵌合法,检测Beclin-1/ATG-5基因mRNA表达。各引物序列见表1。
表1 Real-time PCR各基因的引物序列
Tab.1 Sequences of Real-time PCR primers of genes
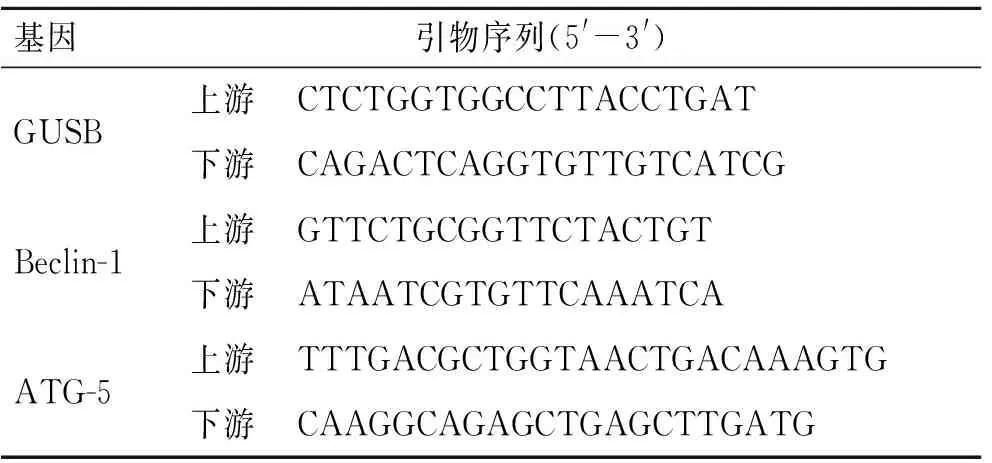
基因引物序列(5'-3')GUSB上游CTCTGGTGGCCTTACCTGAT下游CAGACTCAGGTGTTGTCATCGBeclin-1上游GTTCTGCGGTTCTACTGT下游ATAATCGTGTTCAAATCAATG-5上游TTTGACGCTGGTAACTGACAAAGTG下游CAAGGCAGAGCTGAGCTTGATG

2 结 果
2.1 姜黄素改善EAM大鼠心脏结构和功能姜黄素干预21 d后,第22天(即干预后次日)将大鼠麻醉后进行心动超声检查的结果显示:与Con组相比,EAM组大鼠HR明显增快(P<0.001);给予姜黄素50 mg/(kg·d)灌胃处理后,Cur组大鼠HR较EAM组减慢(P=0.001)。EAM组大鼠心脏EF较Con组明显降低(P<0.001);姜黄素灌胃后,EAM大鼠EF升高并恢复至对照组水平(P<0.001)。EAM组大鼠LVEDs明显增加,而LVFS明显降低,提示EAM组大鼠存在左室收缩功能异常;给予姜黄素处理后,Cur组大鼠LVEDs明显减小(P=0.030),LVFS升高(P=0.019),差异均具有统计学意义(P<0.05)。这提示EAM大鼠左室收缩功能发生障碍,且该心功能障碍可被姜黄素逆转(表2)。
表2 各组大鼠心脏超声结果及血液动力学改变
Tab.2 Echocardiographic and hemodynamic parameters in each group of rats

指标Con(n=7)EAM(n=7)Cur(n=7)FPHR(次/min)447.30±10.22540.17±12.25**477.09±14.20##89.19<0.001EF(%)80.01±2.7871.99±1.90**81.42±2.00##30.28<0.001LVEDs(mm)2.77±0.283.78±1.01*2.87±0.14##5.680.012LVEDd(mm)5.99±0.396.02±0.475.56±0.252.490.110LVFS(%)47.81±3.9142.34±6.79**46.57±2.77#7.600.004LVPW(mm)0.99±0.061.07±0.031.12±0.031.780.195
Con:对照组;EAM:心肌炎模型组;Cur:姜黄素干预组;HR:心率;EF:射血分数;LVEDs:左室收缩末内径;LVEDd:左室舒张末内径;LVFS:左室短轴缩短率;LVPW:左室后壁厚度;数值以均数±标准差表示;与Con组比较,*P<0.05,**P<0.01;与EAM组比较,#P<0.05,##P<0.01。
2.2 姜黄素促进EAM大鼠心肌LC3的表达LC3是自噬体发挥功能的相关蛋白,其表达水平的高低能够反映心肌自噬活性的变化。本实验各组间LC3蛋白表达有差异(F=20.43,P=0.001,图1),EAM组大鼠LC3的表达高于Con组,差异有统计学意义(P=0.026);而给予姜黄素处理后,LC3表达较EAM组进一步显著升高,且差异具有统计学意义(P=0.014)。
2.3 心肌Beclin-1的表达情况Beclin-1和 ATG-5均为LC3的上游基因,是参与自噬调控的关键因子。Real-time PCR实验检测结果显示:各组间Beclin-1表达有差异(F=29.38,P=0.001),EAM大鼠心肌组织内的表达较Con组升高(P=0.041);给予姜黄素干预后,Cur组大鼠心肌组织内Beclin-1表达较EAM组进一步升高(P=0.003),而ATG-5表达虽在EAM组及Cur组大鼠中表现出升高趋势,但并无统计学意义(F=2.877,P=0.108,图2)。提示姜黄素促进EAM大鼠心肌Beclin-1表达,对ATG-5基因表达无明显作用。
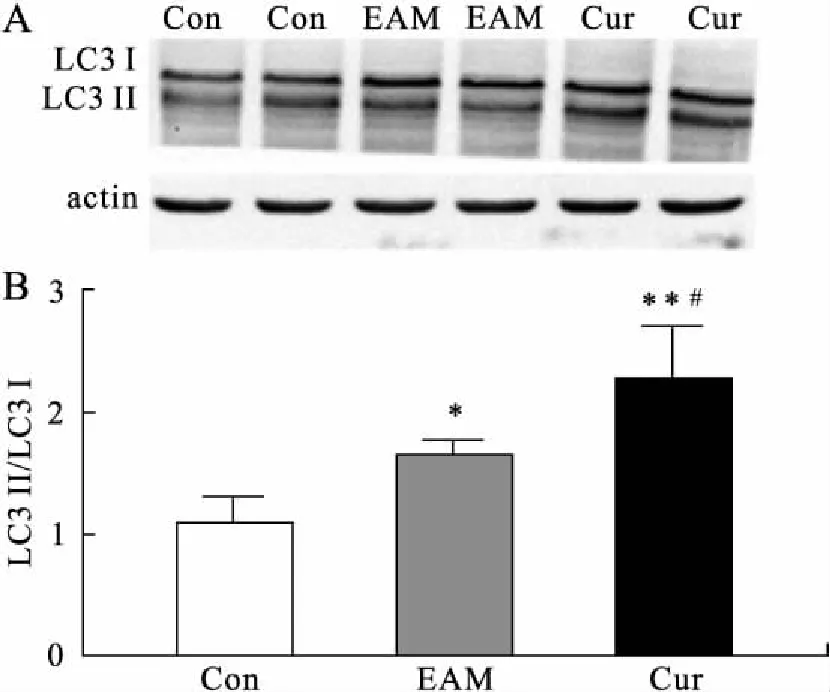
图1 姜黄素对大鼠心肌细胞LC3蛋白表达的影响
Fig.1 Effect of curcumin on the protein expression of LC3 in the myocardium of EAM rats (n=7)
与Con组比较,*P<0.05,**P<0.01;与EAM组比较,#P<0.05。
3 讨 论
本实验以Lewis大鼠为研究对象,通过足垫注射猪心肌肌球蛋白构建EAM模型,给予姜黄素灌胃处理后,观察大鼠心脏功能及心肌细胞自噬活性的变化。结果显示,EAM组大鼠出现左室收缩功能异常及心脏EF降低,同时心肌自噬活性较Con组大鼠升高,与HU等[10]的报道一致;给予50 mg/(kg·d)的姜黄素干预21 d后,不仅心肌炎大鼠左室收缩功能及心脏EF得到改善,并且心肌细胞自噬活性较对照组及模型组显著升高,通过进一步探究自噬上游基因表达变化,发现姜黄素能够促进自噬调控基因Beclin-1 mRNA表达。
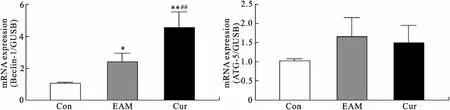
图2 姜黄素对EAM大鼠心肌细胞LC3上游因子表达的影响
Fig.2 Effect of curcumin on the expression of LC3 up-stream factors in the myocardium of EAM rats
与Con组比较,*P<0.05,**P<0.01;与EAM组比较,##P<0.01。
自噬是广泛存在于真核细胞内的一种程序性细胞死亡机制。细胞通过自噬作用能够完成对胞内衰老的蛋白质及受损的细胞器重新加工再利用,并为自身提供能量以维持细胞正常代谢、更新细胞器及保持细胞内环境稳态。LC3是第一个被发现的自噬体标记蛋白,其表达水平高低能够反映体内自噬活性的强弱。Beclin-1是最早发现的哺乳动物自噬调控基因,是自噬体早期形成调控的关键因子。ATG-5在自噬体形成阶段与ATG-12及ATG-16形成多聚体后作用于自噬前体,参与自噬体的延伸。自噬在基础条件下呈现出低水平活性,能够调控衰老死亡的蛋白质或受损细胞器的再利用,发挥着细胞管家的作用[2-3]。既往多项研究证实,自噬活性增强能够改善心脏功能。GU[4]以心肌梗死后发生糖尿病的大鼠为研究对象,发现西格列汀可通过激活自噬并抑制心肌梗死后糖尿病的炎症反应从而改善大鼠的心脏功能并降低其死亡率。WANG[5]发现环丝氨酸通过促进心肌细胞自噬和抑制MMP-2和MMP-9表达,改善心脏功能障碍。
研究发现,Th-1相关细胞因子,如IFN-γ、TNF-α、IL-1β等,能够诱导自噬发生;而IL-4和IL-10等Th2相关细胞因子则能够抑制自噬的表达[11]。本课题组之前的研究发现,心肌炎大鼠心肌细胞中炎症因子IL-1β的表达较对照组明显升高[7],提示EAM大鼠机体内的高炎症状态可能促进自噬表达。但EAM组大鼠的心功能较对照组恶化,提示此时自噬活性的增强虽有可能起到一定的心肌保护作用,尚未达到能够显著改善心脏功能的活性状态。
已有研究发现,不同的病理生理条件下和疾病过程中,姜黄素对自噬的调节作用有可能不同。体外研究发现姜黄素能够通过抑制PI3K、促进Beclin-1和Bcl-2的解离,增加细胞质中游离的Beclin-1,以及干扰FOXO1的核定位而发挥其诱导自噬的作用[12]。LIU[13]的研究发现,姜黄素通过诱导自噬及凋亡抑制非小细胞肺癌细胞的增殖与活化从而起到抗肿瘤作用。HUANG[14]发现姜黄素能够通过抑制自噬改善实验大鼠脑部的缺血再灌注损伤。然而,本研究中给予姜黄素干预后,心肌炎大鼠心肌自噬活性较EAM组进一步增强,并且此时心肌炎大鼠心功能得到明显改善,提示姜黄素能够通过诱导自噬发挥其心肌保护作用。
综上所述,本研究成功构建大鼠EAM模型,心动超声检测发现心肌炎大鼠心脏收缩功能减弱,EF降低,心肌细胞自噬活性反应性增强;姜黄素干预后,心肌炎大鼠心肌细胞自噬活性进一步增强,大鼠心脏收缩功能改善,EF升高,提示姜黄素能够通过增强自噬活性改善EAM大鼠心功能,并且该作用是通过诱导LC3上游分子Beclin-1表达实现的。本研究为姜黄素的心肌保护作用增添了新的证据,但其通过何种机制增强自噬活性,需要后续的深入研究。

