长链非编码RNA-TDRG1高表达对宫颈癌临床进展及预后不良的影响
范 阳,李 洁,张忠明,刘明晖,单玉珍,张逢香,邹余粮
(1. 西安交通大学第一附属医院妇产科,陕西西安 710061;2. 西安航天总医院妇科,陕西西安 710010)
宫颈癌是全球范围内最常见的妇科癌症之一,约占女性癌症死亡患者人数的10%~15%[1]。宫颈癌早期治疗效果较好,中晚期则预后较差[2],但早期多无明显临床症状,巴氏筛查虽有助于早发现、早治疗,但仍有相对较高的假阴性率[3]。同时,宫颈癌现阶段尚缺乏高效特异的肿瘤标志物,为早期诊断及随访观察均带来不便[4]。因此,目前亟需开发新的用于宫颈癌早期诊断、治疗以及预后判断的临床生物标志物。
长链非编码RNA(long non-coding RNAs, lncRNAs)是一类长度超过200 bp的转录本[5],曾被认为是基因转录的“噪音”,是特定基因转录Pol Ⅱ的副产物。研究发现,lncRNAs可以编码基因的上游启动子区域,干扰下游基因的表达;结合蛋白编码基因转录形成互补的双链DNA复合体,干扰mRNA的切割或导致选择性剪接;与特定蛋白结合以调节其活性;或作为小RNA的前体分子,如microRNAs (miRNA)或piwi-interacting RNAs (piRNAs)[6],在细胞周期、细胞分化等生理功能中发挥重要作用[7]。
近年来,有学者证实lncRNAs在多种肿瘤疾病的发生发展中起重要作用,如宫颈癌等[8-9]。新发现的人类睾丸特异性基因睾丸发育相关基因1 (human testis development-related gene 1, TDRG1)编码了100个氨基酸蛋白,这些蛋白不具有任何已知的蛋白结构域[10]。TDRG1可能通过调节PI3K/Akt/mTOR信号通路参与睾丸生殖细胞肿瘤的发生[11]。研究表明,存在lncRNA-TDRG1通过成纤维细胞生长因子1(FGF1)相关机制促进骨髓间充质干细胞增殖[12]。而且,lncRNA-TDRG1可能参与上皮性卵巢癌的发生和进展[13],并通过结合和靶向VEGF-A蛋白增强子宫内膜癌的致瘤性[10]。然而,lncRNA-TDRG1在宫颈癌中的作用目前尚未被研究。
1 资料与方法
1.1 一般资料组织样本来源于西安交通大学第一附属医院妇科、西安航天总医院妇科宫颈病变患者,宫颈癌组织及邻近正常宫颈组织(距离宫颈癌组织>5 cm且经病理检查证实为正常组织)各取60例。所有组织样本均在手术过程中获取,立即放入液氮速冻,并转入-130 ℃冰箱储存直至RNA提取时取出。组织病理诊断由2名病理学家完成。患者术后总体生存期为手术后至宫颈癌相关疾病死亡时间。本实验已通过西安交通大学第一附属医院及西安航天总医院伦理委员会的批准,所有患者已签署知情同意书,组织样本均采取匿名形式收集和使用。患者纳入标准:①术前未经过放疗、化学药物治疗和靶向性治疗;②接受手术治疗;③病理确诊为宫颈癌患者;④患者按照美国癌症联合委员会(AJCC)TNM分期和国际妇产科联盟(FIGO)宫颈癌手术分期系统;⑤有完整的流行病学资料、相关临床信息及个人随访资料。
1.2 细胞株宫颈癌细胞株:SiHa(目录号:TCHu113),HeLa(目录号:TCHu187),C-33A(目录号:TCHu176),CaSki(目录号:TCHu137)购自上海中国科学院细胞库;正常宫颈细胞株Ect1/E6E7(编号:BNCC339959)购自北京北纳生物细胞库。
1.3 主要试剂RNA提取试剂盒:GenEluteTMTotal RNA Purification Kit (Sigma-Aldrich, Germany);反转录试剂盒:Prime Script RT Reagent Kit(TaKaRa, Ohtsu, Shiga, Japan);荧光定量试剂盒:SYBR Premix ExTaqTMⅡ Kit (TaKaRa, Ohtsu, Shiga, Japan);TDRG1及管家基因GAPDH引物由上海生工生物公司合成。lncRNA-TDRG1引物序列F:5′-TCTTCCCTGGCTTGGC-3′;R:5′-TGGGCTCTTTCGTGGC-3′;GAPDH引物序列F:5′-GCACCGTCAAGGCTGAGAAC-3′;R:5′-TGGTGAAGACGCCAGTGGA-3′。
1.4 RNA提取和实时定量PCR按照RNA提取试剂盒GenEluteTMTotal RNA Purification Kit使用说明提取各组织及体外培养细胞株中的总RNA,并进行质量控制。将总RNA(1 μg)按照Prime Script RT Reagent Kit说明书反转录成cDNA,反应条件为:37 ℃ 15 min,85 ℃ 5 s。将获得的反转录产物,按照SYBR Premix ExTaqTMⅡ Kit说明书,确定反应体系和反应条件,扩增过程由iQ5 instrument(Bio-Rad)完成,使用FastStart Essential DNA Green Master (Roche)去检测lncRNA-TDRG1表达,qRT-PCR反应条件:95 ℃变性10 s;60 ℃退火15 s;72 ℃延伸20 s,共40个循环。所有样品均设复孔,实验重复3次。采用2-ΔΔCt或ΔCt (CtlncRNA-TDRG1-CtGAPDH)的方法来计算和标准化lncRNA-TDRG1的相对表达量。

2 结 果
2.1 宫颈癌组织和癌细胞株中lncRNA-TDRG1的表达水平qRT-PCR检测60对宫颈癌和邻近正常组织中lncRNA-TDRG1的表达,结果显示:两组组织中lncRNA-TDRG1表达均呈正态分布(P=0.272,P=0.180),且方差齐(P=0.472),具有可比性。和邻近正常组织相比,lncRNA-TDRG1在宫颈癌组织中的表达显著增加(P<0.001,图1A、B)。qRT-PCR检测4种不同类型的宫颈癌细胞系,以及正常宫颈细胞系Ect1/E6E7中lncRNA-TDRG1的表达。结果显示,lncRNA-TDRG1在宫颈癌细胞株中的表达显著高于正常宫颈细胞系Ect1/E6E7(P<0.05,图1C)。

图1 宫颈癌组织中lncRNA-TDRG1的表达变化
Fig.1 The expression of lncRNA-TDRG1 in cervical cancer tissues
A:同一患者宫颈癌组织(cancer tissue)以及邻近正常组织(adjacent normal tissue)中lncRNA-TDRG1的相对表达量(n=60),ΔCt值低提示lncRNA-TDRG1高表达;B:qRT-PCR检测提示,和邻近正常组织比较,宫颈癌组织中lncRNA-TDRG1呈高表达(**P<0.001);C:不同类型的4种宫颈癌细胞系中lncRNA-TDRG1的表达量高于正常宫颈细胞系Ect1/E6E7(*P<0.05)。
2.2 宫颈癌患者lncRNA-TDRG1表达水平和临床病理参数的关系按照宫颈癌组织中lncRNA-TDRG1的表达水平,我们取中位表达量截断,分为低表达组(n=30)和高表达组(n=30)。lncRNA-TDRG1表达水平与宫颈癌临床病理参数的相关性如表1所示,结果说明宫颈癌组织中lncRNA-TDRG1的表达水平和癌细胞的分化程度(高中分化vs低分化,P=0.019),以及淋巴结转移(有vs.无,P=0.037)密切相关,但是和年龄(P=0.795),以及FIGO分期(P=0.589)无相关性。以上结果提示,高表达lncRNA-TDRG1可能与宫颈癌的发生发展有关。
2.3 lncRNA-TDRG1高表达是宫颈癌患者预后不良的因素Kaplan-Meier和Log-rank检验结果表明,lncRNA-TDRG1的表达与宫颈癌患者的总体生存率直接相关,即宫颈癌患者高表达lncRNA-TDRG1时,总体预后更差(P=0.041,C-index=0.89,图2)。多因素分析显示,lncRNA-TDRG1高表达是宫颈癌患者预后不良的危险因素(P=0.006,表2),提示lncRNA-TDRG1高表达患者的总体预后更差。
表1 宫颈癌患者lncRNA-TDRG1表达水平和临床病理参数的关系
Tab.1 Relationship between lncRNA-TDRG1 expression and clinicopathological characteristics in cervical cancer patients

CharacteristicsNumberlncRNA-TDRG1 expressionHigh(n=30)Low(n=30)PAge(year)0.795 ≤45341816 >45261214FIGO stage0.589 Ⅰ21912 Ⅱ392118Cell differentiation0.019 Moderate and well321121 Poor28199Lymph node metastasis0.037 Yes332112 No27918

图2 lncRNA-TDRG1表达和宫颈癌患者总体生存率之间的关系(log-rank test,P<0.05)
Fig.2 The relationship between lncRNA-TDRG1 expression and overall survival of cervical cancer patients
3 讨 论
宫颈癌是一种复杂的疾病,涉及多种因素,虽然其发病原因为宫颈高危型HPV病毒持续感染,但具体病理机制仍未完全明确[14]。尽管目前宫颈癌疫苗(HPV疫苗)正逐步得到推广[15],但对于宫颈癌患者而言,能够早期诊断和治疗仍是获得良好预后的关键。因此,开发新的用于宫颈癌早期诊断、治疗以及预后判断的临床生物标志物非常重要。
随着基因测序技术的发展,学界普遍认为低于2%的人类基因用来编码蛋白质,剩下98%的基因则编码noncoding RNAs(ncRNAs),包括lncRNAs和circRNAs[16]。近年来,研究表明lncRNAs在多种类型疾病,尤其肿瘤性疾病中起重要作用[8],宫颈癌中也有许多lncRNAs的异常表达[17]。如研究者发现,lncRNA-HOTAIR在宫颈癌组织中上调,并且和FIGO分期、淋巴转移、肿瘤大小以及肿瘤浸润深度有关,lncRNA-HOTAIR使肿瘤对放疗不敏感,促进肿瘤细胞迁移和侵袭[18-19]。lncRNA-799也在宫颈癌中高表达,并作为miR-454-3P的ceRNA上调TBL1XR1表达,促进肿瘤转移[20]。同时,lncRNA-MEG3被发现在宫颈癌组织中下调,功能研究发现其可引起癌细胞G2/M周期阻滞和细胞凋亡[21],并且这种作用可能和其作为分子海绵调控miR-21-5p有关[22]。宫颈癌中lncRNA-TUSC8也呈下调趋势,其可通过减少c-Myc表达抑制癌细胞增殖[23]。综上所述,lncRNAs在宫颈癌中呈现出表达和功能的多样性,参与了宫颈癌的进展和预后。
表2 单变量和多变量Cox回归分析60例宫颈癌患者的总生存期
Tab.2 Univariate and multivariate Cox regression analyses of overall survival in 60 cervical cancer patients
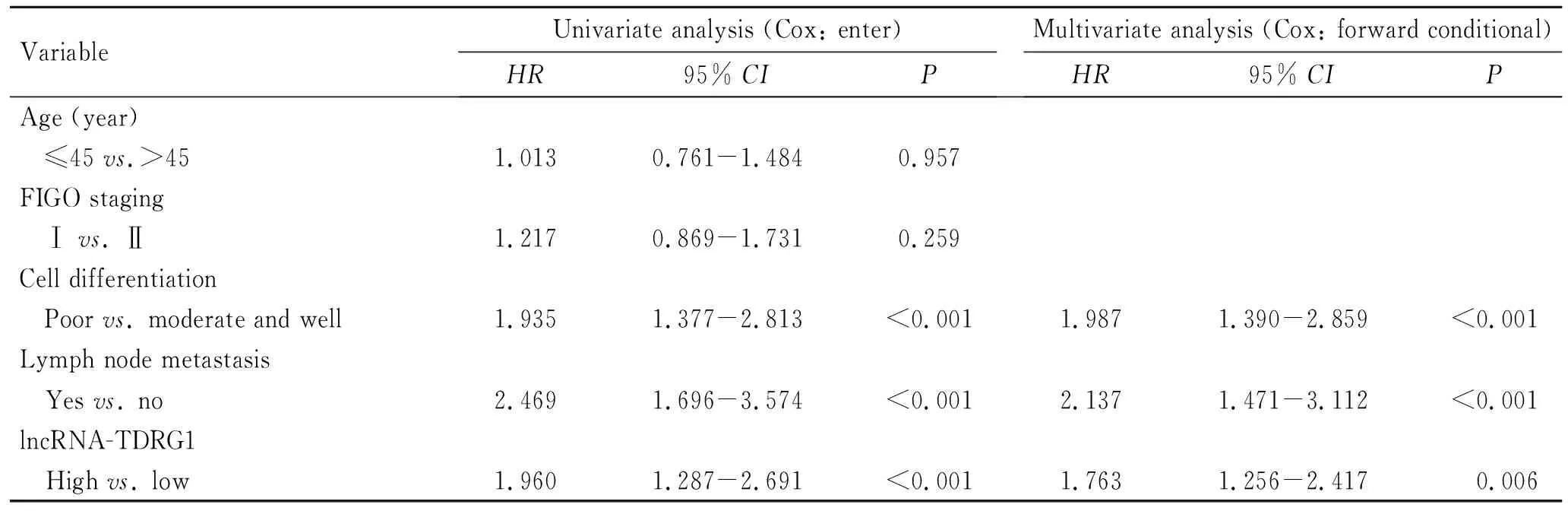
VariableUnivariate analysis (Cox: enter)HR95% CIPMultivariate analysis (Cox: forward conditional)HR95% CIPAge (year) ≤45 vs.>451.0130.761-1.4840.957FIGO staging Ⅰ vs. Ⅱ1.2170.869-1.7310.259Cell differentiation Poor vs. moderate and well1.9351.377-2.813<0.0011.9871.390-2.859<0.001Lymph node metastasis Yes vs. no2.4691.696-3.574<0.0012.1371.471-3.112<0.001lncRNA-TDRG1 High vs. low1.9601.287-2.691<0.0011.7631.256-2.417 0.006
HR:风险比; 95%CI:95%置信区间。
lncRNA-TDRG1是最近新发现的一种TDRG1基因相关的非编码RNA[10]。研究发现,存在lncRNA-TDRG1通过成纤维细胞生长因子1(FGF1)相关机制促进骨髓间充质干细胞增殖[12]。有学者还证实,早期胃癌患者癌组织和血浆中lncRNA-TDRG1的表达水平呈正相关,并且lncRNA-TDRG1和早期胃癌的淋巴结转移相关,可能是早期胃癌潜在的诊断生物标志物[24]。而且,lncRNA-TDRG1可能参与上皮性卵巢癌的发生和进展[13],并通过结合和靶向VEGF-A蛋白增强子宫内膜癌的致瘤性[10]。然而,目前lncRNA-TDRG1在宫颈癌中的表达和功能未知。
本研究首次证实宫颈癌组织中lncRNA-TDRG1的表达呈显著上调趋势,并且在不同的宫颈癌细胞株中得到证实。这一结果提示,lncRNA-TDRG1可能在宫颈癌中发挥原癌基因的功能。同时,进一步分析lncRNA-TDRG1表达和宫颈癌临床病理参数的关系时发现,lncRNA-TDRG1高表达和癌细胞分化程度,以及淋巴结转移情况呈显著正相关,我们推测下调lncRNA-TDRG1的表达可能抑制肿瘤的侵袭和迁移。生存分析显示,宫颈癌患者高表达lncRNA-TDRG1时,肿瘤恶性程度更高,患者生存时间更短,总体预后更差。根据多因素分析,lncRNA-TDRG1检测可作为一种新的生物标志物,补充传统的生物标志物,预测宫颈癌患者的预后并改善临床结局。
总之,本研究表明lncRNA-TDRG1在宫颈癌中普遍表达升高,且与宫颈癌患者的恶性状态有显著相关性。此外,lncRNA-TDRG1上调是宫颈癌患者预后不良的危险因素。然而,lncRNA-TDRG1在宫颈癌中的分子机制尚需进一步研究。

