近红外线、紫外线及二者共同作用对小鼠皮肤光老化的影响
刘钰泽,刘 平,苏 慧,杨荣丽
(1. 西安交通大学第二附属医院皮肤科,陕西西安 710004;2. 十堰市太和医院皮肤科,湖北十堰 442000;3. 西安一四一医院皮肤科,陕西西安 710089)
通过长期观察受紫外线(ultraviolet, UV)辐射的皮肤,KLIGMAN于1986年提出光老化的概念。紫外线曾被认为是光老化的主要原因,对紫外线的作用研究也一直是热点。随着研究的深入,学者们发现作为日光主体的红外线(IR),与紫外线有类似的作用,也可引起光老化。目前,红外线引起光老化的主要机制仍未明确,有学者认为红外线中的近红外线(IRA)及部分中红外线(IRB)能达到组织的深层,引起热休克反应导致皮肤损伤,可激活细胞信号通路,引起氧化应激反应,激活细胞信号通路引起胶原降解,形成光老化[1]。胶原降解主要是细胞基质中的基质金属蛋白酶家族(matrix metalloproteinases, MMPs)的作用结果,MMPs家族庞杂,目前已知的就有十几种,其中MMP-1有着明显的降解Ⅰ型和Ⅲ型胶原的作用[2]。有研究表明,在小鼠皮肤中MMP-1的作用被MMP-13替代[3]。因此,本实验利用紫外线、近红外线及二者联合照射小鼠皮肤,通过HE染色、实时定量PCR、Western blot检测小鼠皮肤中MMP-13的表达情况,观察上述实验条件对小鼠皮肤光老化的影响,从而为预防及治疗光老化提供新的思路。
1 材料与方法
1.1 材料紫外线灯箱、红外线仪(重庆华伦弘历实业有限公司),台式高速冷冻离心机(美国Beckmna公司),MiniTrnas-Blot转移电泳槽、PCR扩增仪、实时定量PCR仪(CFX96)、蛋白印迹设备、凝胶电泳仪、凝胶分析成像系统、EpS500/400电泳仪(均为美国Bio-Rad公司)。兔抗鼠MMP-13单克隆抗体(安博奥森生物技术有限公司)、兔抗鼠MMP-13单克隆一抗(Abcam公司)、One Step PrimeScript miRNA cDNA Synthesis Kit、PrimeScript RT Reagent Kit(日本TaKaRa公司)等。实验动物选用雄性封闭群ICR小鼠(清洁级)50只,体质量18~20 g,6~8周龄,购自西安交通大学医学部实验动物中心(合格证:0014420),清洁动物房,常规饲料和水喂养,温度(23±2)℃,湿度(54±4)%,12 h昼夜交替。
1.2 方法
1.2.1动物分组 小鼠随机分为5组:空白组、IRA组、UV组、IRA/UV组、UV/IRA组,每组10只。适应性饲养1周后,进行光照干预,干预前去除小鼠背部毛发。
1.2.2干预方法 第1、2、4、5、7天为照射日,第3、6天为休息日,照射日的晚8点进行照射。自制UV灯箱照射:灯箱预热15 min,并测量光强度。小鼠置于灯箱正中,光源距小鼠背部30 cm照射;5次/周,第1周为1 h,后每周递增20 min,第4周照射时间120 min保持至第14周。UV灯箱组成:40 W UVA灯管2支,光源波长315~400 nm,峰值365 nm;40 W UVB灯管4支,光源波长280~315 nm,峰值312 nm;累计照射剂量UVA 310.4 J/cm2,UVB 46.6 J/cm2。IRA照射:仪器预热10 min,并测量光强度,小鼠置于光源正中,红外线照射仪距离小鼠背部40 cm,5次/周,30 min/次,持续至第14周。红外线仪波长0.78~2.8 μm,功率100 W,IRA累计照射剂量:1.26×107J/cm2。 IRA/UV组即在IRA照射完立即进行UV照射,而UV/IRA组则正好相反。取材:15周的第1天,即最后1次照射24 h后取材。脱毛剂去除小鼠背部毛发,次日麻醉后取颈背部皮肤约3 cm×2 cm,部分固定3 d,行HE染色;另取2~3 g,-80 ℃冰箱保存,实时定量PCR和Western blot使用。
1.2.3HE染色 固定取材的皮肤组织,包埋、切片,常规HE染色,观察染色结果。
1.2.4免疫组化 组织固定、脱蜡、复水、过氧化氢酶灭活、细胞打孔,热修复;封闭,滴加一抗(兔抗鼠MMP-13),二抗;显色,复染,镜验;观察并计算结果。
1.2.5实时定量PCR 取冻存组织,剪碎,加液氮研磨成粉末状,按照One Step Prime Script miRNA cDNA Synthesis Kit试剂盒提取总RNA。提取的总RNA经紫外线分光光度计测定浓度后,按照PrimeScript RT Reagent Kit逆转录试剂盒,进行反转录实验;反应结束后,将获得的cDNA用于PCR或放在-20 ℃保存。RT-PCR设计、合成MMP-13引物序列,上游5′-CATCCATCCCGTGACCTTAT-3′,下游5′-GCATGACTCTCACAATGCGA-3′;内参GAPDH上游5′-CCCACTAACATCAAATGGGG-3′,下游5′-ACACATTGGGGGTAGGAACA-3′。qPCR反应条件95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s,共39个循环;重复3次反应,取平均Ct值,以GAPDH为内参,用Ct值计算相对表达含量。
1.2.6Western blot检测蛋白表达 将组织研磨至粉状;加入裂解液,裂解40 min后,混合物离心4 ℃ 12 000 g,14 min,取上清,加6×loading buffer,100 ℃水中变性,上样(样品30 μL marker 5 μL)。电泳,转膜,封闭过夜。兔抗鼠MMP-13一抗孵育,洗膜后加山羊抗兔辣根过氧化物酶标记抗体二抗孵育;ECL显影,获取图像。
1.3 统计学分析采用SPSS 13.0软件进行统计分析。数据采用均数±标准差表示,多组间计量资料比较采用方差分析,两两比较采用Bonfferroni校正。P<0.05认为差异有统计学意义。
2 结 果
2.1 小鼠皮肤变化空白组皮肤正常。IRA组较空白组皮肤红,变薄,局部有轻微皱纹形成。UV组、IRA/UV组、UV/IRA组均见明显的皱纹,皮肤松弛,粗糙,局部有红斑结痂(图1,表1)。
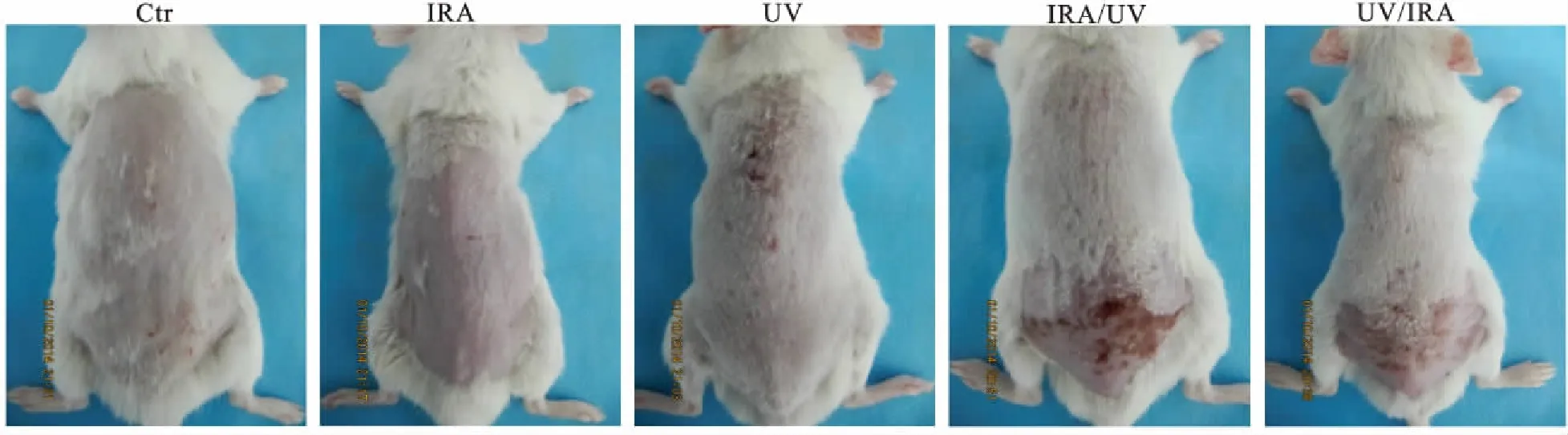
图1 肉眼观察小鼠皮肤情况
Fig.1 The skin changes in each group of mice observed with the naked eye
2.2 HE染色及免疫组化结果HE染色显示(图2),空白组皮肤结构完整,表皮规则,分界明显,真皮层染色一致,胶原纤维束排列规整有序。IRA组真皮变薄,胶原纤维减少,排列结构基本正常,真皮层血管增生明显。UV组表皮不规则增生,真皮乳头层萎缩,真皮层变薄,胶原纤维排列紊乱。 UV/IRA组和IRA/UV组表皮增厚和真皮变薄,真皮乳头层消失,真皮结缔组织胶原排列杂乱,部分纠结成团(表1)。MMP-13免疫组化染色显示(图3),空白组的真皮、表皮都有少量的黄色颗粒。IRA组较空白组有更多的黄色颗粒,主要集中在真皮层。UV组、IRA/UV组和UV/IRA组的黄色颗粒较IRA组更多,表皮层有表达。图3统计阳性细胞个数,计算MMP-13阳性细胞率,4组实验组较空白组均有统计学差异(P<0.05,表2)。
表1 小鼠皮肤老化表现(皱纹形成程度和组织病理观察)
Tab.1 The skin photoaging of mice (skin wrinkles and histopathology) (n)

观察指标空白组IRAUVIRA/UVUV/IRA肉眼观察皱纹形成程度(无/轻/中/重)10/0/0/02/8/0/00/1/2/70/0/2/80/0/2/8HE观察真皮厚度(正常/变薄/增厚)10/0/04/6/00/10/00/10/00/10/0HE观察胶原排列(正常/杂乱)10/010/00/100/100/10
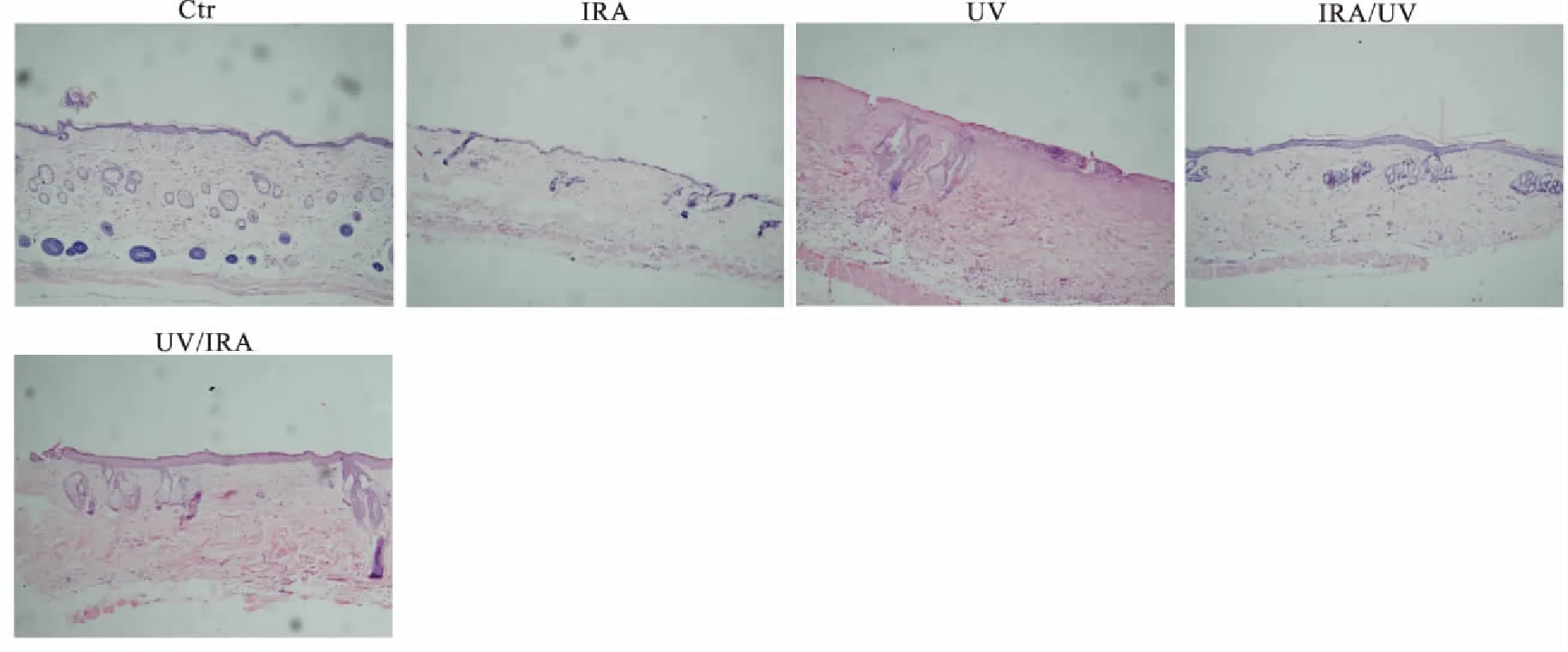

图2 小鼠皮肤的组织病理学改变Fig.2 The histopathologic changes of the mices skin (×10)
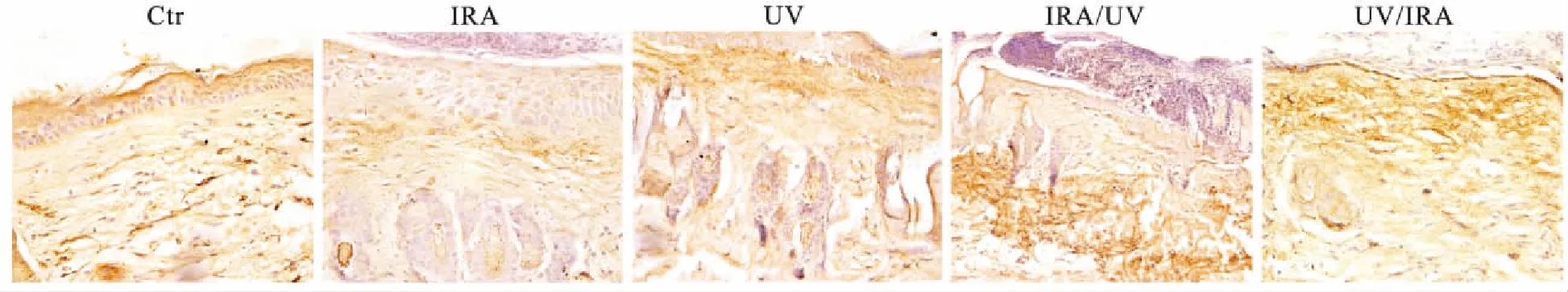
图3 MMP-13免疫组化结果
Fig.3 MMP-13 in the mice’s skin detected by immunohistochemical method (×40)
表2 MMP-13蛋白在各组中的表达比较
Tab.2 The expression of MMP-13 in each group
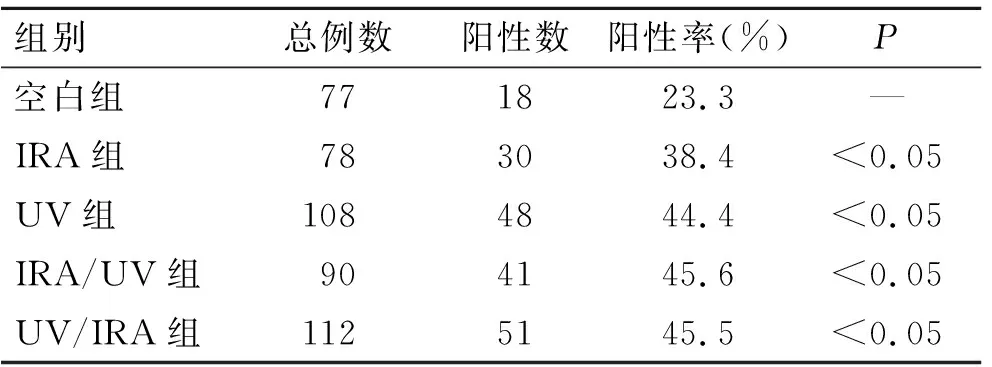
组别总例数阳性数阳性率(%)P空白组771823.3—IRA组783038.4<0.05UV组1084844.4<0.05IRA/UV组904145.6<0.05UV/IRA组1125145.5<0.05
2.3 MMP-13蛋白和mRNA表达情况Western blot和实时定量PCR检测结果显示,IRA组MMP-13蛋白与mRNA表达量较空白组增加(P<0.05);UV组较IRA组表达上调(P<0.05);IRA/UV组和UV/IRA组MMP-13蛋白与mRNA表达均较UV组增加(P<0.05),并且IRA/UV组较UV/IRA组增加更明显,且有统计学意义(P<0.05,图4、图5)。
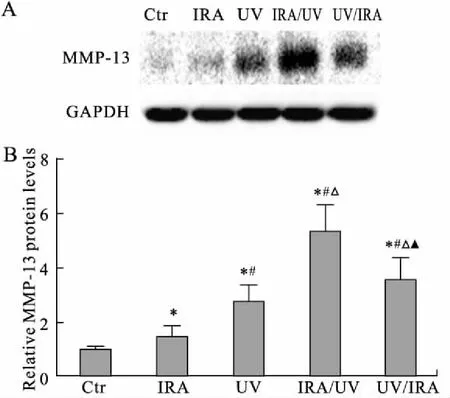
图4 小鼠皮肤MMP-13蛋白的表达情况
Fig.4 The protein expression level of MMP-13 in the mice’s skin
与空白组(Ctr)比较,*P<0.05;与IRA组比较,#P<0.05;与UV组比较,△P<0.05;与IRA/UV组比较,▲P<0.05。
3 讨 论
光老化皮肤的病理生理变化主要反映在:①细胞外基质蛋白的降解增加;②胶原合成分泌减少和功能紊乱[4]。IRA引起成纤维细胞产生热休克效应,激活MAPKs通路,MMP-1、MMP-3、MMP-9表达增多[5];SCHROEDER[6]发现,IRA促进成纤维细胞分泌MMP-1,与UV作用的通路不一样,是一个反向调节的过程;KIM等[7]在人体试验中也发现了IRA可引起Ⅰ型胶原的减少;诸多学者的研究均表明IRA可以作为独立因素引起皮肤老化[8],同时与UV一起有协同作用。

图5 小鼠皮肤MMP-13 mRNA的表达情况
Fig.5 The mRNA expression level of MMP-13 in mice skin
与空白组(Ctr)比较,*P<0.05;与IRA组比较,#P<0.05;与UV组比较,△P<0.05;与IRA/UV组比较,▲P<0.05。
本实验中,肉眼及HE染色结果均提示IRA组小鼠皮肤胶原降解、血管增生。长期反复暴露于IRA可造成血管增生和皮肤老化,IRA调节血管生成主要是其热效应上调VEGF和下调TSP-2引起[9]。UV组、UV/IRA组和IRA/UV组小鼠皮肤粗糙,弹性下降,形成明显皱纹,HE结果示此3组有明显的胶原纤维的减少,胶原纠结成团。BRAVERMAN等[10]发现光老化的皮肤胶原和弹力蛋白的减少,纤维排列杂乱,这与本研究结论一致。KIM等[7]在人体试验中,发现反复暴露于红外线下,可以引起前Ⅰ型胶原的表达减少,但是,LEE等[11]对无毛小鼠的试验中,并没有发现单独的IR引起胶原纤维和弹力纤维的改变。这二者的不同结果可能是因为选用的IR波长不同及实验对象不同。在FRANK等[12]的研究中发现,用UVB辐射经IRA预照射后的人成纤维细胞,可以抑制凋亡通路的激活,与IRA作用于线粒体相关。SCHROEDER等[13]发现IR辐射人成纤维细胞后,会减少Ⅰ型胶原的合成和分泌。
本研究结果显示,在IRA辐射后小鼠皮肤中MMP-13表达上调。SCHROEDER[14]发现,IRA可使人皮肤中MMP-1的表达上调,且MMP-1表达的主要位置在真皮而不是表皮;IR引起皮肤老化上调MMP-1的表达,干扰胶原的从头合成。KIM等[7]也发现单次红外线辐射人体皮肤会上调前胶原的表达,不会引起MMP-1的改变,但是长期重复暴露于红外线时,会引起前胶原表达减少和MMP-1表达上调。鉴于小鼠皮肤中MMP-13作用与人皮肤中MMP-1的作用类似,以上结论与本实验结果有相似性。
在本研究中,与UV组比较,IRA/UV组和UV/IRA组的MMP-13表达水平明显上调。KIM[11]已经证明,IRA具有放大UV引起的皱纹的作用。他们认为红外线促进MMP-13生成是IR的热效应,说明IRA上调MMP-13的表达,可能跟它的光效应和热效应都有关。本次实验联合组上调MMP-13的原因可能是,联合照射形成了叠加效果,所以MMP-13表达量较单一光源组上调。
两种光源产生光老化的机制不尽相同。UV引起ROS产生途径是:①直接激活细胞表面的受体,如EGF受体和细胞因子受体,促进细胞的代谢产生ROS[15];②直接作用于细胞内的生色基团,将电子传递给氧分子产生ROS[15]。IR引起ROS产生途径则是:红外线辐射的光子,被线粒体外膜的细胞色素氧化酶C吸收,改变线粒体膜上呼吸链组分活性,促进ROS生成。ROS激活ERK1/2和JNK通路,上调c-Jun和c-Fos的表达,促进AP-1的形成,AP-1进入细胞核相应位点,促使MMPs表达增加[13]。
在本研究中,IRA/UV比UV/IRA组能更加明显地升高MMP-13表达,说明UV的放大IRA光老化作用比IRA放大UV作用更加显著。我们推测可能原因是:①IRA/UV组辐射后细胞内产生的ROS含量高于UV/IRA组;②在预先接受UV照射后,IRA的相关传导通路受损,无法产生ROS,从而激活下游通路,客观上削弱了光老化作用。除了ROS影响,也有IR的热效应,紫外线和红外线激活细胞因子等等改变MMP-13表达。另外TGF-β通路本身可以促进胶原形成,而近红外线还有抑制TGF-β受体表达的作用,从不同途径促进光老化[9]。
综上所述,我们发现近IR不但引起光老化,而且和UV相互影响,上调MMP-13表达,并加速小鼠皮肤光老化过程。我们实验研究证明,在相同的照射条件下,两种光源照射顺序不同,引起小鼠皮肤表达MMP-13的量明显不同。因此,防止近红外线辐射,避免MMP-13形成,可能在预防小鼠皮肤光老化的皱纹形成中发挥重要作用。由于机体拥有一个完整而又复杂的调节机制,关于ROS的含量、作用时间和具体所涉及的下游通路激活等等,未来有待进一步研究。

