IL-17A通过p38MAPK通路抑制巨噬细胞ABCA1蛋白的降解
马望歌,周 栋,王丽君,刘 艳,陈小莉,郭 宁,周 娟, 2
(1. 西安交通大学第一附属医院心血管内科,陕西西安 710061;2. 陕西省分子心脏病学重点实验室,陕西西安 710061;3. 汉中市中心医院心血管内科,陕西汉中 723000)
动脉粥样硬化(atherosclerosis, AS)是心血管系统相关疾病发病机制研究的重点和热点。AS的发生与机体脂质代谢紊乱、炎症反应及局部自由基增加等因素有关,其中免疫炎症机制在AS发生发展中的作用越来越被研究者认可[1]。当机体动脉内膜受到损伤时,损伤部位的内皮细胞、粘附的血细胞可以释放粘附分子,进而诱导血液中的单核细胞进入动脉内膜,并转化为巨噬细胞[2]。巨噬细胞通过膜表面的清道夫受体可以大量摄取氧化型低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)。正常情况下,这些被摄取进巨噬细胞的ox-LDL经进一步转化而排出。但当巨噬细胞对胆固醇的摄取、酯化和排出的动态平衡被打破时,脂质将大量在胞内积聚,并进一步形成巨噬细胞源性的泡沫细胞,这是AS形成的初始步骤[3]。三磷酸腺苷结合盒转运体A1(adenosine triphosphate binding cassette transporter A1, ABCA1)可介导细胞内脂质的流出及稳态维持,其主要通过促进胆固醇及磷脂从细胞内转运至胞外贫脂的载脂蛋白A-I(apolipoprotein A-I, ApoA-I),并形成前-β高密度脂蛋白(high density lipoprotein, HDL),从而减少胞内脂质的蓄积,是机体抗AS的重要分子之一[4]。
白细胞介素17(interleukin-17, IL-17)是体内一种重要的细胞因子,在炎症、肿瘤、自身免疫性疾病等的发病进程中均发挥重要作用[5-6]。IL-17家族由IL-17A、IL-17B、IL-17C、IL-17D、IL-17E等6个成员构成,IL-17A是其中最为重要的成分。有研究显示,AS斑块局部的IL-17表达上升[7]。但有关IL-17在AS病程中的确切作用目前仍无定论[8]。本课题组前期研究结果提示,IL-17A可上调巨噬细胞ABCA1蛋白的表达,在一定程度说明其抗AS作用。本研究将进一步探讨IL-17A上调巨噬细胞ABCA1蛋白表达的相关分子机制。
1 材料与方法
1.1 主要试剂Raw264.7细胞购买于中国科学院上海细胞库,DMEM培养基购自美国Hyclone公司,胎牛血清购自美国Gibco公司,放线菌酮购自美国Sigma公司,ABCA1抗体购自美国Novus公司,p-p38MAPK、泛素(ubiquitin)及β-actin抗体均购自美国Cell Signaling Technology公司,Protein A/G PLUS-Agarose和SB203580购自美国Santa Cruz公司,其他试剂均为国产分析纯。
1.2 细胞培养及分组Raw264.7细胞常规培养于100 mL/L胎牛血清的DMEM培养基中,50 mL/L CO2、37 ℃孵箱培养。1~2 d换液,待细胞长满后,2.5 g/L胰酶消化,1∶5传代。取生长状态良好的细胞种植于6孔培养板中。
干预前用无血清培养基培养细胞14~16 h。用10、20、50 ng/mL IL-17A干预,确定最适浓度,进行后续实验。即与10 μg/mL蛋白酶抑制剂放线菌酮(cycloheximide, CHX)同时加入无血清培养基中,分别干预Raw264.7细胞0.5、1、2、4 h进行后续检测。此外,将IL-17A抑制剂SB203580单独干预或先于IL-17A 0.5 h置于培养基中联合干预,观察p38MAPK通路的作用。
1.3 Western blot检测ABCA1、p-38MAPK蛋白的表达情况吸出各组培养基,预冷PBS漂洗2次,加入蛋白裂解混合液(RIPA)裂解细胞,并提取蛋白进行蛋白定量。采用聚丙烯酰胺凝胶电泳分离等量蛋白,将其转移到PVDF膜上,50 mL/L脱脂牛奶封闭后滴加一抗(ABCA1,p-p38MAPK,ubiquitin,工作液均为1∶1 000稀释;内参β-actin为1∶10 000稀释)孵育、4 ℃过夜,经二抗孵育后进行化学发光法显色。β-actin作为内参对照。
1.4 免疫共沉淀检测ABCA1蛋白泛素化水平提取各组细胞总蛋白,加入20 μL Protein A/G PLUS-Agarose 4 ℃孵育30 min,离心去除琼脂糖珠,测定样品浓度后,取100 μg样品加入1 μg ABCA1抗体和20 μg Protein A/G PLUS-Agarose,4 ℃摇床过夜,离心后,60 μL 2×上样缓冲液重悬后煮沸变性,其余操作同Western blot(一抗:ubiquitin 1∶1 000)。

2 结 果
2.1 巨噬细胞ABCA1的表达情况不同浓度IL-17A干预Raw264.7细胞,Western blot检测结果显示,巨噬细胞ABCA1蛋白在10、20、50 ng/mL的IL-17A的干预时,表达水平呈增高趋势,与未干预组差异有统计学意义(P<0.05,图1)。

图1 Western blot检测不同浓度的IL-17A对RAW264.7细胞ABCA1蛋白表达的影响
Fig.1 The effects of IL-17A on the protein expression of ABCA1 in RAW264.7 macrophages
与IL-17A未干预组(0 ng/mL)比较,*P<0.01。
用不同浓度的IL-17A干预细胞,与对照组相比,10、20、50 ng/mL的IL-17A干预对Raw264.7细胞ABCA1 mRNA的表达均无影响(结果未显示)。上述结果表明,IL-17A可以促进巨噬细胞ABCA1蛋白的表达,但这种表达的增高并不发生在转录水平。
2.2 IL-17A可抑制巨噬细胞内ABCA1蛋白质的降解Western blot检测结果显示,IL-17A联合干预组RAW264.7细胞ABCA1蛋白的表达在0.5、1、2 h均高于同一时间点CHX单独干预组(P<0.05,图2),表明IL-17A可以通过抑制ABCA1的降解,从而增加其蛋白表达水平。

图2 IL-17A可以抑制RAW264.7细胞中ABCA1蛋白的降解
Fig.2 The protein expression of ABCA1 in RAW264.7 macrophages treated by IL-17A when protein synthesis was inhibited by CHX
与相同时间点CHX单独干预组比较,*P<0.05。
2.3 IL-17A可抑制巨噬细胞ABCA1与ubiquitin蛋白的结合免疫共沉淀技术检测显示,与对照组相比,在20 ng/mL的IL-17A干预组细胞在ABCA1表达增多的情况下,ABCA1蛋白与ubiquitin结合的程度减少(图3),提示其泛素化程度降低。说明IL-17A主要通过抑制ABCA1蛋白的泛素化降解过程,从而增高其表达。
2.4 IL-17A通过p38MAPK途径抑制ABCA1蛋白的泛素化降解进一步给予Raw264.7细胞p38MAPK抑制剂SB203580预处理30 min,结果表明,20 ng/mL的IL-17A可明显升高细胞p38MAPK的磷酸化水平(P<0.05),而2 μmol/L的SB203580预处理可使其磷酸化水平明显降低(P<0.05)。同时,SB203580预处理还可显著降低细胞因IL-17A干预而增加的ABCA1蛋白的表达水平(图4)。

图3 IL-17A可减少ABCA1蛋白与泛素的结合
Fig.3 The ubiquitination of ABCA1 protein in RAW264.7 macrophages treated by IL-17A
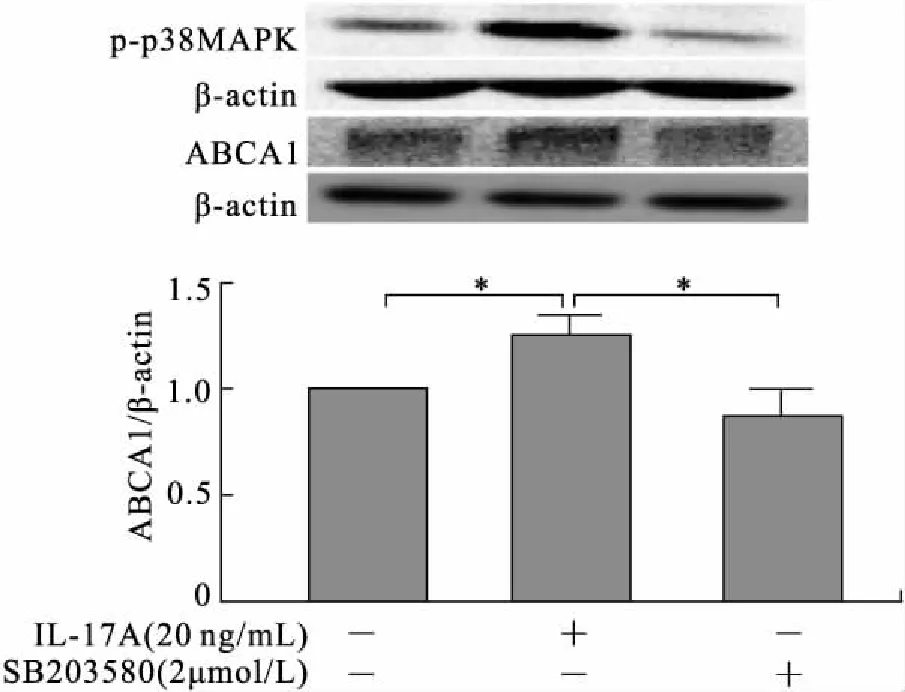
图4 p38MAPK抑制剂可逆转IL-17A对巨噬细胞ABCA1蛋白表达的增高作用
Fig.4 The role of p38MAPK in upregulating ABCA1 protein induced by IL-17A in RAW264.7 macrophages
与IL-17A未干预组比较,*P<0.05。
应用SB203580预处理细胞后,检测ABCA1蛋白泛素化水平。结果显示,IL-17A干预减少了ubiquitin与ABCA1蛋白的结合,联合使用p38MAPK抑制剂较IL-17A作用的ubiquitin与ABCA1蛋白的结合增加(图5)。以上结果提示,IL-17A主要是通过p38MAPK途径调控ABCA1蛋白的泛素化降解过程,从而增加其表达。
3 讨 论
随着生活水平的不断提高,由AS引发的心脑血管疾病逐渐成为威胁人们生命安全的主要疾病之一。在AS早期,其标志性的病理特征是血管内皮下大量巨噬细胞内脂质的蓄积以及泡沫细胞的形成。而促进巨噬细胞内胆固醇流出及体内胆固醇的逆向转运(reverse cholesterol transport, RCT)是机体抗AS机制的重要环节[9]。现有资料已证明,ABCA1是RCT的重要组成部分,主要介导胆固醇从胞内流出到贫脂的apoA-1并进一步形成初生高密度脂蛋白,从而促进巨噬细胞内胆固醇外流。因此,巨噬细胞上ABCA1蛋白的表达及活性对AS的发生、发展可以起到一定的抑制作用。

图5 p38MAPK抑制剂可逆转IL-17A对ABCA1蛋白泛素化降解的抑制作用
Fig.5 The role of p38MAPK in ubiquitination of ABCA1 protein induced by IL-17A in RAW264.7 macrophages
IL-17是一种主要由辅助性T细胞17(helper T cell 17, Th17)分泌的炎性细胞因子。目前,人们对IL-17在AS发生中的作用还存在较大争议[10]。有资料表明,IL-17可以减轻AS斑块的病变程度,具有一定的抗AS作用。ERBER[11]及CHENG[12]的研究证实,在apoE敲除小鼠中,IL-17A抗体可使动脉粥样硬化斑块变小。本课题组前期实验已经证实,IL-17A可以增加巨噬细胞ABCA1蛋白的表达水平,而且这种作用并非是通过转录水平的调节达成。真核细胞蛋白质表达水平的高低除了与合成过程有关,还受到其降解的影响。泛素-蛋白酶水解途径是一种特异性降解蛋白的重要途径,我们推测,IL-17A增加ABCA1蛋白的表达可能与其影响其泛素化降解过程有关。实验结果表明,在给予细胞CHX以抑制蛋白质合成的情况下,IL-17A干预仍可增加细胞ABCA1蛋白的表达,表明IL-17A可抑制ABCA1蛋白的降解。免疫共沉淀实验也进一步证实IL-17A可以减轻ABCA1蛋白的泛素化程度。
p38MAPK通路可被环境中的多种理化刺激及氧化应激、紫外线、缺氧缺血和IL-1等炎性细胞因子的刺激而活化。本研究结果表明,作为IL-17A的胞内关键性信号分子,IL-17A干预在活化p38MAPK的同时,也提高了ABCA1蛋白的表达。与IL-17A单独处理组相比,p38MAPK抑制剂SB203580降低了ABCA1蛋白的表达,说明IL-17A可以通过p38MAPK通路实现对细胞胆固醇代谢关键分子ABCA1的调控。p38MAPK抑制剂SB203580还可逆转细胞因IL-17A干预而降低的ABCA1泛素化水平,也进一步证明IL-17A可通过p38MAPK途径降低ABCA1的泛素化程度,使其降解减少,最终上调其表达。
总之,本实验结果表明,IL-17A可以通过p38MAPK通路抑制ABCA1蛋白的泛素化降解过程,从而使巨噬细胞ABCA1蛋白的表达增高。这一作用及其机制的发现可在一定程度上解释IL-17A的抗AS效用。

