稳定表达TFEB-GFP 细胞系的构建及促TFEB 入核药物筛选
李 薇 ,刘振兴,杨 萌,赵 爽,刁爱坡
(1.天津科技大学生物工程学院,天津 300457;2.内蒙古医科大学基础医学院,呼和浩特 010110)
转录因子EB(Transcription Factor EB,TFEB)是第一个鉴定出的MiTF/TFE 家族的基本螺旋-环-螺旋亮氨酸拉链(basic-helix-loop-helix leucine zipper,bHLH-Zip)类转录因子[1].TFEB 的细胞定位和活性调节与其磷酸化修饰状态相关.TFEB 蛋白至少可以在20 个位点被磷酸化[2-3],其中的Ser142 和Ser211这两个丝氨酸残基对其亚细胞的定位具有关键作用[4-7].当这两个丝氨酸残基都被磷酸化时,TFEB 定位在细胞质中且无转录活性.TFEB 的活性严格地受到翻译后修饰、蛋白质间相互作用和空间组织的调控.在营养丰富的条件下,TFEB 主要以无活性状态存在于细胞质,但在饥饿或溶酶体功能发生障碍的条件下,TFEB 迅速转位至细胞核并激活其靶基因的转录[4,8].研究[9]表明,很多构成溶酶体的蛋白表达由TFEB 调控.溶酶体功能正常是维持细胞稳态的必要条件[10],参与内吞作用、自噬和溶酶体胞吐作用等许多基本的细胞过程[11].表达溶酶体蛋白增强溶酶体活性,如增强细胞自噬功能,可以防止溶酶体相关疾病的发生.TFEB 的失调会导致多种类型的癌症,肿瘤细胞依赖于有效的溶酶体功能,并且在致癌过程期间发生溶酶体组成和数量的多种改变.肾细胞癌(RCC)是由肾小管上皮产生的异质性肿瘤,其中的易位RCC(t-RCC)就是由MiTF/TFE 家族成员TFE3 和低频率的TFEB 有关的基因融合引起的[12-13].在人类胰腺癌细胞(PANC1)中发现了TFEB 的非典型核定位[14].最近在非整倍体细胞的研究中发现,TFEB激活是对未降解的自噬物的溶酶体积累后的溶酶体应激的细胞应答[15].
TFEB 在对细胞应激反应中起作用,在细胞适应各种内部压力和环境波动中的作用与其全面调节自噬/溶酶体系统的独特能力密切相关.TFEB 控制参与调节自噬、线粒体功能、代谢、未折叠蛋白反应(UPR)、凋亡和炎症反应关键基因的表达,具有广泛的功能[16].此外,TFEB 的功能可能具有细胞类型的特异性,它的激活对于肝细胞中的脂质分解代谢、巨噬细胞中的免疫应答以及肌肉中有效的线粒体功能发挥重要作用.
但到目前为止,发现的具有诱导TFEB 发挥功能的化学药物数量较少,而对于可以利用TFEB 作为靶点的治疗肿瘤疾病和神经退行性疾病等顽疾的药物鲜有报道.本研究的目的在于构建稳定表达TFEBGFP 的人子宫颈癌细胞HeLa,采用该细胞模型筛选新的促进TFEB 入核并发挥其转录功能的小分子化合物,并研究其对TFEB 的诱导作用及对细胞生长的影响.本研究将为以TFEB 为靶点调控溶酶体功能的药物发现与应用提供理论和实物基础.
1 材料与方法
1.1 材料
1.1.1 菌种、细胞及质粒
大肠杆菌(E.coli)STBL3、人胚肾细胞HEK293T、人子宫颈癌细胞HeLa、人乳腺癌细胞MDA-MB231、稳定表达EGFP-LC3 的HeLa 细胞,慢病毒表达载体系统包括 pLVX-AcGFP1-N1、pMD2.G 和psPAX2 质粒均为本实验室保存.
1.1.2 主要试剂
Pfu DNA 聚合酶、T4 DNA 连接酶、Taq DNA 聚合酶、限制性内切酶 EcoR Ⅰ和 BamH Ⅰ、DNA marker、蛋白预染marker、TurboFect™,Thermo 公司;PCR 产物纯化试剂盒、DNA 胶回收试剂盒、质粒DNA 小量抽提试剂盒,上海生工生物工程有限公司;胎牛血清(FBS),浙江天杭生物科技有限公司;胰酶、DMEM 高糖培养基、嘌呤霉素、DAPI、LC3 抗体,美国Sigma 公司;Opti-MEM 培养基,美国Gibco 公司;噻唑蓝(MTT),北京索莱宝生物科技有限公司;βactin 抗体、TFEB 抗体,Santa 公司;p62 抗体,CST公司;Cathepsin B 抗体,Abcam 公司;Histone 抗体、GFP 抗体、HRP 标记的鼠二抗、兔二抗,天津三箭生物技术有限公司.引物合成和基因测序由北京华大基因公司完成.
1.2 方法
1.2.1 pLVX-AcGFP1-N1-TFEB 表达载体的构建
应用Primer 5.0 软件,根据NCBI 数据库中的人TFEB 基因序列设计引物.通过比对序列,选择两端加上EcoRⅠ和BamHⅠ酶切位点(下划线部分)及保护碱基.引物序列上游为 5'-CGGAATTCTGATG GCGTCACGCATAGGGTTGC-3',下游为 5'-CGGG ATCCCGCAGCACATCGCCCTCCTCCATG-3'.以本实验室保存的pcDNA3.1+-flag-TFEB-HA 重组质粒为模板,PCR 反应体系:上、下游引物(10µmol/L)各2µL、模板cDNA 1µL、10×Pfu Buffer(with MgSO4)10µL、dNTP Mix(10 mmol/ L)2µL、Pfu DNA 聚合酶(2.5 U/µL)1µL、ddH2O 82µL.反 应 条 件:95 ℃2 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 3 min,共30 个循环;72 ℃ 5 min.扩增得到TFEB 基因片段.将纯化后的目的基因片段与 pLVX-AcGFP1-N1 载体采用EcoRⅠ和BamHⅠ双酶切后纯化回收,T4 DNA 连接酶于16 ℃连接过夜.连接产物转化STBL3 感受态细胞.随机挑取大肠杆菌转化子,接种到5 mL 含有200µg/mL 氨苄霉素的LB 液体培养基中,37 ℃、180 r/min 摇床振荡培养12~16 h.提质粒后采用Taq DNA 聚合酶系统进行PCR 验证.同时采用EcoRⅠ和BamHⅠ进行双酶切验证.分别取5µL PCR 产物和酶切产物进行琼脂糖凝胶(0.8%)电泳检测.选取经酶切和PCR 验证都正确的重组质粒进行测序鉴定.
1.2.2 细胞培养
HEK293T、HeLa、MDA-MB231 细胞均用含有10% FBS 的DMEM 培养基,置于37 ℃、5% CO2培养箱中培养,定期换液传代.
1.2.3 慢病毒包装
在60 mm 培养皿中接种适量HEK293T 细胞,细胞生长24 h 融合度达70%~80%时进行转染.用TurbofectTM将pLVX-AcGFP1-N1-TFEB 重组质粒及pLVX-AcGFP1-N1 质粒分别与psPAX2、pMD2.G 两个包装质粒按照4∶3∶1 的比例(共加入6µg)转染HEK293T 细胞.转染12 h 更换新鲜培养基,再分别于24 h 和48 h 吸取上清液,将两次收集液合并,分别为实验组病毒收集液及对照组病毒收集液,1 500 r/min 离心15 min,小管分装,每管500 μL,-80 ℃避光保存.
1.2.4 HeLa 细胞最佳嘌呤霉素筛选浓度的确定
在96 孔板中接种适量HeLa 细胞,常规培养24 h 细胞长至70%~80%融合度时,更换含有不同浓度嘌呤霉素的培养基,设置嘌呤霉素终质量浓度为0.2、0.4、0.8、1.6、3.2、6.4µg/mL,每天镜下观察,并隔天更换含有不同浓度嘌呤霉素的新鲜培养基.3~5 d 后,导致细胞全部死亡的嘌呤霉素最低浓度即为最低致死浓度(一般以4 d 完全致死为准).
1.2.5 构建稳定表达TFEB-GFP 的HeLa 细胞系
在35 mm 培养皿中接种适量HeLa 细胞,常规培养24 h 细胞长至70%~80%融合度时,更换含有8 μg/mL 聚凝胺(polybrene)的新鲜培养基;再分别加入500 μL 实验组病毒收集液和对照组病毒收集液,温和地混匀,37 ℃、5% CO2条件下避光侵染24 h;更换含有最佳嘌呤霉素筛选浓度(终质量浓度1µg/mL)的新鲜培养基,筛选培养5 d 后,计数并重新铺细胞至60 mm 培养皿,一般每个培养皿700~800 个细胞,一直用含有1µg/mL 嘌呤霉素的培养基进行培养.待单克隆长至肉眼可见时,将单克隆挑起并转移至新的培养皿扩大培养获得稳定细胞系.荧光显微镜下拍照观察,同时收集细胞,蛋白免疫印迹技术检测成功表达TFEB-GFP 的细胞系.
1.2.6 免疫印迹实验(Western blot)
收集对数生长期的细胞,加入适量RIPA 细胞裂解液(50 mmol/L Tris-Cl(pH 7.4),150 mmol/L NaCl,2 mmol/L EDTA(pH 8.0),1% TritonX-100,0.1%SDS)(含蛋白酶抑制剂)在冰上裂解30 min,4 ℃离心收集上清液并按比例加入SDS 上样缓冲液,经10%SDS-PAGE 分离后转至PVDF 膜上,用含有5%脱脂奶粉的PBST 缓冲液(膜封闭液)室温封闭1 h,于4 ℃条件下进行一抗(稀释比例分别为TFEB 1∶200、β-actin 1∶5 000、Histone 1∶1 000、p62 1∶1 000、Cathepsin B 1∶2 000、LC3 1∶5 000、GFP 1∶1 000)孵育过夜,PBST 洗膜后再与二抗孵育2 h,PVDF 膜在MiniChemiTM迷你型化学发光成像仪下曝光成像.
1.2.7 药物筛选
待60 mm 培养皿中TFEB-GFP 稳定细胞系长至所需密度时即可进行96 孔板铺板.收集细胞,血球计数板计数,调整细胞悬液的浓度,铺板使待测细胞密度8 000 个/孔,常规培养24 h 后加入终浓度为5µmol/L 的药物处理,24 h 时用荧光显微镜拍照观察.
1.2.8 MTT 法检测细胞活力
收集对数期HeLa、MDA-MB231 细胞接种于96孔板中,血球计数板计数,调整细胞悬液的浓度,铺板使待测细胞密度5 000 个/孔,设复孔3 个.常规培养24 h 后加入不同浓度的药物处理(1、2.5、5、10、15、20µmol/L),DMSO 为对照组.分别检测24、48、72 h 的细胞活力.每孔加入20µL 5 mg/mL MTT 溶液,继续培养4 h 后,小心吸去孔内培养基,每孔加入200µL DMSO 溶解沉淀,置水平摇床上振荡10 min,使结晶充分溶解.利用酶标仪检测490 nm 波长下各孔的吸光度.
1.3 统计学处理
应用SPSS 18.0 软件进行统计分析,采用t 检验进行组间比较,*、**和***分别表示P<0.05、P<0.01 和P<0.001.
2 结果与分析
2.1 pLVX-AcGFP1-N1-TFEB表达载体的构建
pLVX-AcGFP1-N1-TFEB 表达载体的构建如图1所示.对以pcDNA3.1+-flag-TFEB-HA 质粒为模板的PCR 产物进行0.8%琼脂糖凝胶电泳鉴定,可见大小约为1.5 kbp 的特异性PCR 扩增条带,与预期一致(图 1(a)).将纯化后的目的片段与载体 pLVXAcGFP1-N1 进行双酶切纯化后连接,转化 E.coli STBL3 宿主菌,挑取阳性转化子培养,提质粒后进行PCR 及双酶切验证,PCR 产物和酶切产物进行琼脂糖凝胶电泳检测.实验结果显示:PCR 扩增出目的条带大小与TFEB 基因(1.5 kbp)相符(图1(b));双酶切重组质粒2 出现的两条带的大小分别与TFEB 基因(1.5 kbp)和pLVX-AcGFP1-N1 载体(8.8 kbp)大小相符(图1(c)).选取电泳条带位置正确的重组质粒2进行测序,验证载体上插入的TFEB cDNA 序列方向、位置及大小均正确,表明 pLVX-AcGFP1-N1-TFEB 重组表达质粒构建成功.
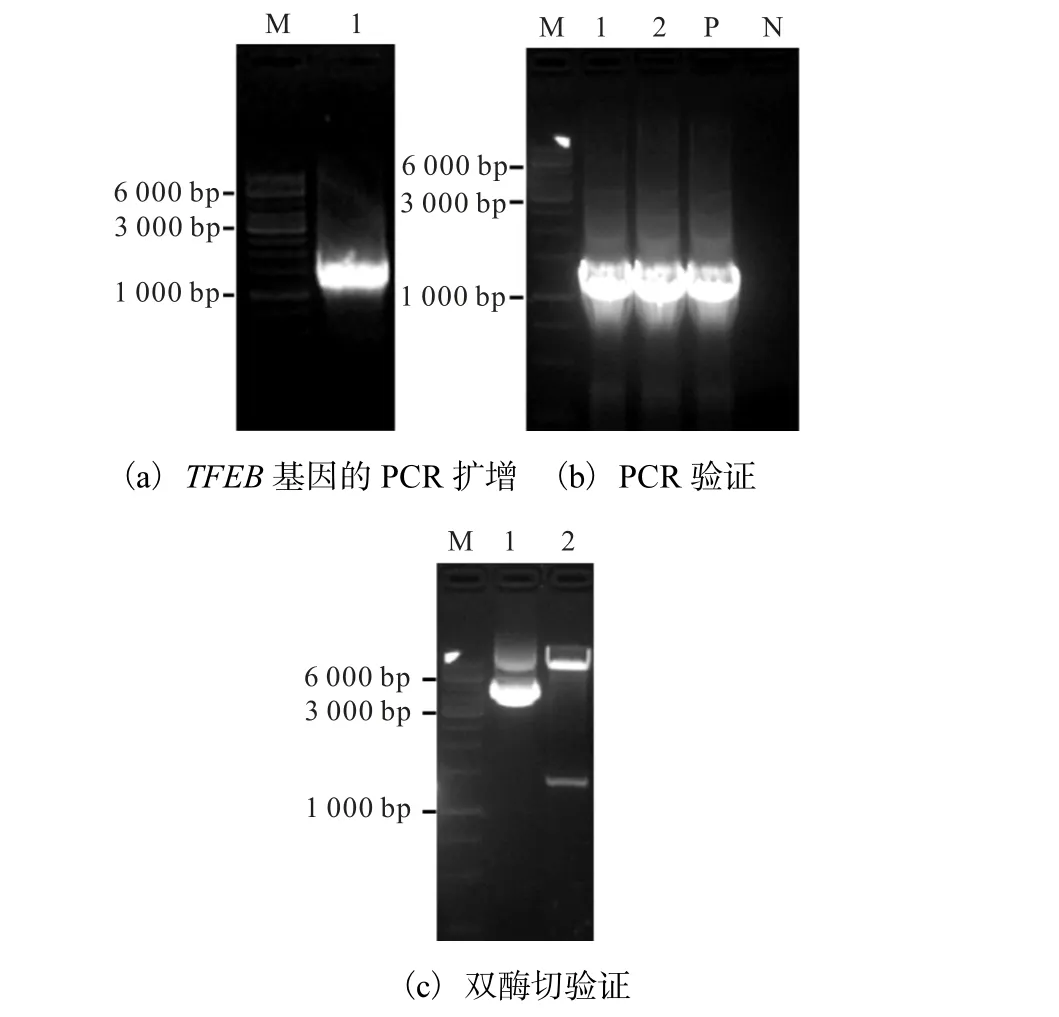
(a)中M.DNA marker;1.PCR 产物.(b)中M.DNA marker;1—2.重组质粒PCR 产物;P.阳性对照;N.阴性对照.(c)中M.DNA marker;1—2.重组质粒双酶切产物
2.2 稳定表达TFEB-GFP HeLa 细胞系的构建
用嘌呤霉素筛选出稳定表达TFEB-GFP 的HeLa细胞株(TFEB-GFP).对照组病毒收集液侵染的HeLa细胞作为对照,通过荧光显微镜拍照观察,结果如图2(a)所示,稳定表达TFEB-GFP 的HeLa 细胞的细胞质中有绿色荧光.
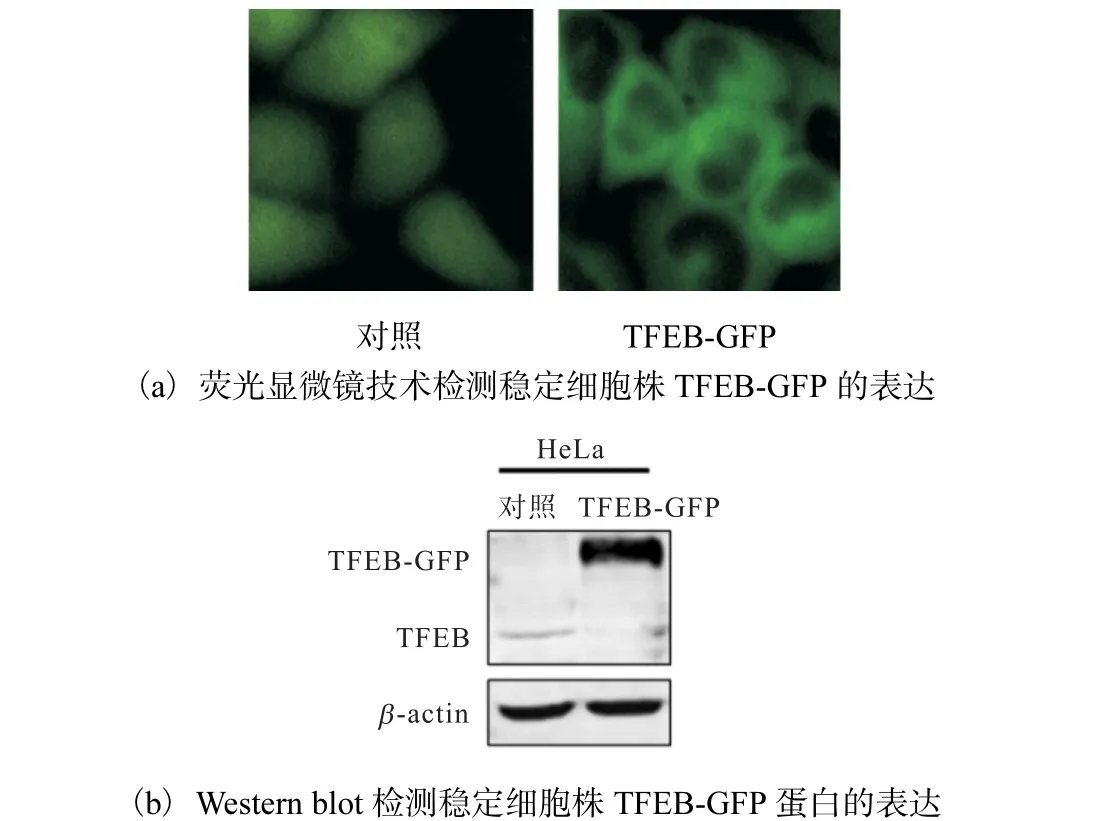
图2 稳定表达TFEB-GFP HeLa细胞系的鉴定Fig.2 Identification of the expression of TFEB-GFP in the HeLa stable cell lines
收集细胞制成蛋白样品,通过Western blot 证实实验组TFEB-GFP 蛋白表达明显增高(图2(b)).结果表明稳定表达TFEB-GFP 的HeLa 细胞系构建成功.
2.3 Sertraline HCl促进TFEB入核
利用稳定表达TFEB-GFP 的HeLa 细胞模型,对来自 Selleck 的小分子化合物库中的药物进行筛选.DMSO 为阴性对照,Torin 1(终浓度250 nmol/L)为阳性对照,荧光显微镜下拍照观察TFEB-GFP 的定位,确定Sertraline HCl 能够促进TFEB-GFP 入核,并且以时间(6、12、24 h)依赖性方式诱导TFEB-GFP核聚集(图3(a)).进一步通过核质分离方法研究Sertraline HCl 对内源性TFEB 细胞定位的影响.6 孔板中接种适宜密度的HeLa、MDA-MB231 细胞,24 h后分别换成加了Sertraline HCl(终浓度5µmol/L)的培养基处理24 h,DMSO 为阴性对照,核质分离以后,以核内TFEB 蛋白量比核内参(Histone)蛋白量统计Sertraline HCl 处理后TFEB 相对核内蛋白量,Western blot 检测结果如图3(b,c)所示,Sertraline HCl 处理后,HeLa、MDA-MB231 细胞核中TFEB 蛋白表达量明显比对照组增多,差异有统计学意义,进一步确定Sertraline HCl 促进TFEB 入核.
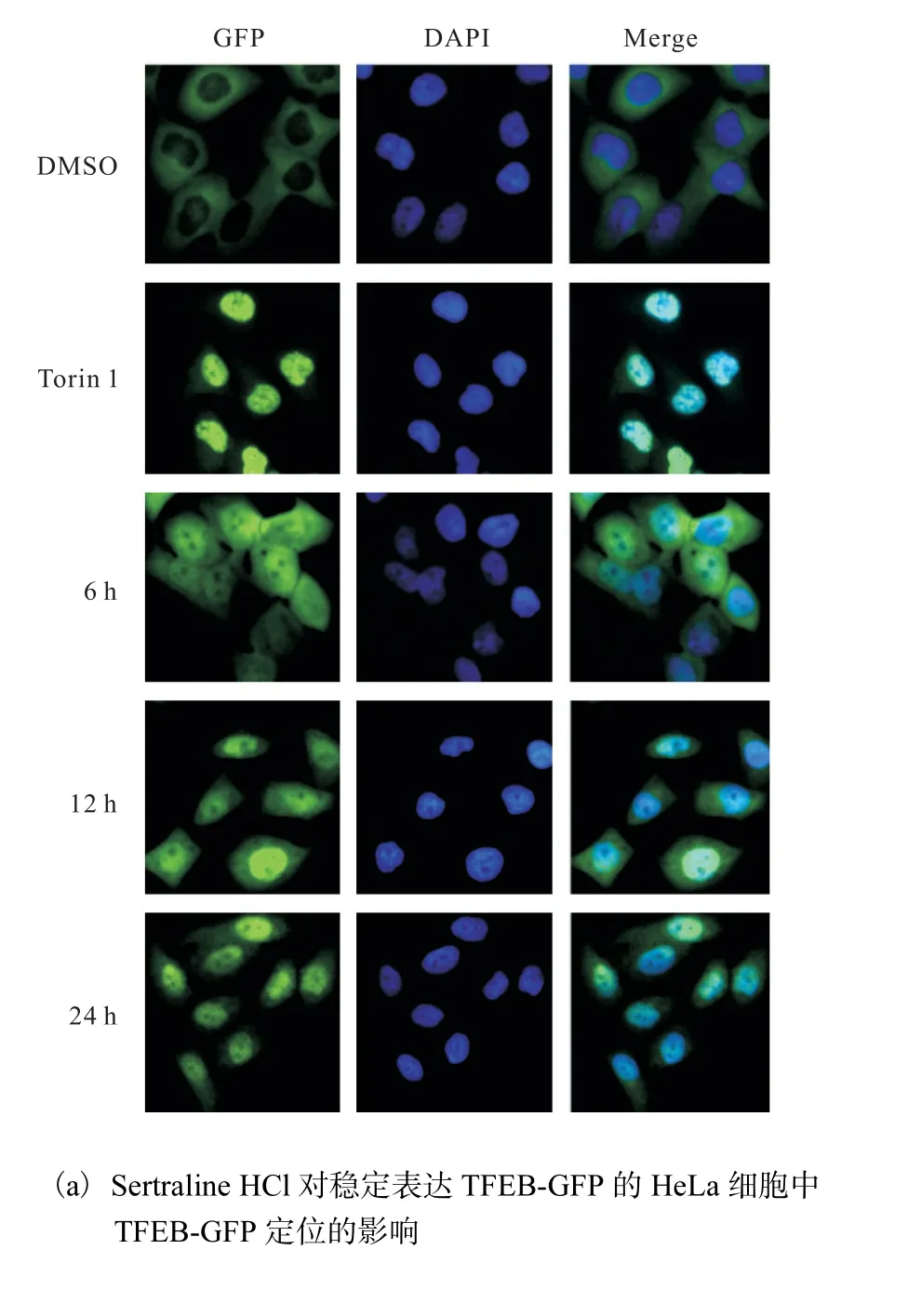
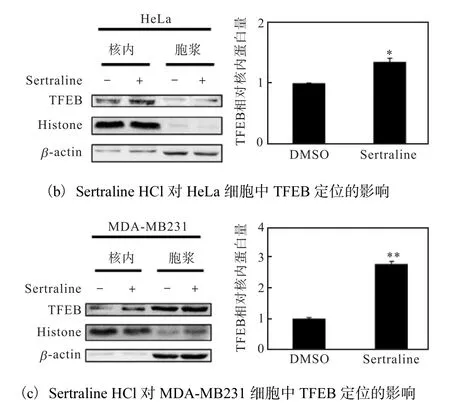
图3 Sertraline HCl促进TFEB入核Fig.3 Sertraline HCl promoting TFEB nuclear translocation
2.4 Sertraline HCl促进TFEB靶基因表达
为了研究Sertraline HCl 对HeLa、MDA-MB231细胞中TFEB 靶基因表达的影响,以DMSO 作为对照,用10µmol/L Sertraline HCl 处理HeLa、MDAMB231 细胞48 h 后,收集并裂解细胞,蛋白免疫印迹技术检测结果如图4 所示.Sertraline HCl 处理后,HeLa、MDA-MB231 细胞中 p62、组织蛋白酶B(Cathepsin B)表达均比对照组增加,差异有统计学意义.这表明Sertraline HCl 促进TFEB 靶基因p62、Cathepsin B 的表达.
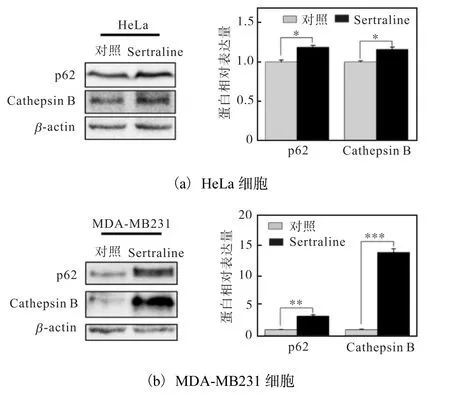
图4 Sertraline HCl促进TFEB靶基因的表达Fig.4 Sertraline HCl promoting the expression of TFEB target genes
2.5 Sertraline HCl促进细胞自噬
以上实验结果表明,Sertraline HCl 促进TFEB 入核并增强TFEB 的转录活性,而TFEB 调控很多溶酶体蛋白的表达.因此,进一步研究Sertraline HCl 对细胞自噬的作用.LC3 在自噬形成过程中发生聚集的原理为:无自噬时,EGFP-LC3 融合蛋白弥散在胞浆中;自噬形成时,EGFP-LC3 融合蛋白转位至自噬体膜,在荧光显微镜下可以观察到形成多个明亮的EGFP-LC3 绿色荧光斑点,通过计数评价自噬活性的高低.
将稳定表达EGFP-LC3 的HeLa 细胞培养于96孔板中,常规培养24 h 后加入Sertraline HCl(终浓度5µmol/L),DMSO 为 阴 性 对 照,雷 帕 霉 素(Rapamycin)(终浓度500 nmol/L)为阳性对照.继续培养6 h,用4% PFA 室温固定15~20 min,弃去PFA,PBS 洗3 次,荧光显微镜下拍照观察EGFPLC3 点状分布.图5(a)结果显示,Sertraline HCl 处理后,EGFP-LC3 绿色亮点聚集,而且数量比阴性对照增多,说明Sertraline HCl 能够增加LC3-Ⅱ蛋白的聚集程度,由此表明Sertraline HCl 促进HeLa 细胞自噬体的形成.
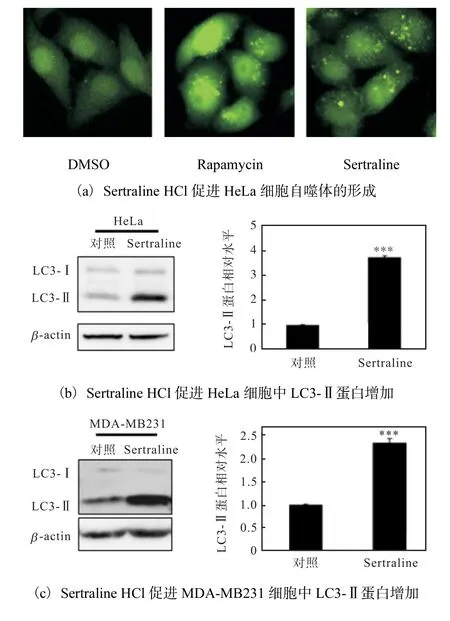
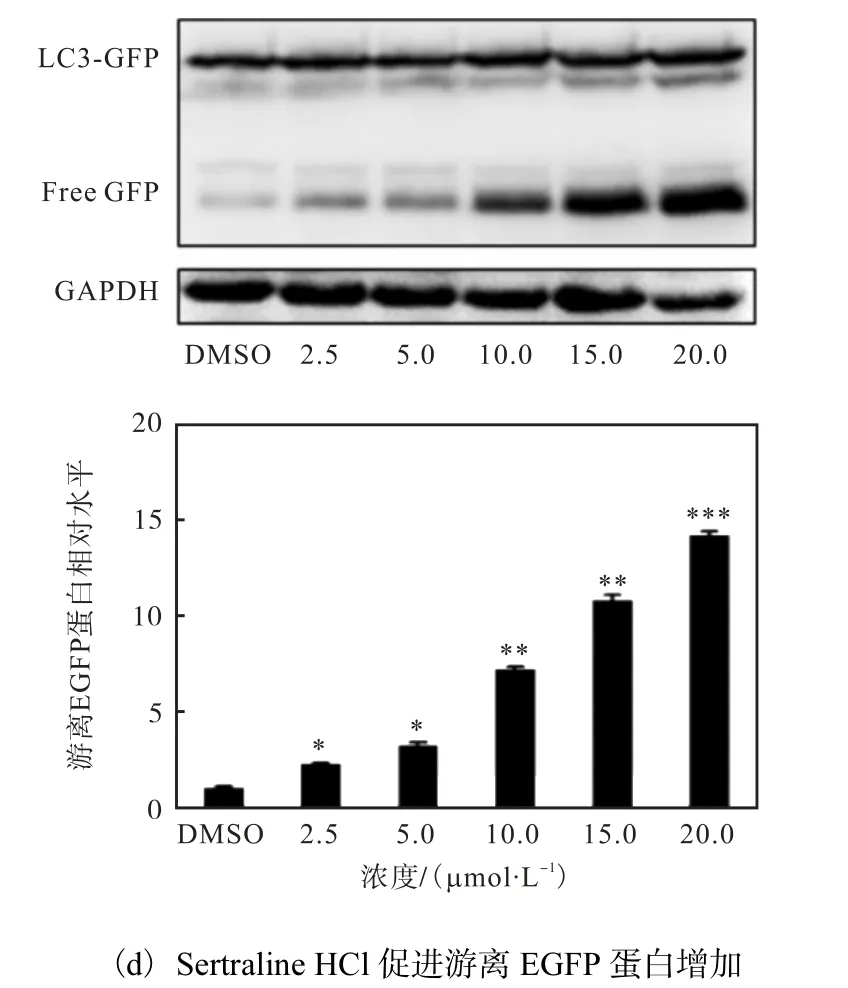
图5 Sertraline HCl促进细胞自噬Fig.5 Sertraline HCl promoting autophagy
在自噬过程中,LC3 在相关蛋白酶的作用下转变为具有活性的LC3-Ⅱ并结合到自噬体膜上,因此,LC3-Ⅱ蛋白水平直接反映自噬体数量.LC3-Ⅱ的含量或LC3-Ⅱ/LC3-Ⅰ或LC3-Ⅱ/β-actin 的比例与自噬体的数量呈正相关,在某种程度上反映了细胞的自噬活性[17-18].因此,进一步研究了Sertraline HCl 对LC3-Ⅱ蛋白表达的影响.将HeLa、MDA-MB231 细胞培养于6 孔板中,加入10µmol/L Sertraline HCl 常规培养48 h,DMSO 作为对照,通过蛋白免疫印迹技术检测自噬标志物LC3 的表达情况.结果如图5(b,c)所示,Sertraline HCl 处理的HeLa、MDA-MB231细胞中 LC3-Ⅱ蛋白水平明显高于对照组,表明Sertraline HCl 能够上调HeLa、MDA-MB231 细胞内自噬体数量.
自噬体形成后会运送到溶酶体,与其融合形成自噬溶酶体,在自噬发生时,EGFP-LC3 连同自噬体内膜和内容物一起被降解;但与LC3 易被降解不同的是,EGFP 在溶酶体中仅表现荧光信号淬灭,本身并不被降解,在自噬溶酶体降解后会释放出游离的EGFP[19-20].因此,游离EGFP 也可以作为检测自噬流降解是否发生的依据.通过蛋白免疫印迹技术检测不同终浓度的Sertraline HCl 处理稳定表达EGFPLC3 的HeLa 细胞12 h 后细胞中EGFP 蛋白的变化,结果如图 5(d)所示,随着药物浓度的增加,游离EGFP 蛋白的数量增加,表明Sertraline HCl 能够促进自噬流.
2.6 Sertraline HCl抑制肿瘤细胞生长
为了研究Sertraline HCl 是否具有抗肿瘤活性,通过MTT 法检测Sertraline HCl 对肿瘤细胞活力的影响,结果如图6 所示.
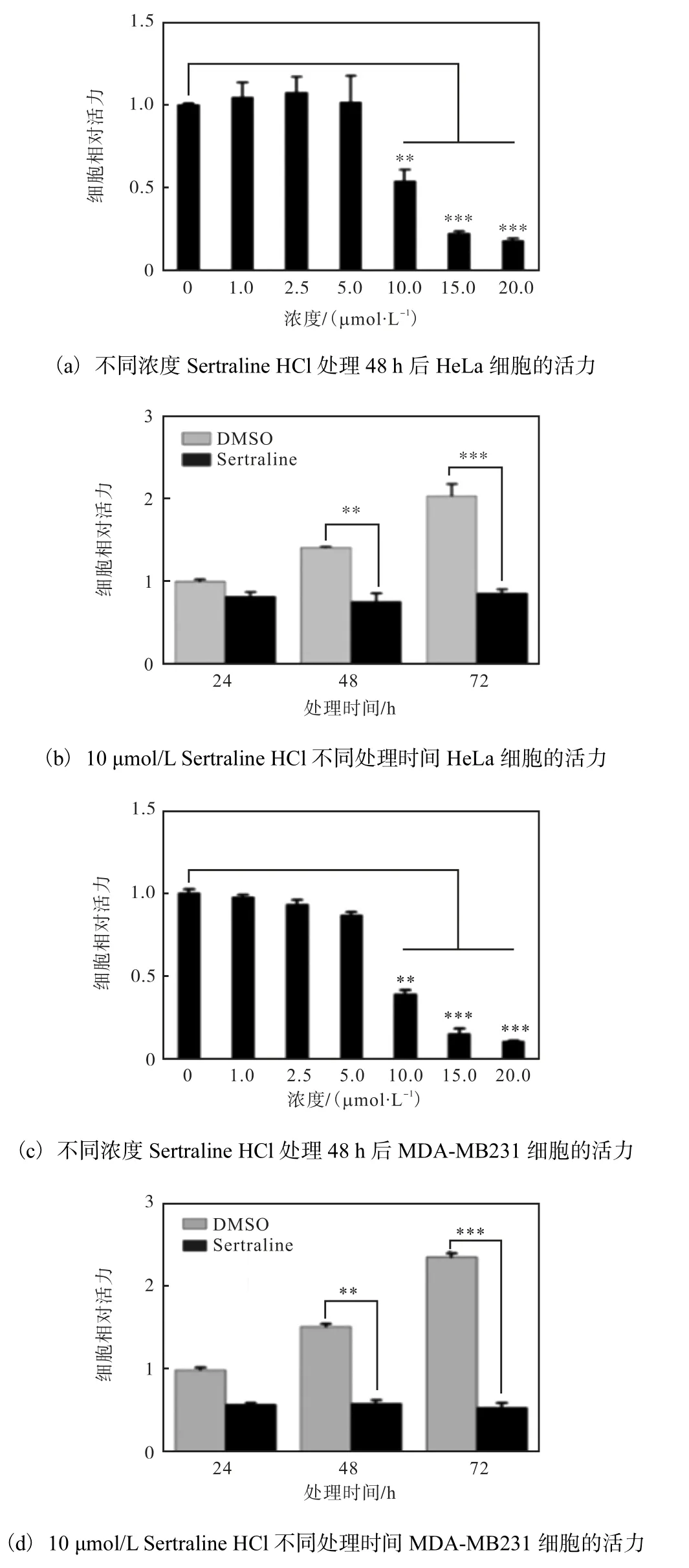
图6 Sertraline HCl对肿瘤细胞活力的影响Fig.6 Effect of Sertraline HCl on cancer cells viability
Sertraline HCl 在10µmol/L 以上浓度时,HeLa、MDA-MB231 细胞的活力均受到抑制,并呈浓度梯度依赖性;10µmol/L Sertraline HCl 处理HeLa、MDAMB231 细胞48 h 时,细胞活力均出现了明显降低(P<0.01),72 h 更明显(P<0.001),并呈时间梯度依赖性,表明Sertraline HCl 抑制肿瘤细胞的活力.
3 讨 论
TFEB 与人类疾病的发生存在相关性,它的激活对许多神经系统疾病和溶酶体疾病的治疗有潜在的作用.因此,以精确的时间和组织特异性方式调节TFEB 活性的小分子化合物的开发具有很好的前景.这些小分子有潜力用于众多的人类疾病的治疗,包括肝细胞代谢调节、巨噬细胞炎症反应、肌肉线粒体功能以及神经元细胞清除等方面.
TFEB 参与细胞内清除的多个途径,TFEB 可以作为治疗靶点用于治疗许多与自噬或溶酶体功能障碍有关的疾病和与有毒聚集物累积相关的疾病.研究证明调节TFEB 的活性具有作为溶酶体疾病治疗策略的潜力,因为自噬/溶酶体途径的缺陷是这类疾病发病机制的重要原因[21-23].
因此,构建稳定表达TFEB-GFP 的HeLa 细胞系用于筛选和研究激活TFEB 活性小分子化合物具有重要意义.本研究筛选到Sertraline HCl 具有促进TFEB 转录活性的作用.Sertraline HCl 是选择性5-羟色胺再摄取抑制剂(SSRIs)类的抗抑郁药[24],主要用于治疗抑郁症、焦虑症、强迫症、恐慌症和创伤后应激障碍,还可用于早泄[25-26]、神经心源性晕厥[2]等疾病的治疗.Sertraline HCl 也适合治疗包括患阿尔茨海默氏病(AD)在内的老年患者的抑郁症状[27],控制AD 患者出现的其他可能由血清素能系统介导的行为问题,如焦虑、易怒和攻击性等[28].能够改善伴有抑郁症的稳定型慢性阻塞性肺疾病(COPD)患者生活质量的疗效[29],在治疗脑卒中后抑郁症[30]、糖尿病抑郁症[31]、冠心病介入术后抑郁症[32]、帕金森病后抑郁症[33]也显示了良好的临床效果.Sertraline HCl对脑结构的改善与强迫症患者的症状改善有关,Tang等[34]研究了Sertraline HCl 对强迫症患者脑结构的影响,结果显示,用Sertraline HCl 进行药物治疗12 周后,有11 例强迫症患者的灰质体积显著增加,小脑活化增加.目前,Sertraline HCl 的抗抑郁疗效明显,但对肿瘤细胞的作用鲜有报道.
本次实验利用高效且能稳定整合于宿主基因组的慢病毒载体构建了稳定表达TFEB-GFP 的HeLa细胞系,为研究TFEB 在HeLa 细胞中的功能及作用机制奠定了基础,该细胞系还为针对TFEB 的靶向性研究提供了一种切实可行的细胞模型;同时利用该细胞模型筛选出了促TFEB 入核药物Sertraline HCl,该药物能够促进TFEB 靶基因的表达,并促进细胞自噬,具有抗肿瘤活性.自噬在肿瘤细胞中起着抵抗肿瘤组织微环境压力的作用,从而促进肿瘤细胞的生长.当细胞自噬处于一定的水平内,主要体现为促进肿瘤细胞存活的作用,但是也存在过度激活的自噬导致肿瘤细胞死亡的现象,这也是一个可能的抑瘤机制[35].因此,可以推测Sertraline HCl 可能通过过度激活细胞自噬引起肿瘤细胞的死亡.
——一道江苏高考题的奥秘解读和拓展

