miR-199a-3p通过上调NET1表达促进胃癌细胞增殖①
欧阳德亮 刘龙飞 王丽萍 黄明明 肖建虹
(南华大学附属第三医院普外科,衡阳421000)
胃癌是世界范围内最常见的恶性肿瘤之一,其发病率位列恶性肿瘤的第二位。早期胃癌无明显症状且易被忽略[1]。因此,大部分患者常因早期漏诊而延误最佳治疗时机。尽管近年来国内外医疗水平不断提升,但胃癌的死亡率一直居高不下。考虑到胃癌的发生发展涉及原癌基因激活、抑癌基因失活突变等多种因素[2],明确胃癌发生的分子机制对于临床的诊断治疗意义重大。
微小RNA(microRNA,miR) 是长约22 nt的非编码RNA,广泛存在于从病毒到人类的各种生物中,具有高度保守性。这些miR能够与mRNA结合阻断蛋白编码基因的表达,进而影响蛋白翻译功能。其中miR-199a-3p作为一种癌基因参与了许多人类肿瘤的发病过程,包括肝细胞癌、肾细胞癌、卵巢癌等。研究表明,miR-199a-3p可通过下调MAPK通路来促进胃癌细胞增殖[3]。此外,miR-199a-3p还可通过抑制ZHX1表达来调控胃癌细胞的增殖与凋亡[4]。尽管miR-199a-3p与胃癌的发生发展存在一定的联系,但其中的具体分子机制仍未完全明确,可能与多种靶基因的表达有关。因此,本研究旨在探讨miR-199a-3p影响胃癌细胞增殖的分子机制。
1 材料与方法
1.1材料 人胃癌细胞株BCG-823、MKN-28以及正常胃黏膜上皮细胞GES-1购自中国科学院上海生命科学研究所细胞库;CCK-8试剂购自北京索莱宝科技有限公司;双荧光素酶报告基因试剂盒购自碧云天生物技术有限公司;Lipofectamine 2000转染试剂盒、Trizol试剂盒购自美国Invitrogen公司;NET1多克隆抗体、GAPDH抗体购自Abcam公司;pcDNA3.0-miR-199a-3p、pcDNA3.0-Anti-NET1质粒由上海基屹生物科技有限公司构建;重组荧光素酶报告基因pISO-Net1-3′-UTR由汉恒生物科技有限公司构建。
1.2方法
1.2.1细胞培养及处理 BCG-823、MKN-28和GES-1细胞培养基为含10%胎牛血清的RPMI1640,并于37℃、5%CO2的细胞培养箱中培养。将生长良好的上述细胞分别接种至24孔板中,待细胞生长至80%左右时,用Lipofectamine 2000转染试剂盒分别将相应的表达质粒以及阴性对照转染至细胞中,构建出稳定转染的细胞株。
1.2.2CCK-8法检测细胞增殖 将经过实验处理的BCG-823、MKN-28以及GES-1细胞以1×104ml-1细胞密度接种于96孔板中,每孔100 μl。分别在培养0、24、48、72 h后,每孔加入CCK-8溶液(5 mg/ml)10 μl,继续培养4 h后终止培养。上机检测前,轻轻振荡混匀1 min。随后选择450 nm波长,在酶标仪上测定各孔吸光度值。
1.2.3双荧光素酶报告基因检测 将构建好的pISO-NET1-3′-UTR与pISO-NET1-3′-UTR-Mut重组荧光素酶报告基因分别与miR-199a-3p、miR-199a-3p-NC以及Anti-miR、Anti-miR-NC共转染至BCG-823细胞中,48 h后按照双荧光素酶报告基因试剂盒说明书检测荧光素酶活性。
1.2.4Western blot 检测NET1蛋白的表达水平 提取BCG-823细胞的总蛋白。按照Western blot说明书进行聚丙烯酰胺凝胶电泳。电泳结束后,半干转膜30 min。随后滴加NET1多克隆抗体4℃孵育过夜。第2天滴加二抗后37℃孵育2 h。最后加入ECL发光液并置于显影仪中显影。随后以GAPDH为内参用Image J2X软件进行灰度值扫描,计算相对表达量。
1.2.5qRT-PCR检测miR-199a-3p、NET1 mRNA水平 Trizol试剂盒提取BCG-823细胞的总RNA,纯化后按照逆转录试剂盒说明书使其逆转录为cDNA,随后按照qRT-PCR反应体系进行引物扩增。扩增完毕后,使用2-ΔCt法计算各细胞中miR-199a-3p和NET1 mRNA的相对表达量。PCR引物设计如下:miR-199a-3p上下游引物:5′-GTCACAGTAGTCTGCACAT-3′、5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTAACCA-3′,NET1上下游引物:5′-GTGGCTTCACCAACTATACG-3′、5′-GACTGCATTAGTTCGGATGT-3′,GAPDH上下游引物:5′-GAAGGTGAAGGTCGGAGTC-3′、5′-GAAGATGGTGATGGGATTTC-3′。
1.2.6流式细胞检测 收集上述转染后的BCG-823细胞,加入1.5 ml Hanks缓冲液。细胞过滤后置于流式管中,离心10 min弃上清液。随后加入Binding缓冲液100 μl,振荡混匀。再加入5 μl Annexin V-FITC和10 μl的PI溶液,混匀后37℃避光孵育20 min。最后在流式管中加入150 μl Binding Buffer,上机进行流式细胞检测。

2 结果
2.1miR-199a-3p在胃癌细胞中的表达及对其增殖的影响 通过qRT-PCR分别检测BCG-823、MKN-28和GES-1细胞中miR-199a-3p表达水平。结果显示,BCG-823、MKN-28细胞中miR-199a-3p水平要显著高于GES-1细胞(P<0.01,图1A)。而在三种细胞中转染miR-199a-3p后,BCG-823、MKN-28细胞的增殖活性在转染后24、48、72 h均显著高于GES-1细胞(P<0.01,图1B)。提示miR-199a-3p能够促进胃癌细胞增殖。
2.2NET1是miR-199a-3p的靶点基因 为了明确NET1与miR-199a-3p的关系,我们进行了双荧光素酶报告基因检测。与共转染miR-199a-3p-NC和NET1-3′-UTR报告基因载体相比,共转染miR-199a-3p和NET1-3′-UTR后,荧光素酶活性显著上升。共转染miR-199a-3p和NET1-3′-UTR-Mut则对荧光素酶活性无显著影响(图2A)。而将Anti-miR、Anti-miR-NC与荧光素酶报告基因共转染后可得到相反的结果(图2B),表明NET1是BCG-823细胞中miR-199a-3p的靶分子。
2.3miR-199a-3p上调人胃癌细胞中NET1蛋白的表达 Western blot结果显示(图3),转染miR-199a-3p后BCG-823细胞内NET1蛋白的表达水平要显著高于miR-199a-3p-NC转染组。而转染Anti-miR-199a-3p后NET1蛋白的表达水平则要显著低于Anti-miR-199a转染组。

图1 miR-199a-3p在胃癌细胞中的表达及对其增殖的影响Fig.1 Expression of miR-199a-3p in gastric cancer cells and its effect on cell proliferationNote: A.qRT-PCR was used to detect the expression of miR-199a-3p in gastric cancer cells;B.CCK-8 assay was used to detect the cell proliferation,**.P<0.01.
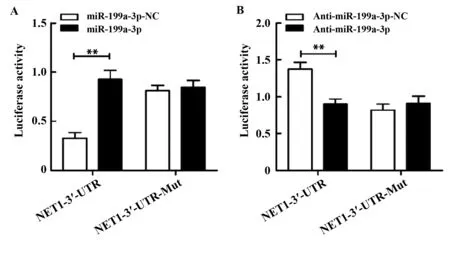
图2 双荧光素酶报告基因检测Fig.2 Dual-luciferase reporter gene assayNote: A.Co-transfected miR-199a-3p,miR-199a-3p-NC with NET1-3′-UTR reporter vectors;B.Co-transfected Anti-miR,Anti-miR-NC with NET1-3′-UTR reporter vectors,**.P<0.01.
2.4miR-199a-3p上调人胃癌细胞中NET1 mRNA的表达 qRT-PCR进一步检测BCG-823细胞中NET1 mRNA的表达水平。结果如图4所示,转染miR-199a-3p表达质粒上调BCG-823细胞中miR-199a-3p的表达水平后,NET1 mRNA表达水平显著上升。而转染miR-199a-3p抑制剂后,NET1 mRNA表达水平显著降低。提示miR-199a-3p能够促进NET1的表达。
2.5NET1对miR-199a-3p调控胃癌细胞增殖的影响 BCG-823细胞分别转染miR-199a/pcDNA、miR-199a-NC/pcDNA、miR-199a/pcDNA-Anti-NET1后,进行CCK-8细胞增殖实验和细胞凋亡检测。结果显示(图5),miR-199a/pcDNA-Anti-NET1组的BCG-823细胞增殖水平要显著高于miR-199a-NC/pcDNA组而低于miR-199a/pcDNA组(P<0.05)。而流式细胞检测结果显示(图6),miR-199a/pcDNA-Anti-NET1组的细胞凋亡率要显著低于miR-199a-NC/pcDNA组而高于miR-199a/pcDNA组。提示miR-199a-3p可能通过上调NET1表达发挥抗凋亡以及促进细胞增殖的作用。
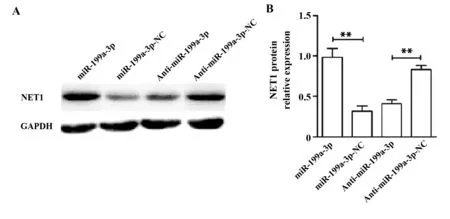
图3 BCG-823细胞中NET1蛋白的表达水平Fig.3 Expression level of NET1 protein in BCG-823 cellsNote: A.Western blot was used to detect the protein expression of NET1 in BCG-823 cells;B.The relative expression of NET1 protein,**.P<0.01.

图4 BCG-823细胞中NET1 mRNA的表达水平Fig.4 Expression level of NET1 mRNA in BCG-823 cellsNote: qRT-PCR was used to detect the expression of NET1 mRNA in BCG-823 cells,**.P<0.01.
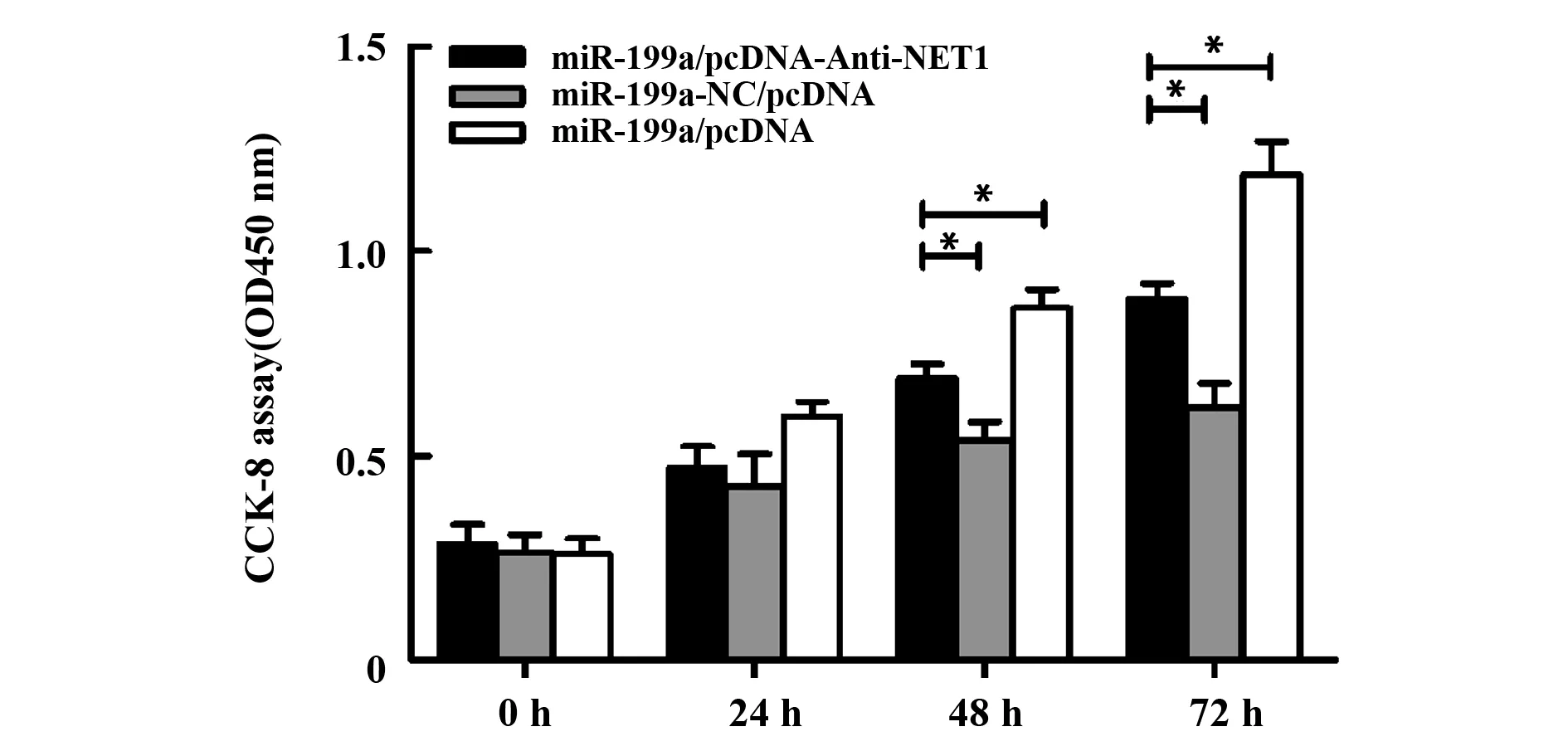
图5 NET1对胃癌细胞增殖的影响Fig.5 Effects of NET1 on proliferation of gastric cancercellsNote: CCK-8 assay was used to detect the cell proliferation,*.P<0.05.

图6 NET1对胃癌细胞凋亡的影响Fig.6 Effect of NET1 on apoptosis of gastric cancer cellsNote: A-C.Results of flow cytometry;D.Results of apoptosis rate,**.P<0.01.
3 讨论
随着人们生活水平的提高,胃癌的发生率也呈逐年递增趋势,而明确其致病机制对于预防控制胃癌的发生意义重大[5]。miRNA是一类由内源基因编码的单链RNA分子,其能够参与调控肿瘤细胞的增殖、分化等生命活动,并直接影响肿瘤的发生发展[6]。而既往研究表明,miRNA对于胃癌的发生同样具有重要意义。miR-21水平升高能够显著抑制RECK的表达从而促进幽门螺杆菌感染,而下调miR-21则能够诱导胃癌细胞发生凋亡[7]。miR-15和miR-16则与胃癌细胞耐药的敏感性密切相关[8]。此外,有报道显示miR-199a-3p在胃癌组织中呈高表达,其与癌细胞的淋巴结转移、分化程度以及TNM分期均存在一定的相关性。本研究中,miR-199a-3p在胃癌细胞BCG-823、MKN-28中的水平显著高于正常细胞,同时还能够促进胃癌细胞增殖,这与之前的研究结论相符。
NET1是近年来新发现的一种肿瘤相关基因,它与肿瘤细胞的增殖、迁移以及浸润均存在密切关系。目前NET1已作为肿瘤基因靶向治疗的关键分子广泛应用于各种肿瘤的研究中[9]。NET1基因在不同鼻咽癌患者的组织中均呈现出特异性的高表达,提示其可作为诊断鼻咽癌发生的标志物[10]。此外,NET1在结肠癌和膀胱癌的组织中,表达水平均要明显高于正常人,且其表达量随癌细胞的分化、淋巴转移逐渐增高[11]。
目前已有报道,NET1与多种miRNA同样存在相关性。miR-200a过表达时能够通过诱导NET1表达增加来促进癌细胞的增殖与迁移[12]。miR-638则可通过靶向调节NET1表达,来减弱大肠癌细胞的增殖及侵袭力[13]。而在胃癌的分子机制中,已经发现miR-573能够负向调控NET1,进而抑制胃癌的发生发展[14]。本研究发现NET1同样是胃癌细胞中miR-199a-3p的靶分子,miR-199a-3p能够显著上调NET1的表达水平,该结果也进一步证实NET1与胃癌的发生发展密切相关。
siRNA靶向NET1基因后,肝癌细胞增殖受到了明显的抑制,随后其细胞内吞作用出现减弱、细胞凋亡率增加、化疗药物敏感性上升。提示NET1基因可能是肿瘤治疗的潜在靶点,RNAi也可能成为肿瘤靶向治疗的有效方法。而利用双靶向siRNA技术同时沉默NET1和VEGF基因,则能够更加显著地抑制肝癌细胞的增殖,促进细胞凋亡并减少肿瘤血管的形成[15]。而本研究通过转染Anti-NET1质粒,发现miR-199a-3p同样能够通过靶向调节NET1表达,发挥抗凋亡和促进细胞增殖的作用。
综上,miR-199a-3p参与了胃癌的发生发展,其在胃癌细胞中呈高表达。此外,miR-199a-3p在参与胃癌的发生过程中,可能通过上调NET1的表达发挥作用。但是考虑到肿瘤是多种因素以及不同生物过程共同作用的结果,miR-199a-3p除调控NET1外,可能还存在其他的靶点基因以及作用机制。因此,我们仍需进一步研究。