miR-367-3p靶向SMURF1抑制BCG介导的巨噬细胞凋亡和自噬
姬文兰 王启源 虞秀锋 胡 萍 王亚梅
(陕西省结核病防治院内四科,西安710100)
结核病(Tuberculosis,TB)是由致病菌结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染所引起的人畜共患的慢性传染疾病。MTB为胞内寄生菌,主要寄生的宿主细胞是巨噬细胞,其进入肺部后,由宿主的第一道防线巨噬细胞所识别、结合、吞噬,使MTB激活宿主细胞内免疫反应,引起多种通路的活化,进而引起细胞凋亡,吞噬小体酸化,形成吞噬溶酶体,细胞吞噬作用增强,同时产生多种细胞因子共同发挥抗结核作用来清除感染[1]。
微小RNA(microRNAs,miRNAs)是一类长度约为20~25个核苷酸的非编码RNA,可通过抑制靶mRNA翻译或诱导靶mRNA降解从而影响多种生物学进程[2-4]。miRNAs在MTB与宿主细胞相互作用过程中发挥关键作用,调节感染后细胞免疫反应和细胞命运,甚至限制细菌增殖,参与机体抗结核感染的过程[5-7]。近年来,多项研究表明多种miRNAs在MTB侵入巨噬细胞后表达量发生改变,可通过靶向关键基因,调控凋亡及自噬过程,进而干扰宿主细胞对MTB的清除[8-13]。因此,研究miRNAs与TB之间的关系不仅有助于阐明MTB致病和宿主应对结核菌的免疫反应机理,还能为TB生物标志物和治疗靶标的研究提供依据。
本研究以RAW264.7细胞为研究对象,探究miR-367-3p在巨噬细胞抗卡介苗菌株(Bacillus calmette-guerin,BCG)感染机制中的关键作用,以期了解在BCG感染巨噬细胞过程中miR-367-3p对凋亡和自噬及介导的免疫效应的影响及其机制,为探讨TB发病机制、研发新的诊断与治疗方法提供一定实验依据。
1 材料与方法
1.1材料 小鼠巨噬细胞RAW264.7(中科院上海细胞所);Middlebrook 7H9培养基(BD公司,美国);Trizol试剂盒和LipofectamineTM2000脂质体(Invitro-gen公司,美国);反转录试剂盒和双荧光素酶检测试剂盒(Promega公司,美国);SYBR Premix Ex TaqⅡ(Qiagen公司,德国);BCA蛋白定量试剂盒(Pierce公司,美国);PVDF膜(Millipore公司,美国);Bax、Bcl-2、p62、SMURF1和β-actin抗体(Abcam公司,美国);LC3抗体(Cell Signaling Technology公司,美国);ECL化学发光试剂盒(Thermo公司,美国);细胞凋亡检测试剂盒Cell Death Detection ELISA kit(Roche公司,德国);miR-367-3p抑制剂及阴性对照购自上海吉玛制药技术有限公司;BCG购自上海生物制品研究所有限公司。
1.2方法
1.2.1细胞培养 将RAW264.7巨噬细胞置于含10%胎牛血清、100 mg/L青霉素和100 mg/L链霉素的DMEM培养液中,37℃、5%CO2培养,胰酶消化传代,继续培养,待细胞增殖状态良好,进入后续实验。
1.2.2BCG处理RAW264.7巨噬细胞 RAW264.7细胞悬液加入六孔板的各孔中,加入DMEM培养基,24 h后弃细胞培养液,PBS洗涤2~3次。在每孔滴加MOI=10的菌悬液(BCG与细胞的比例为10∶1),置于细胞培养箱中37℃、5%CO2孵育。感染4 h后弃上清,目的是去除未感染进入细胞内的细菌,更换新鲜培养液,此时作为细胞感染的0 h。BCG感染巨噬细胞0、6、12、24及48 h时检测各组miR-367-3p的表达水平。
1.2.3细胞转染 采用LipofectamineTM2000试剂将miR-367-3p抑制剂(inhibitors)及阴性对照(Negative control,NC)转染至RAW264.7细胞,严格按照说明书进行操作,RT-PCR验证转染是否成功。
1.2.4RT-PCR检测mRNA的表达水平 细胞总RNA提取按照Trizol试剂盒说明书进行操作,分光光度法测定总RNA浓度。根据逆转录试剂盒说明书将细胞总RNA逆转录合成cDNA。应用SYBR试剂盒在ABI7500实时定量PCR仪上测定目的基因相对表达水平。采用Quantity one凝胶成像分析系统测定各相应条带的灰度值,以U6和β-actin作为内参照,目的基因的相对表达量以2-ΔΔCt表示。
1.2.5Western blot检测蛋白表达 按照全蛋白提取试剂盒说明提取细胞的总蛋白,BCA蛋白定量检测试剂盒测定蛋白浓度。蛋白经SDS-PAGE电泳分离后电转至PVDF膜。5%脱脂奶粉室温封闭1.5 h,加入特异性一抗于4℃过夜孵育。TBST漂洗3×10 min后,加入辣根过氧化物酶标记的相应二抗,室温孵育2 h,TBST漂洗3×10 min后用ECL发光显影并拍照;Western blot检测条带用凝胶成像仪分析系统Quantity One软件扫描灰度值。计算目的蛋白与β-actin灰度值的比值,进行统计学分析。
1.2.6CFU计数检测BCG存活率 巨噬细胞RAW264.7转染miR-367-3p inhibitors和NC 24 h,被BCG感染4 h后,用PBS洗涤以清除细胞外细菌。此后,被感染的细胞在指定的时间内孵育,去除12孔板中的培养液后每孔加入500 μl 0.5% Triton X-100裂解细胞。倒置显微镜下观察巨噬细胞的裂解情况,待巨噬细胞全部裂解后每孔加入500 μl完全培养液终止裂解。振荡混匀5 min,将稀释后裂解物一式3份并接种至含有OADC的Middlebrook 7H10琼脂培养基上培养,3周后,进行菌落计数。
1.2.7ELISA检测细胞凋亡 将RAW264.7细胞以5×105个/ml接种于六孔板培养皿中,按实验设计处理后24 h,用细胞凋亡ELISA检测试剂盒进行检测,参照说明书进行操作。
1.2.8生物信息学预测分析 利用生物信息学软件TargetScan、miRanda及PicTar等预测miR-367-3p的靶基因。
1.2.9荧光素酶报告实验 分别将含有野生型[Smad泛素化调节因子1(Smad ubiquitin regulatory factor-1, SMURF1)3′-UTR-WT]及突变型(SMURF1 3′-UTR-Mut)的报告基因载体和miR-367-3p inhibit-ors、NC共转染至HEK293细胞,48 h后,按照双荧光素酶检测试剂盒使用说明进行操作,于酶标仪上检测萤火虫荧光素酶和海肾荧光素酶的活性。以海肾荧光素酶作为内参,计算萤火虫荧光强度与海肾荧光强度比值。

2 结果
2.1miR-367-3p在MTB感染的RAW264.7细胞中高表达 为探讨miR-367-3p在BCG感染的免疫应答中的作用,首先检测BCG感染6、12、24和48 h后小鼠巨噬细胞RAW264.7中miR-367-3p的表达量,结果显示,与0 h相比,BCG处理不同时间后,RAW264.7中miR-367-3p的表达水平均明显升高,且24 h时miR-367-3p表达量最高(图1A),由此表明BCG诱导的miR-367-3p在BCG感染的RAW264.7细胞中具有重要调节作用。随后为进一步探讨miR-367-3p在BCG感染巨噬细胞中的作用机制,RAW264.7转染miR-367-3p inhibitors下调其表达水平,转染效率如图1B所示,BCG诱导的miR-367-3p的表达水平显著下调,提示转染成功。
2.2miR-367-3p抑制MTB诱导的巨噬细胞凋亡 CFU检测胞内BCG存活率,结果发现抑制miR-367-3p后胞内BCG存活率明显降低(图2A),提示miR-367-3p可促进BCG在巨噬细胞中的存活。进而检测miR-367-3p是否对BCG诱导的细胞凋亡有影响,ELISA结果显示miR-367-3p下调明显增加细胞凋亡率(图2B),说明miR-367-3p能够抑制BCG介导的巨噬细胞凋亡。同时,Western blot检测促凋亡蛋白Bax和抗凋亡蛋白Bcl-2表达,结果显示抑制miR-367-3p表达明显上调Bax的表达并下调Bcl-2表达水平(图2C~E)。上述结果揭示抑制miR-367-3p通过促进巨噬细胞凋亡进而加强宿主巨噬细胞对BCG的清除。

图1 BCG感染诱导RAW264.7细胞中miR-367-3p的表达Fig.1 miR-367-3p expression in BCG-stimulated RAW 264.7Note: A.Relative expression level of miR-367-3p at indicated time was determined by RT-PCR analysis.*.P<0.05 vs 0 h;B.RT-PCR was carried out to evaluate the transfection efficiency of miR-367-3p inhibitors.*.P<0.05 vs NC(no BCG);#.P<0.05 vs NC;&.P<0.05 vs BCG+NC.
2.3miR-367-3p抑制BCG介导的巨噬细胞自噬进程 为了探讨miR-367-3p对巨噬细胞自噬过程的调控作用,Western blot检测自噬标志蛋白LC3-Ⅱ和p62表达水平,结果如图3所示,下调miR-367-3p表达后,自噬相关蛋白LC3-Ⅱ的表达升高且LC3-Ⅱ/LC3-Ⅰ数值增大,同时p62的表达水平降低(图3),提示miR-367-3p可抑制BCG介导的细胞自噬过程,从而调控胞内BCG的存活。

图2 miR-367-3p对BCG介导的巨噬细胞凋亡的影响Fig.2 Effect of miR-367-3p on BCG-mediated apoptosisNote: A.BCG survival was determined using CFU assay;B.Cell apoptosis was examined by ELISA assay;C-E.Western blot was performed to determine the protein expression of Bax and Bcl-2 in different groups.*.P<0.05 vs NC(no BCG);#.P<0.05 vs NC.

图3 miR-367-3p对BCG感染的巨噬细胞的自噬进程的影响Fig.3 Effect of miR-367-3p on autophagy process in BCG-infected macrophagesNote: Representative Western blot and quantitative analysis showed the levels of autophagy relative protein LC3-Ⅱ and p62.*.P<0.05 vs NC(no BCG);#.P<0.05 vs NC.
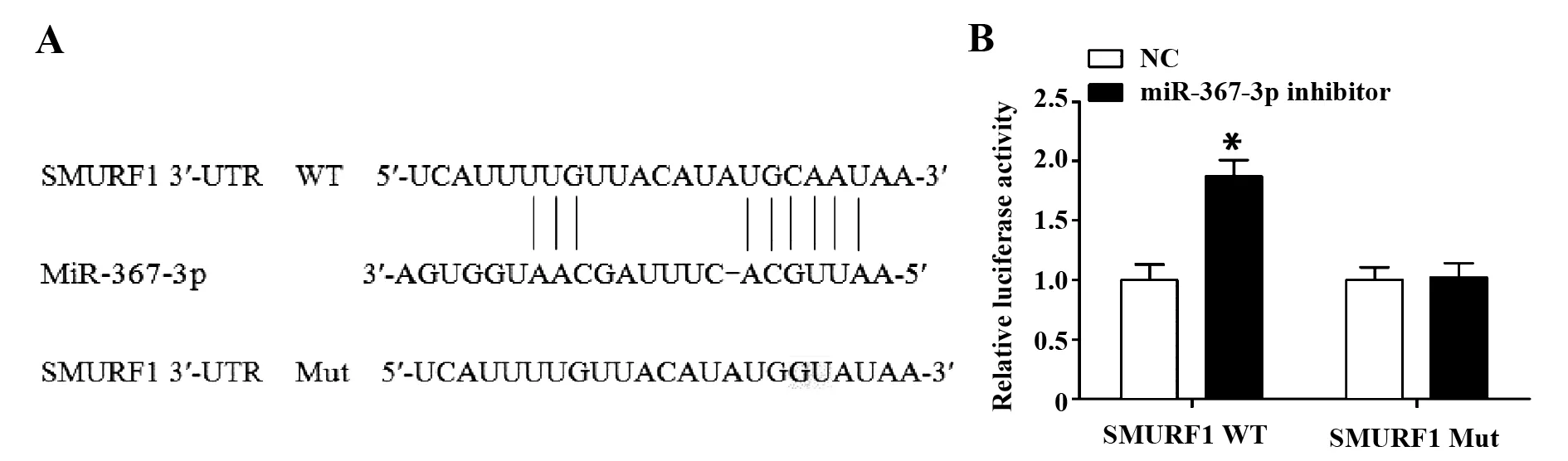
图4 miR-367-3p可直接靶向结合SMURF1的3′-UTRFig.4 miR-367-3p directly targeted 3′-UTR of the SM-URF1Note: A.Interaction sites of miR-367-3p with predicted target gene SMURF1 3′-UTR;B.The interaction between the miR-367-3p and SMURF1 detected by Dual-Luciferase Reporter Assay.*.P<0.05 vs NC.
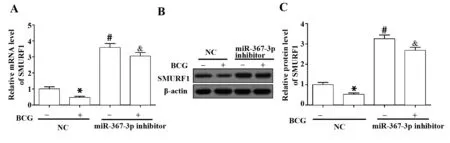
图5 miR-367-3p负调控SMURF1的表达水平Fig.5 miR-367-3p negative regulated SMURF1 expressionNote: A.The SMURF1 mRNA levels were determined using RT-PCR assay.B,C.The protein expression of SMURF1 was evaluated using Western blot analysis.*.P<0.05 vs NC(no BCG);#.P<0.05 vs NC;&.P<0.05 vs BCG+NC.
2.4生物信息学预测miR-367-3p靶基因 生物信息学软件预测结果显示SMURF1为miR-367-3p的直接靶基因(4A)。荧光素酶报告活性实验分析结果显示miR-367-3p inhibitors可显著增加SMURF1-WT的荧光素酶活性,而SMURF1-Mut荧光素酶活性无明显变化(图4B),说明miR-367-3p可靶向作用SMURF1的3′-UTR。
2.5miR-367-3p靶向调控SMURF1的表达 进一步采用RT-PCR和Western blot验证miR-367-3p和SMURF1的靶向调控关系,RT-PCR结果显示抑制miR-367-3p后SMURF1的mRNA表达量显著升高(图5A)。与RT-PCR结果一致,miR-367-3p下调明显增加SMURF1的蛋白水平(图5B、C),该结果提示miR-367-3p能够负调控SMURF1的表达。
3 讨论
TB是一种难以根治的慢性传染性疾病,目前研究证实多种miRNAs参与了TB的发病过程。研究发现MTB侵入巨噬细胞后,miRNAs可通过影响巨噬细胞免疫杀伤功能在一定程度上参与机体抗MTB感染过程,因此探讨miRNAs在MTB逃逸巨噬细胞杀伤过程中的作用对于揭示TB发病机制以及寻找抗结核药物靶标就显得尤为重要。本研究旨在探讨miR-367-3p在巨噬细胞抗BCG感染机制中的关键作用,为TB的诊断与治疗提供新途径。研究首次发现miR-367-3p在BCG感染的巨噬细胞RAW264.7中上调,并呈时间依赖性,表明miR-367-3p可能参与BCG感染巨噬细胞的调控过程。
大量研究证实miRNAs通过多种免疫机制逃逸参与巨噬细胞对MTB的杀伤,如抑制巨噬细胞凋亡、抑制溶酶体水解酶降解酸化、抑制吞噬体成熟、干扰抗原呈递、避免反应氧和反应氮产物的毒性反应、抑制自噬等,使MTB在体内复制[1,14]。MTB进入机体之后,巨噬细胞可以通过自身凋亡以杀死巨噬细胞内的MTB,阻止MTB在体内播散,并可激活邻近未被感染的巨噬细胞,增强机体对MTB的杀伤能力;这一过程既可抑制细胞内MTB的释放,又可抑制菌体在宿主内进一步的生长和繁殖[15,16]。对MTB的识别及抗凋亡机制的研究,将为TB的防治提供新的靶目标和新思路。本研究结果显示抑制miR-367-3p可降低BCG的胞内存活量,即下调miR-367-3p有利于BCG的清除。巨噬细胞凋亡可有效控制MTB的散播及生长,对MTB的清除具有重要作用。进一步探讨miR-367-3p对BCG感染巨噬细胞凋亡的调控作用,检测miR-367-3p对巨噬细胞凋亡率及相关靶基因表达水平的影响,研究结果揭示下调miR-367-3p通过调控凋亡相关蛋白表达促进巨噬细胞凋亡进程。以上结果提示抑制miR-367-3p通过促进巨噬细胞凋亡,增强细胞免疫应答,从而影响胞内BCG清除,是机体对结核感染防御的主要免疫机制。
MTB作为胞内寄生菌,以巨噬细胞为宿主。近年研究表明自噬是巨噬细胞中固有免疫和适应性免疫的重要组成部分,可以参与调控MTB在胞内的存活及巨噬细胞对于MTB的清除作用[17]。自噬与凋亡作为程序性死亡的两种方式,既相互独立又紧密相关,清除机体受到外界刺激时产生的病变细胞及正常生命周期内衰老细胞,进而维护机体内环境的平衡与稳定。在机体演变中自噬可以对凋亡产生一定的影响,反过来凋亡也可以通过各种信号通路介导进而调控自噬的程度。自噬可以做为胞内病原体感应机制,如果自噬受到抑制,那么将容易发生感染。自噬有利于宿主细胞清除感染的病原菌以减轻自身损伤,是机体免疫防御的重要组成部分[18]。目前已发现有多种途径参与自噬的诱导和调节。在感染的巨噬细胞内,诱导自噬的发生能促进吞噬体和溶酶体的融合,抑制胞内MTB的存活。研究发现miRNAs在肺结核患者体内显著升高或降低,其通过靶向巨噬细胞内自噬相关基因表达从而抑制自噬,增强MTB的抗自噬能力和生存力。LC3Ⅱ是自噬小体标志蛋白,LC3Ⅱ/LC3Ⅰ可以反映细胞发生自噬的水平。p62为自噬活化过程中的一个调节分子,与自噬程度呈负相关[19]。本实验进一步探讨miR-367-3p对BCG感染巨噬细胞自噬的影响,发现下调miR-367-3p表达后自噬标志蛋白LC3-Ⅱ的表达水平升高,而p62表达水平降低,表明miR-367-3p可抑制BCG介导的巨噬细胞自噬过程。上述结果提示miR-367-3p的下调可以诱导细胞自噬的发生,进而促进宿主细胞对于BCG的清除作用,从而参与TB的免疫病理反应。
继而寻找miR-367-3p对巨噬细胞免疫杀伤功能影响的关键靶标,为结核病的机制的完善奠定基础。SMURF1是一种与E6相关蛋白C端同源型泛素连接酶,在免疫系统中具有重要作用。有研究报道SMURF1缺失抑制MTB感染介导的自噬过程,且胞内MTB存活率升高[20]。利用TargetScan、miRDB、PicTar等生物信息学软件预测到miR-367-3p靶基因为SMUR-F1。荧光素酶报告基因活性分析显示miR-367-3p能特异结合到SMURF1 3′-UTR,明显抑制荧光素酶活性。进一步通过RT-PCR和Western blot方法验证miR-367-3p对SMURF1的靶向调控作用,结果显示miR-367-3p能够负向调控SMURF1的mRNA和蛋白表达水平。上述结果揭示miR-367-3p能直接结合SMURF1 3′-UTR并靶向负调控其表达。
综上所述,下调miR-367-3p可通过靶向SMUR-F1负向调控其表达,从而促进BCG介导的凋亡和自噬过程,揭示miR-367-3p在BCG感染的巨噬细胞凋亡和自噬途径中发挥重要作用,同时,抑制miR-367-3p也会在BCG感染细胞后,起到促进宿主细胞对BCG的清除作用,阻止BCG的胞内生存,为MTB的胞内存活机制及TB的靶向治疗提供一定的理论基础和新的思路。