miR-143-3p可能经MAPK7途径抑制食管癌细胞的增殖、迁移与侵袭①
薛亚军 杜雅彦 黄文华 耿 涛 魏育涛 胡建明
(新疆石河子大学医学院,石河子832000)
食管癌居世界癌症死亡病因的第6位,我国食管癌发病率和死亡病例均占全球的50%和发展中国家的60%,是居民的重要疾病负担,侵袭和转移是导致患者治疗失败和死亡的主要原因[1]。针对食管癌侵袭转移的途径进行研究,抑制食管癌的侵袭转移是提高食管癌生存期的关键[2]。微小RNA(miRNAs)是一类在生物体内普遍存在的单链非编码蛋白质小分子RNA,主要功能是调控生物体生长、发育、分化和凋亡等生命过程中的相关基因表达,在多种肿瘤的发生发展中发挥重要作用[3]。miR-143-3p是高度保守的miRNA,位于人5号染色体33位,是肿瘤生长的潜在调控因子,异常表达与子宫内膜癌、卵巢癌、膀胱癌、大肠癌等多种癌症的发生、发展有关,但其在食管癌增殖、迁移和侵袭中的作用尚未见报道[4,5]。本研究通过采用将miRNA-143-3p拟似物和阻遏物转染食管癌ECA109细胞,探讨miRNA-143-3p对食管癌ECA109细胞增殖、迁移、侵袭的影响。
1 材料与方法
1.1材料
1.1.1细胞株和实验动物 人食管癌ECA109细胞株由本院肿瘤研究中心提供,采用含10%新生牛血清的RPMI1640培养液,37℃、5%CO2的培养箱中培养,隔日更换培养液。SPF级BALB/c裸鼠36只,3~4周龄,体质量14~17 g,购于山东大学实验动物中心,恒温、恒湿饲养,采用随机数字表法将动物分为4组即空白组、阴性组、拟似组和阻遏组。
1.1.2试剂与仪器 胎牛血清、0.25%胰蛋白酶购自赛默飞世尔科技(中国)有限公司;Lipofectamine 2000转染试剂购自北京义翘神州科技有限公司;Trizol购自上海联硕生物科技有限公司;反转录试剂盒购自北京智杰方远科技有限公司;MTT、Transwell小室购自上海子起生物科技有限公司;细胞培养箱购自广州科适特科学仪器有限公司;RT-PCR试剂盒购自北京索莱宝科技有限公司;分光光度计购自托摩根生物科技有限公司;酶标仪购自香港伯齐科技有限公司;PCR仪购自杭州厚泽生物科技有限公司;miRNA-143-3p拟似物、阻遏物、阴性对照物的合成、测序均由大连宝公司进行。
1.2方法
1.2.1细胞转染 取对数生长期的ECA109细胞,胰酶消化后1 000 g离心2 min,收集细胞,调整细胞密度至1×105个/ml,接种至6孔细胞培养板,每孔添加2 ml细胞悬液,37℃和5%CO2条件下培养24 h,共分为4组,即空白对照组(Blank control group,空白组)只转染试剂,阴性组转染miRNA-143-3p阴性对照物,miRNA-143-3p拟似组转染miRNA-143-3p拟似物,miRNA-143-3p阻遏组转染miRNA145阻遏物,转染过程按照Lipofectamine 2000说明进行。
1.2.2RT转染后细胞内miRNA-143-3p表达检测 转染12、24、48、72 h后取细胞样本,采用6孔板接种密度2×105个/孔,酚氯仿法抽取RNA,取2 μg总RNA,反转录制备cDNA,取2 μl反转录产物作为PCR反应模板,荧光定量法检测miRNA-145含量,反应条件:95℃变性10 s,58℃退火10 s,72℃延伸10 s,循环数设置为40。miR-143-3p的上下游引物序列分别为5′-GGGGTGAGATGAAGCACTG-3′及5′-CAGTGCGTGTCGTGGAGT-3′。
1.2.3不同组别细胞裸鼠成瘤能力和免疫组化实验检测 细胞转染后,给相应分组的裸鼠注射细胞,隔2 d检测裸鼠成瘤情况,记录肿瘤体积和质量;14 d 后处死实验动物,采用免疫组化法检测肿瘤中MAPK7表达情况,镜下观察显色情况并拍照记录。
1.2.4ECA109细胞株增殖活性检测 转染后48 h,胰酶消化法制备ECA109细胞悬液转移至96孔板中,每孔含1×104个/ml,每组设6个复孔,接种后24、48、72 h每孔加入20 μl MTT,继续培养4 h后,弃上清,加入100 μl二甲基亚砜(Dimethyl sulphoxide,DMSO)溶解沉淀,震动混匀沉淀15 min,酶标仪比色,记录490 nm处吸光度值。
1.2.5Transwell小室法检测ECA109细胞株侵袭 取转染后ECA109细胞株1×105ml-1,接种于Transwell板上室,每孔160 μl,加入20%五味子多糖(Alkaline S.chinensis polysaccharides,ASPS)血清40 μl,800 μl RPMI1640培养基加入下室,培养24 h,计数基底膜下室细胞数,采用在400×显微镜下随机选取中央和上下左右5个视野的穿越基底膜细胞数,取均值。

2 结果
2.1转染后细胞内miRNA-143-3p表达 12、24、48、72 h时空白组和阴性组细胞内miRNA-143-3p表达相比较差异无统计学意义(P>0.05),均低于阻遏组,高于拟似组,差异均有统计学意义(P<0.05)。见图1。
2.2miRNA-143-3p转染对ECA109细胞增殖的影响 空白组和阴性组24、48、72 h时ECA109细胞增殖水平相比较差异均无统计学意义(P>0.05),均高于拟似组,低于阻遏组,差异均有统计学意义(P<0.05);空白组和阴性组ECA109细胞侵袭能力相比较差异均无统计学意义(P>0.05),均高于拟似组,低于阻遏组,差异均有统计学意义(P<0.05)。见图2。

图1 转染后ECA109细胞内miRNA-143-3p表达Fig.1 Expression of miRNA-143-3p in ECA109 cells after transfectionNote: *.P<0.05.

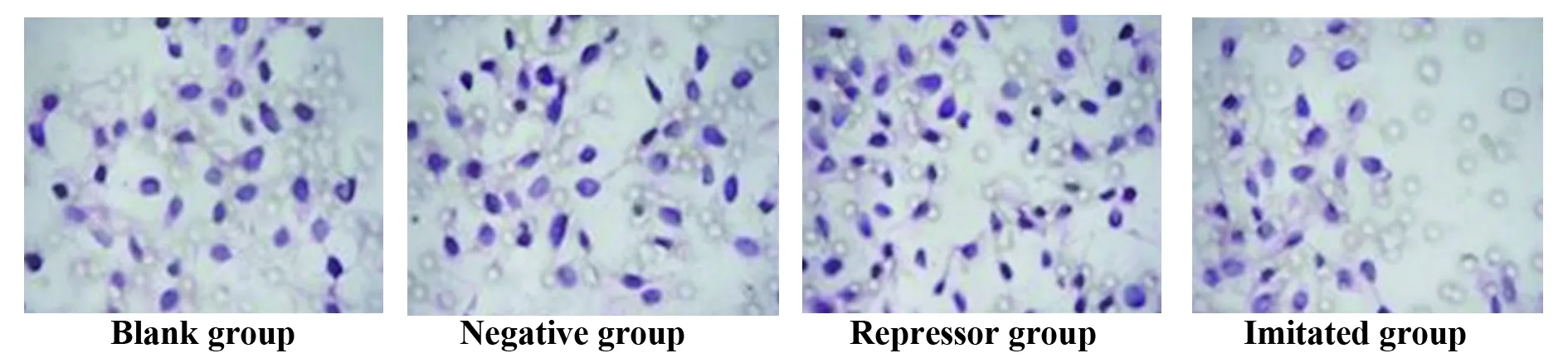
图2 miRNA-143-3p转染对ECA109细胞增殖和侵袭能力的影响
Fig.2 Effect of miRNA-143-3p transfection on prolife-ration and invasion of ECA109 cells
Note: *.P<0.05.


图3 4组裸鼠瘤体大小变化情况
Fig.3 Changes of tumor size in 4 groups of nude mice
Note: *.P<0.05.

图4 4组裸鼠瘤组织MAPK7蛋白表达情况Fig.4 Expression of MAPK7 protein in 4 groups of nude miceNote: *.P<0.05.
2.34组裸鼠瘤体大小变化情况 空白组和阴性组裸鼠瘤重量均高于拟似组,低于阻遏组,差异均有统计学意义(P<0.05),空白组和阴性组裸鼠瘤重量相比较差异无统计学意义(P>0.05)。见图3。
2.44组裸鼠瘤组织MAPK7蛋白表达情况 空白组和阴性组裸鼠瘤组织MAPK7蛋白表达水平相比较差异无统计学意义(P>0.05),均高于拟似组,低于阻遏组,差异均有统计学意义(P<0.05)。见图4。
3 讨论
miRNA为非编码的长约23个核苷酸的内源性微小RNA,可通过与靶信使RNA(messenger RNA,mRNA)的序列互补降低mRNA的稳定性和抑制其翻译,调节靶基因表达。研究显示,miRNA仅占人体基因组的1%~3%,但可调节30%的人类蛋白质编码[6,7]。miRNA对编码蛋白质基因的表达具有广泛影响,并主要通过靶向mRNA 3′非翻译端,负性调控靶mRNA的转录和翻译,发挥类似于癌基因或抑癌基因的作用,在肾癌、结肠癌、肺癌、胃癌等肿瘤中均存在miRNA表达[8-11]。
近年来,越来越多的研究显示miRNA表达异常参与了EC的发生发展。Guo等[12]在研究食管鳞癌(Esophageal squamous cell carcinoma,ESCC)中miRNA表达谱时发现 miR-25、miR-424、miR-151表达上调,miR-100、miR-99a、miR-29c、miR-140表达下调,这些表达异常的miRNA能够准确区分ESCC和正常组织,进一步对miRNA表达谱与EC临床病理资料进行分析时发现,miR-25、miR-130b与EC的高中低分化有关。赵晓鸿等[13]利用miRNA芯片技术检测了ESCC组织中miRNA表达谱的变化,显示has-miR-25、has-miR-424和has-miR-151在癌组织中上调,miR-133a、miR-143、miR-145与miR-375在癌组织中下调,可能与食管黏膜上皮的癌变相关,且其改变是ESCC发生的早期事件。Liu等[14]研究显示miR-143和miR-145可调节FSCN1而致癌,并参与转移的调节,可能为EC早期诊断和预后的潜在生物标志物。Wu 等[15]检测 86 例ESCC标本中miRNAs 的表达,发现miR-143和miR-145的表达水平显著下调,并与肿瘤的浸润深度有关,转染miR-145、miR-133a和miR-133b抑制EC细胞增殖和浸润。Akagi等[16]的研究证明了 miR-145 和 miR-143 的高表达与ESCC的复发转移有关。Kano等[17]的报告则证明了miR-145 的表达与ESCC的复发相关,并与患者的生存时间呈负相关。本研究将miRNA-143-3p拟似物和阻遏物转染至食管癌ECA109细胞株,结果显示,转染miRNA-143-3p拟似物的细胞株增殖、侵袭能力均显著降低,转染miRNA-143-3p阻遏组细胞株增殖、侵袭能力均显著增高,因此miRNA的表达特征对于研究能够识别EC的存在、侵袭和预后的肿瘤标记物具有潜在的临床应用价值,miR-143下调与食管癌的增殖、侵袭和预后密切相关,但其作用机制尚有待进一步研究探讨。
信号传导通路异常贯穿于恶性肿瘤的增殖、分化、凋亡等各个阶段,丝裂酶原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)是细胞内丝氨酸/苏氨酸蛋白激酶,包括5条并行MAPK信号通路,分别为ERK1/ERK2、JNK/SAPK、p38、ERK3/ERK4和ERK5,ERK5又称为MAPK7,在肿瘤细胞的存活和生长过程中发挥重要作用[18]。MAPK7是非典型的MAPK通路,人类MAPK7是由816个氨基酸构成的120 kU蛋白,可通过磷酸化和C端的物理性结合作用激活转录因子肌细胞增强因子2A(Myameba enhancement factor2A,MEF2A)、肌细胞特异性增强因子2D(Myocyte enhancement factor 2D,MEF2D)和肌细胞特异性增强因子2C(Myocyte enhancement factor 2C,MEF2C),引起c-jun、BMK1等基因表达增加,在细胞分化、凋亡、应激反应及多种疾病的发生中发挥重要作用[19]。研究显示,MAPK7介导的信号对前列腺癌转移癌模型具有明显促进作用[20-22]。在乳腺癌模型中,MAPK7可介导乳腺肿瘤激酶激活,促进乳腺癌细胞转移;肝癌中MAPK7的过度表达可促进有丝分裂和肝癌细胞生长。李进科等[23]对64例食管鳞状细胞癌组织采用免疫组化方法检测食管癌和癌旁组织中MAPK7表达,发现MPAK7在食管癌组织中表达显著升高,且表达量与淋巴结转移和临床分期密切相关。本研究发现转染miRNA-143-3p拟似物的瘤体积显著降低,MAPK7表达升高,转染miRNA-143-3p阻遏物的瘤质量体积则显著降低,MAPK7表达降低,提示miRNA-143-3p可能通过MAPK7途径影响食管癌的发生发展。
综上所述,miRNA-143-3p表达异常是影响食管癌增殖侵袭的重要因素,MAPK7信号通路可能是其发挥作用的重要途径,详细机制尚有待进一步研究探讨。