叶酸介导阿霉素白蛋白纳米粒的制备及细胞学研究
胡丹丹, 李 磊, 宁偎峰, 赵 莹, 张琳琳, 胡栎芳, 孟艳秋
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
阿霉素(Doxorubicin,DOX),属于蒽环类广谱抗肿瘤抗生素,临床常用其盐酸盐,也称多柔比星,可对机体产生广泛的生物学效应.阿霉素细胞毒性作用强烈,对肝癌、甲状腺癌、淋巴癌、肺癌的疗效好,对膀胱癌、支气管癌也有一定的作用.但是,如果静脉注射高剂量的DOX将会引起强烈的心脏及脊髓毒副作用,这些缺点成为限制DOX临床应用的主要因素[1].为了提高DOX在体内的生物利用度,减少其毒副作用,增加药物的稳定性,国内外的许多学者将其载于纳米微粒、脂质体等药物载体系统中,将小分子药物与高分子载体采用纳米技术相结合,利用配体与受体间的特异性亲和作用,制成具有靶向性和缓释性等优点的纳米药物,从而降低药物的毒性与不良反应[2-3].Luten等[4]利用叶酸、聚乙二醇和聚环邻腈制备了一种叶酸靶向载体,报告基因pCMVLacZ被包裹进入该叶酸靶向载体;对其进行的人卵巢癌OVCAR3细胞体外转染实验结果显示,该叶酸复合物的转染效率是无叶酸复合物的3倍,说明这是一种具有潜在开发价值的靶向性基因载体.Liang等[5]为了减小基因载体的毒性并优化其功能,利用聚乙二醇和聚乙烯亚胺既克服了转染效率低,又高效地将质粒DNA(pDNA)浓聚到纳米粒内部,制成了叶酸-聚乙二醇-聚乙烯亚胺/pDNA复合物,将异硫腈酸荧光素结合到这种复合物的氨基上,与叶酸受体阳性的人胚肾上皮细胞HEK293和人脑胶质瘤C6细胞共孵育,结果显示肿瘤细胞显著吞噬荧光物质.细胞实验显示该叶酸复合物毒性较低,叶酸复合物组转染效率是无叶酸组的15倍,故叶酸是较为理想的靶向治疗载药系统.
本文以一种无免疫原性、生物可降解材料牛血清白蛋白为载体,将叶酸偶联在其表面,制备载阿霉素的白蛋白纳米粒.利用配体与受体间特异性亲和作用制备高载药量和高包封率的纳米粒,并对其粒径、释放速率等性质进行考察;以阿霉素粉剂为对照,考察其体外抗肿瘤活性,为叶酸偶联阿霉素白蛋白纳米粒的进一步开发研制奠定基础[6].
1 仪器和试剂
仪器:FA1204B电子分析天平,沈阳龙杰仪器有限公司;马尔文激光粒度测试仪,马尔文帕纳科有限公司;MR700型酶联免疫检测仪,费尔伯恩精密仪器(上海)有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;高效液相色谱仪,安捷伦有限公司;DF-J01离心机、ZF7-荧光分光光度计,巩义市英裕裕华仪器厂;透射电子显微镜,赛默飞世尔科技电子有限公司; JK-CI-50CH-CO2恒温培养箱,上海精学科学仪器有限公司;KDQX-100超声波清洗机,科电超声有限公司;DF101S集热式恒温加热磁力搅拌器,郑州科丰仪器有限公司;LIOO S600T-电子显微镜,费尔伯恩精密仪器有限公司.
试剂:牛血清白蛋白,上海金穗生物科技有限公司;叶酸Sigma,湖北鑫润德化工有限公司;二环己基碳二亚胺( Acros)、N-羟基琥珀酰亚胺Sigma、胰蛋白酶、噻唑蓝(MTT)、三乙胺、二甲基亚砜(DMSO),天津博迪化工股份有限公司;人肝癌细胞(HEPG2)、人胃癌细胞(SGC7901),沈阳药科大学;磷酸盐缓冲液(PBS),自制.
2 方法
2.1 阿霉素白蛋白纳米粒(BSANPs-DOX)的制备
称量白蛋白100 mg和阿霉素1 mg加入1 mL水溶解,放入25 ℃的恒温磁力搅拌器中搅拌2 h,用NaHCO3碱溶液调节溶液的pH为8~9,使用恒流泵将4 mL体积分数为95 %的乙醇在8 min内缓慢加入溶液中,加入体积分数8 %的戊二醛溶液20 μL,在室温下进行交联固化反应,固化完毕后,继续搅拌12 h,调节离心机的转速为15 000 r/min,高速离心10 min,倾去上清液,得到白蛋白纳米粒悬液,超声匀化10 min,过0.22 μm的滤膜,即可得到纳米粒子[7].
2.2 叶酸活性酯的制备
准备0.5 mL的三乙胺,将其缓慢加入20 mL的二甲亚砜溶液中,静置一会使其冷却,在冷却好的二甲亚砜溶液中加入1 mg的叶酸粉末,用玻璃棒缓慢搅拌使其溶解,加入适量的二环己基碳二亚胺和N-羟基琥珀酰亚胺,在室温下使其充分反应12 h.过滤后减压浓缩成为干燥粉末状物质,用2倍体积的乙醚将剩余杂质析出,得到淡黄色粉末,该淡黄色粉末即为叶酸活性酯.
2.3 叶酸偶联阿霉素白蛋白纳米粒(FA-BSANPs/DOX)的制备
叶酸活性酯上的羧基可以与牛血清白蛋白表面的氨基酸残基上的氨基发生偶联反应.取适量阿霉素白蛋白纳米粒,用缓冲溶液调节pH至9,将之前制备好的黄色叶酸活性脂粉末溶解适量,加入混悬液中,搅拌均匀.用葡萄糖凝胶柱进行上柱分离,收集先流下来的白色光亮部分液体,即可得到叶酸偶联阿霉素白蛋白纳米粒(FA-BSANPs/DOX)混悬液[6].
2.4 叶酸偶联载阿霉素白蛋白纳米粒(FA-BSANPs/DOX)的性质
2.4.1 叶酸偶联量的测定
①叶酸活性酯标准曲线测定:精密称取定量的叶酸活性酯,用容量瓶定量配置成40 mg/L的溶液,并用容量瓶定量稀释质量浓度分别为40、20、10、8、2 mg/L.全波长分光光度计检测,绘制叶酸活性酯标准曲线.将FA-BSANPs/DOX用胰蛋白酶在37 ℃恒温磁力搅拌器内水解4 h,参照叶酸活性酯标准曲线计算不同牛血清白蛋白上偶联叶酸的量.②设置对照组,即未加胰蛋白酶水解的FA-BSANPs/DOX,其他条件均相同.用全波长分光光度计检测样品内叶酸的含量[8].
2.4.2 形态观察
取FA-BSANPs/DOX适量,用蒸馏水稀释后,滴于铜网上制样,用滤纸吸去多余的液体,自然晾干,于透射电镜下观察其形态.
2.4.3 粒径测定
取FA-BSANPs/DOX适量,用蒸馏水稀释成适宜的浓度,采用马尔文激光粒度仪测定粒径及粒径分布.
2.4.4 包封率和载药量的测定
采用超滤法对游离DOX和FA-BSANPs/DOX进行分离.精密吸取FA-BSANPs/DOX样品溶液0.15 mL于10 mL量瓶中,用蒸馏水稀释至刻度.取稀释后的样品溶液于超滤装置中进行超滤,收集续滤液.精密吸取稀释后的样品溶液和续滤液0.2 mL,利用柱前衍生化-高效液相色谱法分别测定游离药物质量(m游)和纳米粒总药物质量(m总).按照中国药典(2015版)固体脂质纳米粒包封率的计算公式计算包封率
包封率ER=(m总-m游)/m总×100 %.
载药量DL=(m总-m游)/mc×100 %.
式中:m总表示总药物质量;m游表示游离药物质量;mc为混合脂质质量.
2.5 体外释放
取20 mg游离DOX和FA-BSANPs/DOX置于经过预处理的透析袋中,加入5 mL PBS缓冲液(pH=7.4),用透析夹夹紧,置于盛有300 mL PBS的大烧杯中,模拟体内环境在水浴箱中恒速震动(37 ℃,20 r/min).分别于0.5、1、3、5、8、12、24 h吸去1 mL释放液,并及时补充等量恒温的PBS释放介质.用ELISA(酶联免疫吸附测定)法测定不同时刻样品上清液的光密度值,并根据前述标准曲线转换成DOX含量,计算每次取样时释放的DOX总量.上述步骤重复6次,取其平均值,制作DOX纳米粒体外释放曲线[8-9].
2.6 体外药效学研究
2.6.1 测试药品的样品配制
白蛋白纳米粒溶液(BSANPs):制备白蛋白纳米粒质量浓度为20 g/mL的空白材料溶液,用细胞培养液稀释至所需浓度,过0.22 μm滤膜.
阿霉素水溶液(DOX):配制盐酸阿霉素质量浓度为1 g/L的盐酸阿霉素溶液,用细胞培养液稀释至所需浓度,过0.22 μm滤膜.
叶酸偶联阿霉素白蛋白纳米粒(FA-BSANPs/DOX):制备质量浓度为4 g/L的FA-BSANPs/DOX溶液,并用细胞培养液稀释至所需浓度,过0.22 μm滤膜.
2.6.2 HEPG2细胞与SGC7901细胞的培养
配制含质量分数为10 %的胎牛血清、100 U/mL青霉素、质量分数为1 %非必需氨基酸的无菌DMEM培养基(培养箱:温度37 ℃,CO2体积分数为5 %,饱和湿度,次日更换培养液),将HEPG2细胞与SGC7901细胞置于其中进行培养.待培养液中的细胞覆盖率达80 %~90 %时,吸去原有培养基,用PBS将细胞表面的培养液洗净.取质量分数0.25 %胰蛋白酶消化单层培养的SGC7901(HepG2) 细胞,用质量分数为10 %的胎牛血清RPMI 1640培养液调整细胞数为2×104~4×104/mL的单细胞悬液,以每孔200 μL接种于96孔培养板中.将培养板放入CO2培养箱,在 37 ℃、体积分数为5 % CO2及饱和湿度条件下培养,等待细胞贴壁进行下一步实验.
2.6.3 FA-BSANPs/DOX与DOX对HEPG2细胞和SGC7901细胞体外抗肿瘤活性[10-11]
根据前期预实验,本次实验所选用药物的质量浓度梯度为33 mg/L、11 mg/L、3.6 mg/L、1.2 mg/L、0.4 mg/L.待培养细胞贴壁后,在96孔板中分别加质量浓度为33 mg/L、11 mg/L、3.6 mg/L、1.2 mg/L、0.4 mg/L的待测药物DOX、BSANPs、FA-BSANPs/DOX,每浓度6个孔,实验设空白对照组.将96孔板置于CO2培养箱,在37 ℃、体积分数为5 % CO2及饱和湿度条件下培养72 h.培养72 h后,孵育结束后取出96孔板,弃去培养液,每孔加入冷PBS 200 μL清洗,弃去PBS,每孔再加入MTT溶液(5 g/L 20 μL),37 ℃继续培养4 h,中止培养,离心弃去孔内上清液,每孔加入150 μL DMSO溶解甲臜沉淀,超声振荡10 min混匀.在MR700型酶联免疫检测仪上测定490 nm处各孔吸收度 (A) 值,计算各组相对细胞活度.按公式:抑制率=[1-(A实验组-A空白组)/(A对照组-A空白组)]×100 %.计算化合物抑制50 %细胞生成时的药物浓度,即IC50值,重复测试3次,取平均值为最终结果.
3 结 果
3.1 叶酸偶联量的测定
叶酸活性酯在281 nm处有最大吸收峰,如图1所示,其中1、2和3分别为叶酸活性酯标准品、胰蛋白酶水解的FA-BSANPs/DOX样品和未水解的FA-BSANPs/DOX样品.由图1可见:对照组样品3中无游离叶酸存在,从而证明了水解组样品中检测出的叶酸是已被白蛋白偶联的部分.
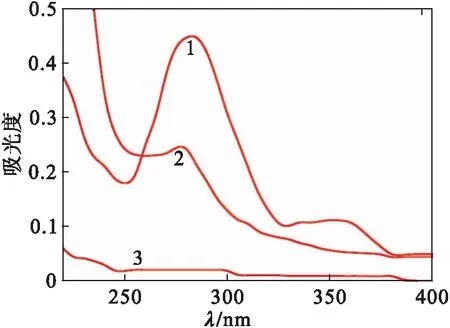
1 叶酸活性酯 2 胰酶水解的载阿霉素的叶酸-白蛋白纳米粒3 胰酶未水解的叶酸偶联阿霉素白蛋白纳米粒 图1 叶酸活性酯紫外光谱Fig.1 Ultraviolet spectrogram of floate active ester
3.2 叶酸偶联阿霉素白蛋白纳米粒(FA-BSANPs/DOX)形态观察
FA-BSANPs/DOX电镜图如图2所示.

图2 叶酸偶联载阿霉素白蛋白纳米粒的透射电镜图Fig.2 TEM image of FA-BSANPs/DOX
由图2可见:FA-BSANPs/DOX呈球形,粒度较为均匀,分散性好.
3.3 FA-BSANPs/DOX粒径分布、包封率及载药量的测定
采用马尔文粒度仪测定FA-BSANPs/DOX的粒径大小,平均为(137.43±0.67) nm,90 %的粒径小于139 nm,粒度分布较为均匀.采用柱前衍生化-高效液相色谱法测定其包封率为(89.43±0.67) %,载药量高达(19.03±0.32)%.
3.4 体外释放
FA-BSANPs/DOX累积释放曲线如图3所示.结果表明:0.5 h累积释放百分率仅为(10.10±2.98) %,3 h内累积释放(22.45±2.72) %,24 h 累积释放(26.71±1.38) %,说明与DOX粉剂相比,FA-BSANPs/DOX释放缓慢,并无明显突释现象.

图3 阿霉素粉剂和叶酸偶联载阿霉素白蛋白 纳米粒的体外释放曲线Fig.3 In vitro release of DOX and FA-BSANPs/ DOX microspheres
白蛋白纳米粒(BSANPS)、阿霉素(DOX)和叶酸偶联载阿霉素白蛋白纳米粒(FA-BSANPs/BOX)对人肝癌细胞HEPG2、胃癌细胞SGC7901的相对活度如图4、图5所示.结果表明:白蛋白纳米粒(BSANPs)对HEPG2和SGC7901基本无影响,叶酸偶联载阿霉素白蛋白纳米粒的相对活度低于阿霉素粉剂,FA-BSANPs/DOX和DOX对高表达的人肝癌细胞HEPG2细胞的IC50值分别为4.98 μmol/L和5.13 μmol/L,对人胃癌细胞SGC7901的IC50值分别为4.85 μmol/L和5.02 μmol/L,说明与粉剂相比FA-BSANPs/DOX的抗肿瘤活性略强[12-13].

图4 白蛋白纳米粒(BSANPs)、阿霉素(DOX)和叶酸 偶联载阿霉素白蛋白纳米粒FA-BSANPs/ DOX对人肝癌细胞HEPG2的相对活度Fig.4 The cell viability of BSANPs、 DOX and FA-BSANPs/DOX in HEPG2

图5 白蛋白纳米粒(BSANPs)、阿霉素(DOX)和叶酸 偶联载阿霉素白蛋白纳米粒(FA-BSANPs/ DOX)对人胃癌细胞SGC7901的相对活度Fig.5 The cell viability of BSANPs、 DOX and FA-BSANPs/DOX in SGC7901
4 结论与展望
以白蛋白为载体,利用叶酸酯结构中的羧基与白蛋白表面的活性氨基形成配位结合物的原理,简单、方便地制备出高载药量、高包封率的叶酸偶联阿霉素白蛋白纳米粒,载药量高达19.03且药物包封率较好.体外释放研究表明所制备的FA-BSANPs/DOX显著降低了DOX的释放速度,具有缓释性.体外药效学实验结果表明:与DOX粉剂相比,FA-BSANPs/DOX对HEPG2细胞和SGC7901细胞的抗肿瘤活性较强,其原因可能是通过配位作用将阿霉素与白蛋白螯合形成纳米粒后,可以促进FA-BSANPs/DOX的细胞摄取;偶联叶酸后,叶酸与肿瘤细胞表面叶酸受体有特异性亲和,从而增加了其对肿瘤细胞的靶向性,抑制了HEPG2细胞和SGC7901细胞的生长,有助于抗肿瘤效果的提高.由此可见,叶酸偶联载阿霉素白蛋白纳米粒具有较高的应用价值,对FA-BSANPs/DOX的体内抗肿瘤效果以及毒性的研究是后期研究的重点内容.

