一株鱼类水霉病原拮抗菌JL50分离鉴定及其拮抗特性分析
申 慧,魏冬梅,段魏魏,梁永增,王咏星
(新疆大学生命科学与技术学院,乌鲁木齐,830046)
0 引 言
【研究意义】水霉病是渔业生产活动中的常发疾病,发病范围广,一旦发病难以进行有效治疗,尤其在繁殖季节对鱼类孵化造成较大危害。2002年传统防治药物孔雀石绿被列为我国水产养殖业的禁用药,科研人员虽致力于开发新型安全的替代药物,但截止目前产业中尚无广谱、高效的水霉病防治药物[1]。【前人研究进展】近年来,研究人员在水霉病的生物防治研究中取得了一定的进展,贺凤[2]、雷翠霞[3]、刘俊[4]、宋增福[5]、Balcázar[6]等已筛选出对水霉生长有较强抑制效果的拮抗菌,并对其拮抗物质进行了初步的分离鉴定。然而,由于鱼类水霉病病原多样,不同地区病原菌优势种群不尽相同,因而其拮抗菌的应用具有一定的地域性限制。新疆由于其独特的气候和水域特点,是鱼类水霉病的高发区,水霉病原菌优势种也有别于其他地区[7]。【本研究切入点】由于鱼类水霉病病原多样,不同地区病原菌优势种群不尽相同,因而其拮抗菌的应用具有一定的地域性限制。新疆具有独特的气候和水域特点,研究分离获得对鱼类水霉病原菌有较强拮抗作用的拮抗菌,分析水霉拮抗菌的拮抗特性。【拟解决的关键问题】研究旨在以新疆本地分离纯化的高致病性水霉病原菌为指示菌,从健康鱼体表分离纯化筛选具有较强拮抗性的细菌,并进行鉴定和分析。为新疆鱼类水霉病的防治提供试验数据和理论依据。
1 材料与方法
1.1 材 料
1.1.1 水霉病原指示菌及供试菌
LF04菌株由实验室前期分离获得,并经鱼卵感染试验确定其为鱼类水霉病原菌(科赫法则),经形态学及18S rDNA序列分析,鉴定其属于水霉科,寄生水霉属;暂命名为SaprolegniaparasiticaLF04菌株;拮抗谱供试菌LF01、HL01、HL04、JY06、JY07、JY10、LY04、HZ、HZ04均由实验室前期分离获得,并经科赫法则验证均为致病菌,且形态差异明显[8]。
1.1.2 鱼苗
鲤鱼鱼苗用于拮抗菌安全性分析,共300尾,平均体长(2.5±0.3)cm;鲤鱼成鱼用于拮抗菌拮抗性分析,共120尾,平均体长(15±1.7)cm(均由新疆兵团水产技术推广站苗种场提供)。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基 (PDA);牛肉膏蛋白胨培养基;LB培养基。
1.2 方 法
1.2.1 拮抗菌株的分离与纯化
从健康鲤鱼的体表随机取下若干鳞片,置于锥形瓶中(无菌蒸馏水)摇床震荡1 h。梯度稀释菌溶液,将稀释倍数为2、10、20、50、100及1 000倍的菌液分别涂布于无菌牛肉膏蛋白胨培养基表面,37℃下培养24 h。分别选取典型单一菌落平板划线纯化,对所得菌株进行编号,4℃斜面保存,备用。
1.2.2 拮抗菌株的筛选
参照刘莉莉等[9]的方法进行拮抗菌的筛选。运用滤纸片对峙培养法,将初筛得到的菌株分别用水霉LF04为指示菌进行抑菌活性的复筛,在PDA培养基的中心放置一块直径6 mm左右的水霉琼脂块,水霉菌丝面紧贴PDA培养基表面。在距离水霉块25 mm处放置一片含有待测菌液的滤纸片。置于25℃恒温培养箱中倒置培养3 d,观察抑制效果;空白作为对照(无接种细菌)。根据抑菌谱的广度及抑菌圈大小,选择适宜菌株做进一步研究。
1.2.3 拮抗菌株的形态及生化鉴定
参照《常见细菌系统鉴定手册》[10]对拮抗菌株进行形态特征观察及生理生化等初步鉴定试验。包括革兰氏染色、水解及发酵相关等18项试验。
1.2.4 拮抗菌株的分子生物学鉴定
用Ezup柱式细菌DNA提取试剂盒提取拮抗菌的DNA。以DNA为模板,使用细菌16S rDNA通用引物7F和1 540 R[11-12],进行PCR扩增。PCR扩增反应体系为25 μL:10×PCR Buffer 2.5 μL,0.25 mmol/L dNTP 1 μL,5 U/μLTaqDNA 聚合酶(Takara)0.2 μL,10 μmol/L上下游引物各0.5 μL,50 mg/μL模板DNA 0.5 μL,加超纯水至总体积25 μL。PCR扩增程序:94℃ 4 min;94℃ 40 s,55℃ 1 min,72℃ 1 min,30个循环;72℃ 10 min,4℃保存。由上海生物工程有限公司检测扩增产物的DNA片段序列。测序结果经NCBI数据库进行Blast比对后,运用MEGA 7软件,N-J法建立系统发育树(自举值Bootstrap分析采用1 000次重复抽样)。
1.2.5 拮抗菌的安全性验证
试验前,将拮抗菌株接种到LB培养基中进行发酵培养并制备菌悬液。将购买的鱼苗置于鱼缸中适应性暂养2 d(25℃,充气)。鱼苗随机分成两组,每组设置3个重复,每个重复50尾鱼苗。第一组加入拮抗菌株发酵液,菌液终浓度为1×104cfu/mL;第二组为对照组,加入等体积的无菌LB液体培养基。试验期间水温控制在25℃左右,充气。连续6 d观察鱼苗的存活情况;及时捞出死鱼。
1.2.6 拮抗菌的拮抗性验证
选取体长约为15 cm的鲤鱼,在鱼样体表人工创伤大小相等的伤口(约面积0.5 cm2,深2~3 mm)。试验分成两组,均加入终浓度为103cell/mL水霉孢子悬液。第一组加入终浓度为1×104cfu/mL的拮抗菌悬液;第二组为对照,加入等体积的无菌LB液体培养基(每组设置三个重复,每个重复20条鲤鱼)。试验期间水温控制在25℃左右,充气。连续7 d观察鱼体的感染情况(体表发现菌丝判定为感染);及时捞出死鱼。
1.2.7 拮抗菌拮抗稳定性验证
将原代菌划线于新的牛肉膏蛋白胨培养基平板上,于37℃培养24 h后进行传代,共传10代。测定菌落边缘至平板边缘的距离(mm),观察拮抗菌的拮抗活性变化。
1.2.8 拮抗菌的抗菌谱测定
以实验室前期分离得到的10株水霉菌进行抗菌谱测定:将6 mm水霉菌琼脂块接种于无菌PDA培养基中央,活化后的拮抗菌株进行发酵培养,采用滤纸片法,在距离水霉琼脂块25 mm处,用移液枪吸取40 μL拮抗菌发酵液于灭菌滤纸片上,分别对10株上述活化处理的水霉病原菌株进行拮抗谱试验,于25℃恒温倒置培养72 h,观察拮抗效果;空白作为对照(无接种细菌)。拮抗范围测定所用指示菌均由实验室分离,经形态学及分子鉴定均为不同种属。
1.3 数据处理
使用SPSS 22软件One-way ANOVA法进行统计学分析,P<0.05为差异显著;使用GraphPad Prism 5软件作图。
2 结果与分析
2.1 拮抗菌初筛及纯化
从健康鲤体表获得鳞片的菌悬液中共获得50株细菌,经滤纸片平板对峙试验,发现其中1株细菌对水霉病原菌LF04菌株具有很强的抑制性,将此细菌菌株编号为JL50;对照组LF04菌株长满培养皿。图1
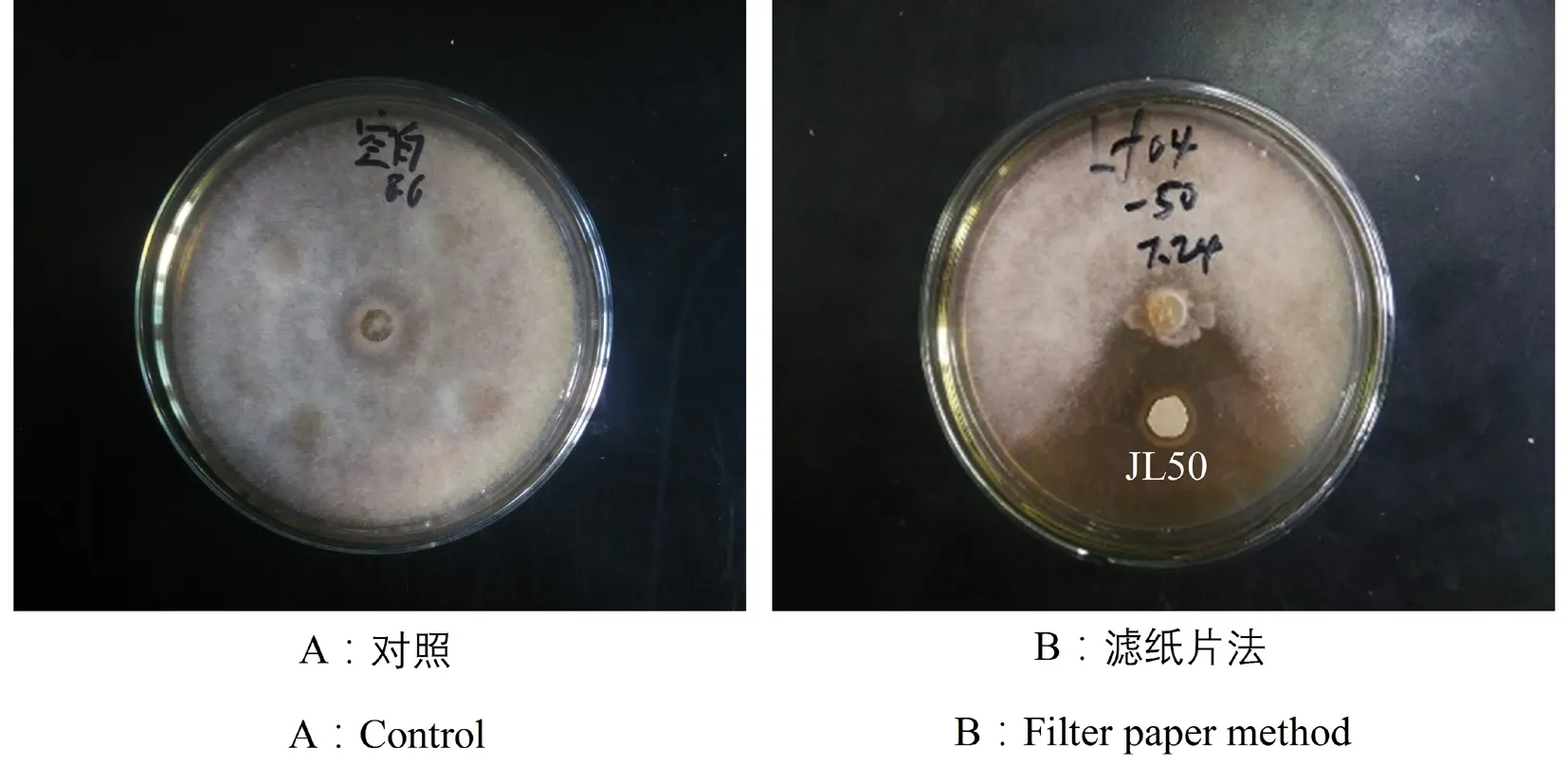
图1 拮抗菌JL50的拮抗效果
Fig.1 Antagonistic effect of antagonistic JL50
2.2 拮抗菌株的鉴定
2.2.1 JL50菌株形态观察
JL50菌株在牛肉膏蛋白胨培养基上培养24 h后,其菌落表面相对光滑、半透明;在油镜下观察其革兰氏染色为阳性,呈细短杆状。图2
2.2.2 JL50菌株生理生化特性
JL50菌株经生化实验观察为需氧型细菌,可利用乳糖、麦芽糖、蔗糖、葡萄糖发酵生长,油脂及淀粉水解试验结果为阴性,菌株部分生理生化特征见表1。对照细菌系统鉴定手册,初步鉴定该菌株为芽孢杆菌科,芽孢杆菌属,短小芽孢杆菌(Bacilluspumilus)。表1

图2 拮抗菌JL50革兰氏染色(×1 000)
Fig.2 Gram stain of antagonistic JL50(×1,000)
表1 拮抗菌JL50的生理生化性质
Table 1 Physiological and biochemical properties of antagonistic JL50
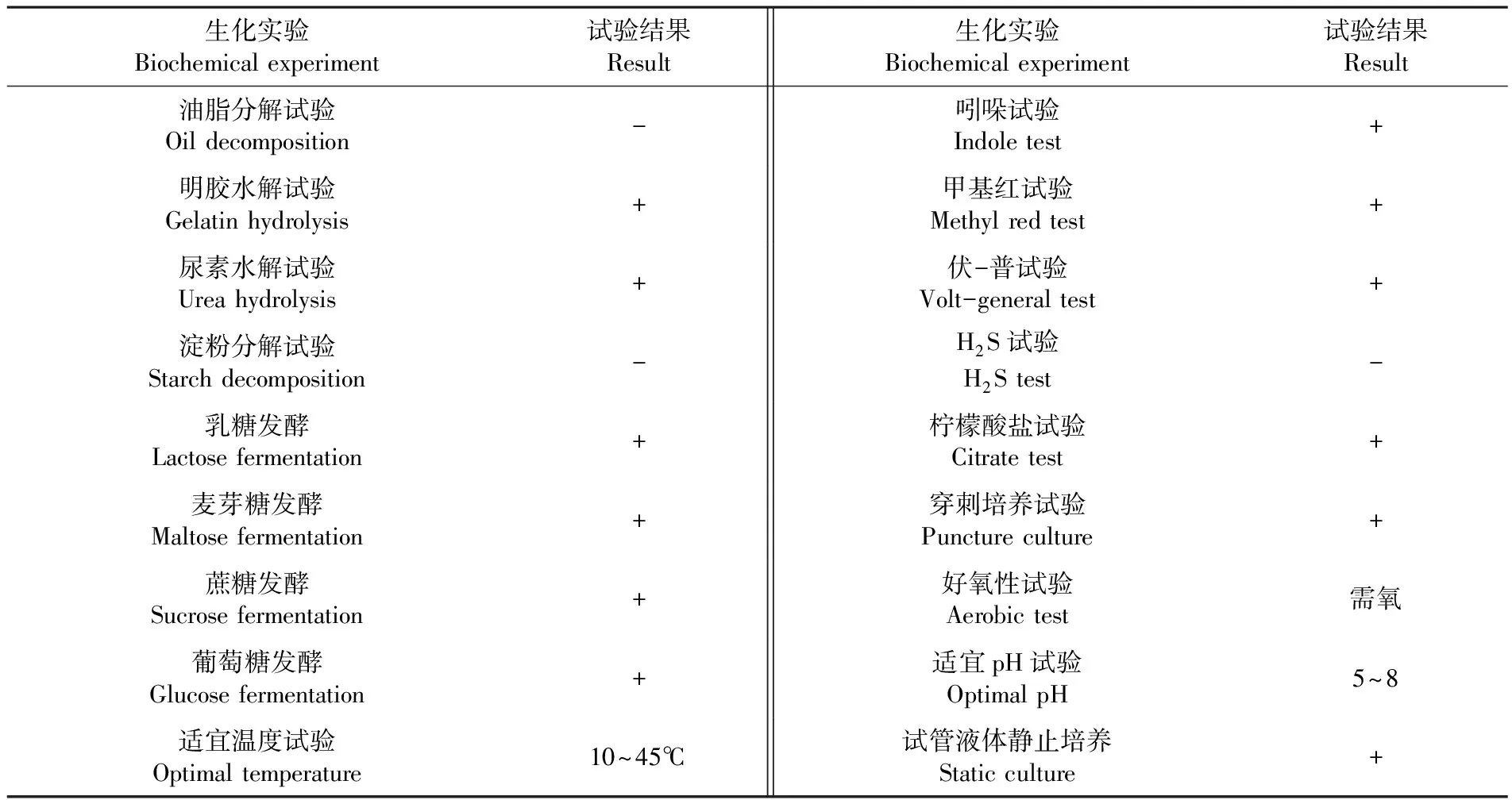
生化实验 Biochemical experiment试验结果 Result生化实验 Biochemical experiment试验结果 Result油脂分解试验Oil decomposition-吲哚试验 Indole test+明胶水解试验Gelatin hydrolysis+甲基红试验 Methyl red test+尿素水解试验Urea hydrolysis+伏-普试验 Volt-general test+淀粉分解试验Starch decomposition-H2S试验 H2S test-乳糖发酵Lactose fermentation+柠檬酸盐试验 Citrate test+麦芽糖发酵Maltose fermentation+穿刺培养试验 Puncture culture+蔗糖发酵Sucrose fermentation+好氧性试验 Aerobic test需氧葡萄糖发酵Glucose fermentation+适宜pH试验 Optimal pH5~8适宜温度试验 Optimal temperature10~45℃试管液体静止培养 Static culture+
注: “+”表示阳性,“-”表示阴性
Note: "+" is positive, and "-" is negative
2.2.3 JL50菌株基因同源性鉴定
根据测序结果可知,JL50菌株16S rDNA序列长度为1 455 bp,通过与NCBI中8模式菌株的16S rDNA 序列比对分析和系统发育树的构建, JL50菌株与短小芽孢杆菌Bacilluspumilusstrain ATCC 7 061 (GenBank 登录号NR 043242) 同源性最近,相似性为100%。综合菌株的培养特征、形态和生理生化特征及16S rDNA序列分析结果,判定该菌株为短小芽孢杆菌Bacilluspumilus。图3
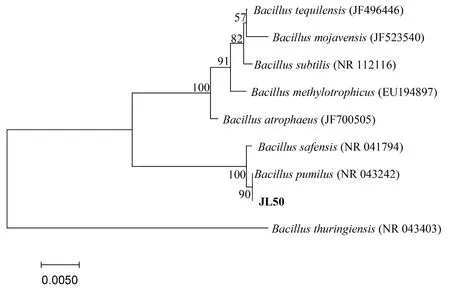
图3 邻接法构建JL50菌株 16S rDNA 序列系统发育树
Fig.3 Phylogenetic analysis of 16S rDNA sequences by neighbor-joining method
2.3 JL50菌株拮抗特性
2.3.1 JL50菌株对鱼苗的安全性
研究表明,随着试验的进行,实验组和对照组存活率均呈下降趋势。试验组与对照组鱼苗的存活率在第1 d和第2 d无显著差异(P>0.05),但随着试验天数的增加。试验6 d后,实验组存活率为73%,而对照组存活率仅为61%,差异显著(P<0.05)。图4

图4 鱼苗的存活率
Fig.4 The survival rate of the fry
2.3.2 JL50菌株拮抗活性
研究表明,试验第1 d,对照组与实验组均未出现水霉感染;试验第2 d,对照组和实验组开始出现水霉感染现象,对照组和实验组感染率分别为8.3%和1.7%;试验第4 d,对照组和实验组感染率分别为36.7%和13.3%;试验7 d时,实验组累积感染率为53.3%,对照组累积感染率为95%,实验组与对照组差异显著(P<0.05)。图5
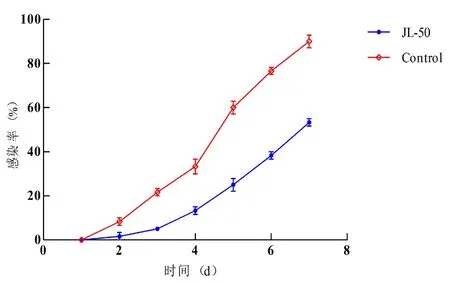
图5 鲤鱼7 d感染率
Fig.5 The 7 d infection rate of carp
2.3.3 JL50菌株拮抗稳定性
为了获得JL50菌株的拮抗稳定性,将JL50菌株进行传代培养,共传代10代。原代菌对水霉的抑制率为61.3%,经过10次传代以后,其抑制率为63.6%。JL50菌株在传代过程中,其拮抗活性比较稳定,无较大波动,拮抗活性在62%上下变动。图6
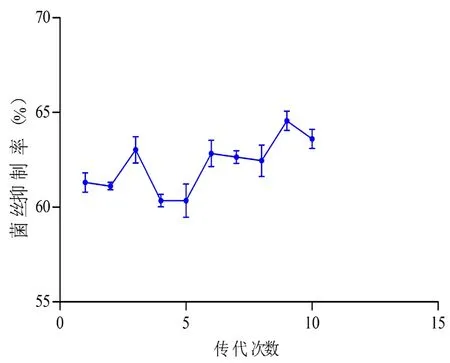
图6 传代次数与菌丝抑制率关系
Fig.6 Relationship between the number of passages and the inhibition rate of mycelium
2.3.4 JL50菌株拮抗范围
研究表明,拮抗菌JL50对水霉LF01和水霉LF04拮抗作用明显,其拮抗谱较窄,仅对特定的水霉病原菌有拮抗性。图7

注:供试水霉菌株编号:A:LF01 B:LF04 C:HL01 D:HL04 E:JY06 F:JY07 G:JY10 H:LY04 I:HZ J:HZ04 培养皿中心为供试水霉琼脂块,蘸有拮抗菌发酵液的滤纸片置于距琼脂块25 mm处
Note: the number of the tested Saprolegnia strains. A:LF01 B:LF04 C:HL01 D:HL04 E:JY06 F:JY07 G:JY10 H:LY04 I:HZ J:HZ04 The center of the culture dish is to test the Saprolegnia strains agar block, and the filter paper dipped in the fermentation liquid of antagonistic bacteria is placed at 25 mm away from the agar block
图7 JL50菌株抑制效果实验
Fig.7 The inhibitory effect of strain JL50
3 讨 论
水霉病是养殖业中危害较大的真菌性疾病之一,新疆由于其水域的特殊性,水温常年较低,有利于水霉菌的爆发与传播;且部分地区水质盐碱度较高,对于泼洒氯化钠等防治方法较耐受,故寻找更为有效的水霉病防治方法需求急迫[7]。利用生物间的拮抗作用,进行疾病防止已被广泛应用。其中利用拮抗菌对水霉菌进行的研究也有相关报道,Lategan等[13-14]发现中间气单孢菌(Aeromonasmedia)A199菌株可以用于治疗人工感染水霉的澳洲鳗鲡(AnguillaaustralisRichardon)及自发感染水霉的银锯鯻(Bidyanusbidyanus),并取得了一定效果;Kentaro Takada[15]发现链霉菌KS84中含有可以抗寄生水霉(Saprolegniaparasitica)的物质,并解析了其结构。张书俊等[16]发现从水霉病害水体中分离的黏质沙雷氏菌(Serratiamarcescens)能产生几丁质酶,其对水霉菌丝生长及孢子萌发具有明显的抑制作用;吕利群等[17]从养殖水体附近的土壤中分离得到的解淀粉芽孢杆菌(Bacillusamyloliquefaciens)Sh1菌株,能明显抑制水霉菌菌丝的生长,并验证了其活性成分非蛋白质且热稳定性好;刘莉莉等[9]从枯草芽孢杆菌(Bacillussubtilis)TCCC11201菌株的发酵液中分离的粗蛋白,对水霉病原菌具有很强抑制作用;赵春晖等[18]发现在功能性拮抗菌芽孢杆菌(Bacillusspp)TCCC11322菌株的培养上清液中,存在有明显抑制水霉生长的分泌性蛋白成分;陈飘等[19]从健康的养殖水体底泥中分离得到了链霉菌属(Streptomycetesp.)的3株拮抗放线菌,均能抑制对水霉菌丝的生长,且对抑制水霉生长具有协同作用。以上研究均证明,利用拮抗菌防治鱼类水霉病具有可能性。
短小芽孢杆菌对水产弧菌有一定拮抗作用[20-21],作为复合型益生菌中的一员在鱼类养殖中已经有广泛的应用[22],具有促进饲料利用效率[23],提高鱼类抗病力,减少鱼类疾病发生[24-26],改善养殖环境,调节养殖水质,维护微生态平衡[27]等特点,但国内尚未见短小芽孢杆菌对水霉病原菌拮抗的报道,试验结果不仅为鱼类水霉病的生物防治提供了依据,还为短小芽孢杆菌作为水产养殖的益生菌的作用进行了拓展,扩大了其应用范围;为益生菌可作为拮抗菌的应用探索提供了思路。
4 结 论
研究从健康鲤鱼体表分离得到1株对水霉病原菌有显著抑制作用的拮抗菌JL50,经鉴定该拮抗菌为短小芽孢杆菌,该菌株可显著抑制特定水霉病原菌的生长(P<0.05),并能显著提高鲤鱼苗的成活率(P<0.05),且该菌株传代稳定性好,对水霉病原菌的拮抗谱较窄,针对性较强。

