辣椒炭疽病基因紧密连锁的KASPar标记的开发
赵园园,刘议蔚,张正海,曹亚从,于海龙,张宝玺,高 杰,王立浩
(1.新疆农业大学林学与园艺学院,乌鲁木齐 830052; 2.中国农业科学院蔬菜花卉研究所,北京 100081)
0 引 言
【研究意义】辣椒(Capsicumspecies.)属于茄科(Solanaceae)辣椒属(Capsicum),起源于南美洲的秘鲁至中美洲墨西哥地区。辣椒易受到诸多病虫害侵害、如细菌性病害、真菌性病害、卵菌类病害、病毒病、根结线虫病[1]。辣椒炭疽病是一种真菌性病害。炭疽病原菌危害辣椒叶、茎及果实,引起落叶、茎枯及烂果,导致严重减产[2]。炭疽菌不仅为害辣椒,也是为害茄子、番茄等作物的主要病害之一。【前人研究进展】C.annuum是世界上种植最广泛的辣椒种,这个种中极度缺乏抗炭疽病的材料。而亚洲蔬菜研究发展中心AVRDC和韩国鉴定表明C.chinense和C.baccatum中存在高抗炭疽病的基因[3]。实际育种过程中,因C.chinense比C.baccatum与C.annuum的亲和力强,故通常用C.chinense和C.annuum种间杂交获得抗病自交系[4]。不同研究者对辣椒炭疽病遗传机制有不同的研究结果。Cheema等于1984年报道辣椒抗黑点炭疽菌(Colletotrichumcapacisi)是隐性遗传[5]。2009年,Mahasuk等证实col1、col2、col3 3个具有加性效应隐性基因控制辣椒黑点炭疽病的青熟果期、红熟果期、以及苗期的抗性[6]。研究表明,辣椒尖孢炭疽菌抗性基因是显性遗传,由两对互补的显性基因控制。构建含有381个分子标记的长度为1 310.2 cM的辣椒遗传连锁图谱[7],将辣椒抗炭疽病的主效基因被定位在了P5染色体上。【本研究切入点】目前,在辣椒炭疽病研究方面,对黑点炭疽菌的研究较多,而对尖孢炭疽菌的研究较少。选用抗炭疽病品种‘PBC932’。‘PBC932’已经被用于辣椒炭疽病抗性遗传规律研究,但不同研究者的研究结果有所不同。相比其它种类炭疽菌,国内分离得到的尖孢炭疽菌(Colletotrichumacutatum)具有更强的致病性与药剂耐受力[8],适用于辣椒炭疽病抗性研究。【拟解决的关键问题】通过对C.chinense‘PBC932’ 和C.annuum‘77013’种间杂交群体进行标记分析,构建遗传连锁图谱。结合辣椒果实炭疽病的表型鉴定结果,进行基因定位。研究与辣椒抗炭疽病主效基因紧密连锁的标记,为辣椒分子标记辅助育种打下基础。
1 材料与方法
1.1 材 料
抗炭疽病品种PBC932(Capsicum.chinenseJacq.)引种自AVRDC(亚洲蔬菜研究发展中心),该品种果实较小,未成熟果色黄绿色,成熟果色红色,长势中等,具有坐果能力强,对炭疽病抗性强的特点。高感炭疽病的中早熟材料77013(Capsicumannuum)由中国农业科学院蔬菜花卉研究所提供。该品种果实较大,未成熟果色绿色,成熟果色红色,具有坐果能力强,易感炭疽病的特点。选用PBC932为父本,77013为母本进行杂交获得F1代。由于F1花粉败育,以77013为父本进行连续回交再自交后获得BC4S1群体。
炭疽菌为尖孢炭疽菌(菌株Coll-153),由中国农业科学院蔬菜花卉研究所辣椒课题组于2009年从山西生产田采集的病果中分离得到。
1.2 方 法
1.2.1 病原菌接种
利用尖孢炭疽菌对PBC932、77013、F1、BC4S2-1、BC4S2-2群体进行抗性离体接种鉴定。辣椒在绿熟期时,果实和种子充分膨大,形态发育已经完成,果实颜色为暗绿色,果皮硬度增加,果重达到最大,果实品质较好。根据不同单株的生长状况、结果率,采收每一单株上的绿熟果(花后30~40 d)2~6个。在每一个果实上贴上标签,标明单株株号,用自来水进行冲洗,去掉果实表面杂物。将果实浸入70%的酒精中,30 s 后取出,杀灭细菌。果实表面自然晾干后,用微注射器(Hamilton PB600-1,Repeating Dispens/er, Reno, NV, USA)在果实表面刺穿1 mm的伤口,注射1 μL分生孢子悬浮液。每个果实接种2~6个点,接种点根据果实大小而定。在用酒精灭菌的塑料箱(50×25×20)(cm)中铺入4层滤纸,用蒸馏水(约80 mL)浸湿。把接种好的果实放于滤纸上,接种点朝上,果实间距2 cm。盖好盖子后,将塑料箱放于26℃的恒温条件下,使湿度保持在95%左右,避光培养7 d。
1.2.2 抗病性鉴定
平均病斑直径(O)为辣椒炭疽病表型鉴定标准,平均病斑直径(O)=Σ所有病斑直径的总和/接种点数。抗病性划分标准为:抗病(R):0 mm ≤ O ≤ 12mm;感病(S):O>12 mm[9]。
1.2.3 DNA提取
提取两个亲本PBC932、77013与F1的DNA,用作开发新的标记以及群体标记分型对照,提取BC4S1的DNA用于构建遗传连锁图谱。采取辣椒嫩叶,冷冻抽干后用于DNA提取。DNA提取方法参照CTAB法,并略有修改[10]。用微量分光光度计检测提取DNA的浓度和质量。
1.2.4 Kaspar 多态性标记的筛选
根据刘议蔚报道得到炭疽病抗性连锁图谱,选择2个Kaspar标记UN32931_776和UN27353_1781作为锚定位点[9]。利用抗病亲本PBC932(C.chinense)与感病亲本77013(C.annuum)全基因组重测序数据,对比已公布的辣椒基因组信息,找到双亲中存在的SNP位点。用Primer 5软件开发Kaspar标记[11]。
Kaspar 标记包含3条引物序列,Allele-1、Allele-2、Common。Allele-1、Allele-2为前引物,引物的最后一个碱基为存在差异的SNP位点。在两个前引物的前端各加上21 bp的公共接头序列:5’GAAGGTCGGAGTCAACGGATT3’为FAM荧光序列。5’GAAGGTGACCAAGTTCATGCT3’为HEX 荧光序列。
Kaspar 引物预混体系为,浓度10 M的位点特异性引物Allele-1、Allele-2各12 μL,共用引物30 μL,ddH2O 46 μL。预混体系总体积为100 μL。PCR扩增体系为5 ng/μL的DNA模板2 μL,2×Kaspar master mixture 2 μL,引物预混液0.055 μL。 PCR扩增程序:94℃条件下预扩增15 min; 94℃预变性20s,61℃ 1 min,每循环降低0.6℃,共9个循环;94℃ 20s, 55℃ 1 min, 26个循环;94℃ 20s,57℃ 1 min,9个循环。选用Roche 480荧光定量仪,以及384板ABI PCR仪,进行KASPar标记的基因型分析。
1.2.5 Kaspar 多态性标记的筛选
多态性标记分析BC4S1群体,将与抗病亲本一致的标记分型记位“a”,与感病亲本一致的分型记为“b”,与F1标记分型一致的记位“h”。统计结果用Joinmap4.0软件进行分析,构建遗传连锁图谱。
1.3 数据处理
利用Joinmap4.0软件[12]对BC4S1群体的KASPar标记分型数据进行分析,构建遗传连锁图谱。参数设置为LOD≥3,步长0.5,所用函数为Kosambi函数[13]。利用MapQTL6.0软件对数据进行进一步处理,分析与辣椒炭疽病绿熟期抗性基因连锁最紧密的标记,并以遗传连锁图谱上LOD值最高点为主效抗性基因QTL位点。
2 结果与分析
2.1 辣椒炭疽病性状的遗传规律
PBC932、77013、F1、BC4S1、BC4S2群体鉴定株数分别为6、6、6、170、130株。抗病亲本PBC932的平均病斑直径为5.59 mm,感病亲本77013的平均病斑直径为24.6 mm,F1的平均病斑直径为8.20 mm。抗病亲本PBC932及F1全部表现为抗病,77013全部表现为感病,抗病性表现为显性遗传。BC4S1与BC4S2群体的病斑直径分布直方图显示,病斑直径呈连续的分布。经K-S(Kolmogorov-Smirnov)检验,P值都为0.2>0.05,病斑直径分布符合正态分布规律。图1

图1 BC4S1群体与BC4S2群体的病斑直径分布
Fig. 1 Diameter distribution of BC4S1population and BC4S2population
BC4S1群体抗性鉴定发现,抗病单株数:感病单株数为85∶74,2检测值为0.478。BC4S1群体抗性鉴定发现,抗病单株数:感病单株数为63∶51,2检测值为0.045。两群体的2检验都符合孟德尔分离比9∶7,显示辣椒抗性由两对互补的显性基因控制。由于植株果实结果数目少,以及采后果实腐烂等,在BC4S1群体和BC4S2群体中有11和16株不能确定抗病性。表1
表1 BC4S1群体与BC4S2群体的表型病斑直径卡方检测
Table 1 Chi-square test results of phenotype lesions in BC4S1population and BC4S2population

2.2 筛选多态性标记
根据报道得到2个Kaspar标记。根据抗病亲本PBC932(Capsicum.chinense)与感病亲本77013(Capsicumannuum)的重测序结果,开发了106个Kaspar标记。将108个Kaspar标记在抗病亲本、感病亲本与F1之间筛选得到14个多态性的标记,多态性的比率是13%。在这14个标记中,标记UN32931_776与UN27353_1781已有定位报道。这两个标记可以作为锚定位点,通过锚定位点,得到的遗传连锁图可以与已经报道的遗传连锁图对应。表2
表2 14个Kaspar标记序列
Table 2 The sequences of 14 Kaspar markers

标记名称Number of marker引物序列Primer sequenceP5L-3Allele-1GAAGGTGACCAAGTTCATGCTAAGTCGATATATGGCTTATCCAllele-2GAAGGTCGGAGTCAACGGATTAAGTCGATATATGGCTTATCTCommonGCCAATGTGCATTTTCAP5L-117Allele-1GAAGGTGACCAAGTTCATGCTAAAAACCAGCAAGACCAGAAGAGAllele-2GAAGGTCGGAGTCAACGGATTAAAAACCAGCAAGACCAGAAGAACommonAGAAAGAACTCTATCATGGGAACAGP5L-175Allele-1GAAGGTGACCAAGTTCATGCTGTCAACCTTCCACACAGCAAAAllele-2GAAGGTCGGAGTCAACGGATTGTCAACCTTCCACACAGCAAGCommonATCCTTTGTGTTCTAACP5L-199Allele-1GAAGGTGACCAAGTTCATGCTGACCAGTCCAACCACCTCCACCGAllele-2GAAGGTCGGAGTCAACGGATTGACCAGTCCAACCACCTCCACCACommonGCCCGGGCCCATATCCATACGAATAP5L-204Allele-1GAAGGTGACCAAGTTCATGCTACTGTTCCAAGTTATCGATGTGTCCAllele-2GAAGGTCGGAGTCAACGGATTAACTGTTCCAAGTTATCGATGTGTCTCommonTGCTGAAAACCTCTGAGACATTGTGP5L-221Allele-1GAAGGTGACCAAGTTCATGCTGGCCAGATATTAAATCGCAAAAAllele-2GAAGGTCGGAGTCAACGGATTGGCCAGATATTAAATCGCAAAGCommonTTTGAGCTTAGAACTCCTCAAAACAP5L-224Allele-1GAAGGTGACCAAGTTCATGCTTTCCTAACAAAGGCGACTCGATATATATTTAAllele-2GAAGGTCGGAGTCAACGGATTTCCTAACAAAGGCGACTCGATATATATTTGCommonTGCAGAAACAAAGAAAGGTGGATGTP5L-249Allele-1GAAGGTGACCAAGTTCATGCTAGCTATGGATTCTGAGGAGGGTAAAAAAllele-2GAAGGTCGGAGTCAACGGATTAGCTATGGATTCTGAGGAGGGTAAAAGCommonTGCTCATGTTCAACCTCTGAATCAGAP5L-257Allele-1GAAGGTGACCAAGTTCATGCTAACCAGGGGTCGTTGACAAllele-2GAAGGTCGGAGTCAACGGATTAACCAGGGGTCGTTGACGCommonCCATCTGGCTTGTCACCACTAGP5L-295Allele-1GAAGGTGACCAAGTTCATGCTAAAGAACTTGGCAGCAGTCCATTCGAllele-2GAAGGTCGGAGTCAACGGATTAAAGAACTTGGCAGCAGTCCATTCACommonACAAGCTGCTTTCTATGGTATCATTGTGTP5L-541Allele-1GAAGGTGACCAAGTTCATGCTTTTGGCAGTTCACACATGTCACGTAAAllele-2GAAGGTCGGAGTCAACGGATTTTTGGCAGTTCACACATGTCACGTATCommonGCACCTACTATCAGATGCAAACGCG
续表2 14个Kaspar标记序列
Table 2 The sequences of 14 Kaspar markers

标记名称Number of marker引物序列Primer sequenceP5L-866Allele-1GAAGGTGACCAAGTTCATGCTATGACTTCTGGAGAACATTTAGCATTCATTTAllele-2GAAGGTCGGAGTCAACGGATTTGACTTCTGGAGAACATTTAGCATTCATTCCommonGCTGCTAGCATGAAACTGGTTATGCUN27353_1781[]Allele-1GAAGGTGACCAAGTTCATGCTCTCGGTTCTTCCATCCAAGATAAAGCGTAllele-2GAAGGTCGGAGTCAACGGATTTCGGTTCTTCCATCCAAGATAAAGCGCCommonTCACCGGCGTGTTGAAAGACTTCAGUN32931_776 A1[]Allele-1GAAGGTGACCAAGTTCATGCTAACAGCCTGCTTGGTGATTTYTCCAACCAllele-2GAAGGTCGGAGTCAACGGATTCAACAGCCTGCTTGGTGATTTYTCCAACTCommonGCAAGGTCATCTTTTCGCACGAACG
2.3 遗传连锁图的构建标记开发
利用获得多态性的14个标记检测BC4S1的170个单株,构建遗传连锁图谱。根据表型数据,利用MapQTL6.0软件进行QTL分析,将辣椒抗炭疽病主效基因AnRGO5定位在标记P5L-866与标记P5L-259之间,遗传距离2.9 cM。其中P5L-117 与基因连锁最为紧密。图2

图2 BC4S1群体的遗传连锁
Fig. 2 Linkage map in BC4S1population
2.4 分子标记准确度的验证及应用
利用P5L-117标记对BC4S2群体130株进行筛选,共得到标记型为抗病的单株34株。34株单株的表型鉴定结果显示,26株抗病,标记的准确度为93.5%。图 3
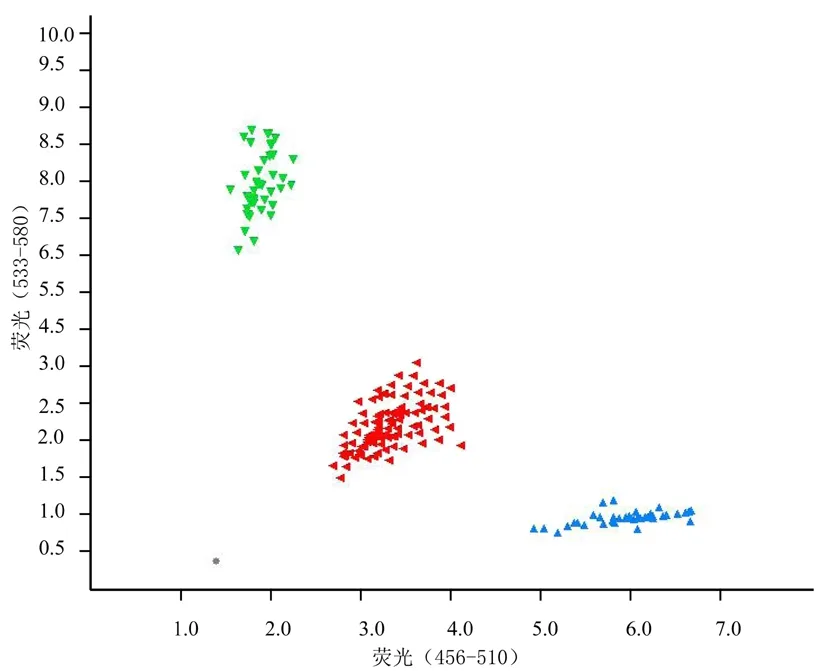
注:绿三角为抗病亲本分型,红三角为F1分型,蓝三角为感病亲本分型,褐色点为水
Note: The green triangle is the type of disease-resistant parent, the red triangle is F1, the blue triangle is the susceptible parent, and the brown point is water
图3 标记(P5L-117)在BC4S2群体中分型
Fig. 3 Classification of the marker (P5L-117) in the BC4S2population
3 讨 论
研究表明,辣椒炭疽病基因是由显性基因控制的。2008年,Kim等对黑点炭疽病的研究结果表明,"AR"(一个来源于品种PBC932的炭疽病抗病株系)对炭疽病的抗性是由单隐性基因控制的[14]。研究表明,辣椒炭疽病基因是由显性基因控制的,这一结果与Kim研究结果不同。试验用菌为尖孢炭疽菌,而Kim试验用菌为黑点炭疽菌,推测辣椒对不同种类的炭疽菌有不同的抗病机制。Lee研究了抗病品种‘PBC81’对尖孢炭疽菌和黑点炭疽菌的抗性遗传,结果显示,二者的主效数量性状位点(QTL)在不同位置[15]。辣椒炭疽病抗病机制较为复杂。研究表明,辣椒炭疽病抗性基因是由两对互补的显性基因控制的,这与Lin对辣椒材料0038-9155的抗病机制研究结果一致。
2016年,Mahasuk通过种间杂交群体 C.annuum‘Bangchang’ × C.chinense ‘PBC932’构建了一个遗传连锁图。此遗传连速图包含12个连锁群,214个SNP标记,图谱总长842 cM。根据绿果期的抗性鉴定结果,在LG2连锁群上定位了2个QTL位点[16]。而研究结果将辣椒炭疽病抗性基因定位在了5号染色体上,定位结果与Mahasuk研究结果不同,这可能是由于试验材料、致病菌种类、试验方法的不同引起的。
目前,与辣椒炭疽病基因连锁的分子标记已有报道,但数目不多。试验获得的标记P5L-117与辣椒抗尖孢炭疽菌基因紧密连锁,可用于分子标记辅助育种。Kaspar标记具有成本低、灵敏度高、DNA用量少等特点,有助于加快抗炭疽病育种进程。
4 结 论
4.1 在抗炭疽病品种PBC932(C.chinense)与感炭疽病品种77013(C.annuum)的杂交群体中,辣椒炭疽病病状为数量性状。辣椒对尖孢炭疽菌的抗性由两对互补的显性基因控制,受微效多基因以及环境因素的影响。
4.2 在BC4S1群体中,将辣椒抗炭疽病主效基因AnRGO5定位在标记P5L-866与标记P5L-259之间,与AnRGO5连锁最紧密的标记为P5L-117,遗传距离2.9 cM。用P5L-117标记对在BC4S2群体的抗病植株进行检测,标记准确率93.5%。

