基于D-101大孔吸附树脂分离纯化新疆石榴皮中的总黄酮
孟新涛,魏 健,张 婷,李德华,谭 归,朱丽娜,邵文志,潘 俨
(1.新疆农业科学院农产品贮藏加工研究所, 乌鲁木齐 830091;2.新疆主要农副产品精深加工工程技术研究中心,乌鲁木齐 830091;3.喀什大学生命与地理科学学院,新疆喀什 844006;4.食品科学与药学学院,新疆农业大学,乌鲁木齐 830052)
0 引 言
【研究意义】石榴(PunicagranatumL.)是新疆特色水果之一,属石榴科(Punicaceae)石榴属(PunicaL.)植物,具有极高的营养价值及医用保健功能,富含维生素、微量元素、氨基酸及蛋白质等物质[1-2],其中VC含量高达11 mg/100g;石榴同时具有良好的抗氧化、调节血脂、消食化积、预防动脉粥样硬化和癌症等功效[3-5]。黄酮类化合物是石榴果实中具有医疗保健作用的主要成分,然而石榴可食部分只占鲜石榴的40%,而皮占其总重超过30%[2-3],对石榴果皮中副产物开发再利用,具有重大的现实意义。【前人研究进展】目前关于黄酮类化合物的提取方法较多[6-8],常用方法主要有硅胶柱色谱法、气相层析法、高效液相色谱法、微孔薄层色谱法和聚酰胺层析法等[9-13],这些方法都存在一些分离纯化效果不佳、成本高及环境污染严重等问题,因此,选择一种分离纯化效果好、成本低及环境污染小的纯化黄酮类化合物方法亟待解决。大孔吸附树脂在黄酮类化合物的纯化中被广泛应用[14-16]。根据分子结构大孔吸附树脂可分为非极性、中等极性和极性三种,分离纯化物可根据自身极性大小,选择与之相适应的树脂结构,已达到较佳分离纯化的目的。大孔吸附树脂法纯化黄酮类化合物,主要通过对黄酮类化合物有选择性吸附作用的大孔吸附树脂,将水溶液中的黄酮类化合物与其它物质分离而达到纯化。【本研究切入点】前期提取石榴皮中总黄酮时发现,石榴皮提取液中总黄酮提取得率随着乙醇浓度和提取温度的增加反而降低,根据“相似相溶”原理,石榴皮中可能存在的黄酮类化合物极性较大的结论[3],故石榴皮中黄酮类物质生成氢键的能力较强,有利于非极性大孔树脂分离纯化,选择D-101型大孔吸附树脂,并优化其对新疆石榴皮总黄酮的工艺条件,为生产中更加有效充分的利用石榴附产物,提供依据。
1 材料与方法
1 .1 材 料
1.1.1 石榴
新疆石榴,购买于乌鲁木齐南昌路北园春市场;槲皮素(纯度≥98%),北京世纪奥科生物技术有限公司;乙醇、石油醚,天津市致远化学试剂有限公司,分析纯。D101大孔树脂,上海蓝季生物。
1.1.2 仪器与设备
UV 260紫外-可见分光光度计日本岛津公司;旋转蒸发仪,上海亚荣旋转蒸发;德国eppendorf;IKA®A 11基本型研磨机,广州仪科实验室技术有限公司;pHS-3C 型酸度计,上海雷磁仪器厂;THZ-82 恒温振荡器,常州国华电器有限公司; SK720H型超声波清洗器,上海科导超声仪器有限公司。
1.2 方 法
1.2.1 石榴皮中总黄酮检测
石榴皮中总黄酮的测定采用槲皮素作为对照品的紫外分光光度计法。
1.2.2 标准曲线绘制
将槲皮素标准品在95℃干燥箱中干燥至恒重,精密称取2.0 mg,用30%乙醇溶解,定容至50 mL容量瓶中,得浓度为0.04 g/L的槲皮素标准品溶液。取槲皮素对照品溶液1.0 、1.5、2.0、2.5、3.0和3.5 mL,分别对应浓度为0.004、0.006、0.008、0.01、0.012和0.014 g/L。30%乙醇定容至于10 mL容量瓶中,在372 nm处,利用紫外分光光度计法测定槲皮素浓度(C)与吸光度(A)之间的关系。分析得:A=0.057 97C+0.028 26R2=0.998 5。
1.2.3 石榴皮中总黄酮的提取及含量测定
利用随机质心映射优化法(RCO)经过两轮循环[3]后得出超声波法提取石榴皮中黄酮类物质较佳工艺:乙醇浓度为87%、超声时间为37 min、提取温度为59℃、料液比为1∶24 (g/mL)。得出新疆石榴皮中总黄酮的提取得率为7.25%。
1.2.4 D-101大孔树脂的预处理
按照文献[17]稍作修改,将D-101大孔树脂中的破碎树脂剔除,用蒸馏水浸泡,搅拌使其破碎树脂及杂物漂浮,洗去杂物。95%乙醇浸泡48 h使其溶胀,期间充分搅拌赶出气泡,再用蒸馏水洗至无醇味。用4% HCl溶液浸泡树脂2 h,抽滤,而后用去离子水以同样流速洗至出水pH值为中性;再用4%NaOH溶液浸泡树脂2 h,抽滤,用去离子水以同样流速洗至出水pH值中性晾干,备用。
1.2.5 D-101大孔吸附树脂静态吸附实验1.2.5.1 D-101大孔吸附树脂静态吸附率测定
将预处理好的树脂抽滤自然晾干,准确称取2.00 g干树脂,装入100 mL具塞锥形瓶中,精确加黄酮溶液10.00 mL(浓度为7.587 mg/g),摇匀后恒温振荡24 h(温度30℃,转速为150 r/min),抽滤。取滤液测定黄酮类化合物的含量,计算吸附量和吸附率。吸附量和吸附率计算公式如下:

吸附量(mg/g湿树脂)
式中:C0—吸附前黄酮溶液浓度(mg/g);C1—吸附后溶液中剩余黄酮溶液浓度(mg/g);W—树脂质量(g);V—吸附液体积(mL)。
1.2.5.2 D-101大孔吸附树脂静态解析率
将吸附饱和树脂,置于100 mL具塞锥形瓶中,精确加入20 mL 95%乙醇,恒温振荡24 h后过滤,测定滤液中黄酮类物质的含量。按照下式计算解析率。

C0—吸附前黄酮化合物溶液浓度(mg/g);C1—吸附后溶液中剩余黄酮化合物溶液(mg/g);C2—解析后溶液中剩余黄酮化合物溶液(mg/g)。
1.2.5.3 pH值对D-101大孔吸附树脂吸附能力的影响
准确称取5 g D-101大孔吸附树脂,分别加入20.00 mL黄酮类化合物溶液,用pH计分别调节溶液pH值为3、4、5、5.53,30℃摇振24 h,测定树脂静态吸附量,分析不同pH值对黄酮类化合物的影响。
1.2.5.4 料液比对D-101大孔吸附树脂吸附能力的影响
称取处理过的干树脂2.00 g,装入6只100 mL具塞锥形瓶中,按吸附料液比为1∶2,1∶4,1∶6,1∶8,1∶10,1∶15,1:20(黄酮类物质溶液:大孔吸附树脂,mg/L)依次加入黄酮类物质(pH值为试验验证最佳值),恒温振荡(30℃,转速为150 r/min)24 h,过滤,测出滤液中黄酮类物质的含量,计算吸附率,比较得到最佳料液比。
1.2.5.5 温度对D-101大孔吸附树脂吸附能力的影响
取2 g/L的黄酮标准溶液各100 mL,加入5 g已预处理好的湿树脂,控制温度为25、30、35、40、45和50℃,静态吸附(摇床振荡)10 h,测定树脂静态吸附量,分析温度对黄酮溶液的影响。
1.2.5.6 D-101大孔吸附树脂静态吸附动力学
准确称取6.00 g D-101大孔吸附树脂,加入黄酮溶液(质量浓度为7.587 33 mg/g)20.00 mL,摇匀后静置,每1 h取上清液测定吸光值,连续取样12 h,计算剩余溶液的浓度。以取样时间点为横坐标,吸附量为纵坐标,作D-101大孔吸附树脂静态吸附动力学曲线。
1.2.6 D-101大孔吸附树脂动态吸附和洗脱
先将一块玻璃棉装入内径13 mm、高300 mm的玻璃层析柱底端,以防止柱子堵塞;准确称取预处理后备用树脂6.00 g,将树脂缓缓加入柱子,边装柱边用洗耳球敲打柱壁,以使大孔树脂压紧挤出气泡。加入10 mL黄酮化合物溶液(7.587 mg/g),进行动态吸附实验。
在室温条件下,取已经吸附平衡的树脂装填于玻璃层析柱中进行洗脱实验,以每5 mL为单位收集流出液,绘制洗脱曲线,分析不同浓度洗脱液和不同洗脱流速对黄酮类物质脱附的影响,确定最佳洗脱条件。
1.2.7 正交试验
D101大孔吸附树脂纯化石榴皮总黄酮优化设计在考察单因素试验基础上,选择影响大孔树脂纯化总黄酮的几个主要因素:温度、洗脱液体积、pH值、料液比。表1
表1 D101大孔树脂纯化石榴皮黄酮工艺正交试验因素及水平
Table 1 Factors and levels of orthogonal test for purification of pomegranate bark from patrinia with macroporous resin
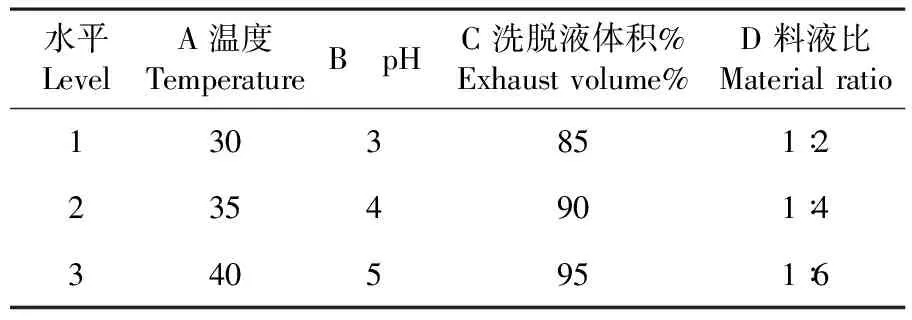
水平LevelA温度TemperatureB pHC 洗脱液体积%Exhaust volume%D 料液比Material ratio1303851∶22354901∶43405951∶6
1.3 数据处理
用Excel 2003处理试验数据,Origin 8.0作图。
2 结果与分析
2.1 D-101大孔吸附树脂静态吸附影响因素
2.1.1 pH值对D-101大孔吸附树脂吸附能力
研究表明,pH值D-101大孔吸附树脂吸附能力的影响较大,样液pH为3~4时,树脂对石榴皮中黄酮的吸附容量达到较大值,吸附量为25.74 mg/g。可能是由于黄酮类化合物在pH为3~4时,分子结构中的轻基酚多以分子状态存在,根据范德华力的作用,黄酮类物质与树脂发生物理吸附,达到较高的吸附效果,随着pH值升高,酸性条件减弱,黄酮类物质以离子的形状态存在,与吸附树脂不能较好结合。但当pH为2时,吸附量为19.02 mg/g,吸附率较低,是因为黄酮分子结构中的酚轻基生成烽盐而导致其溶解[17-18],在强酸催化下发生水解所致,所以选择pH值为3~4为宜。图1
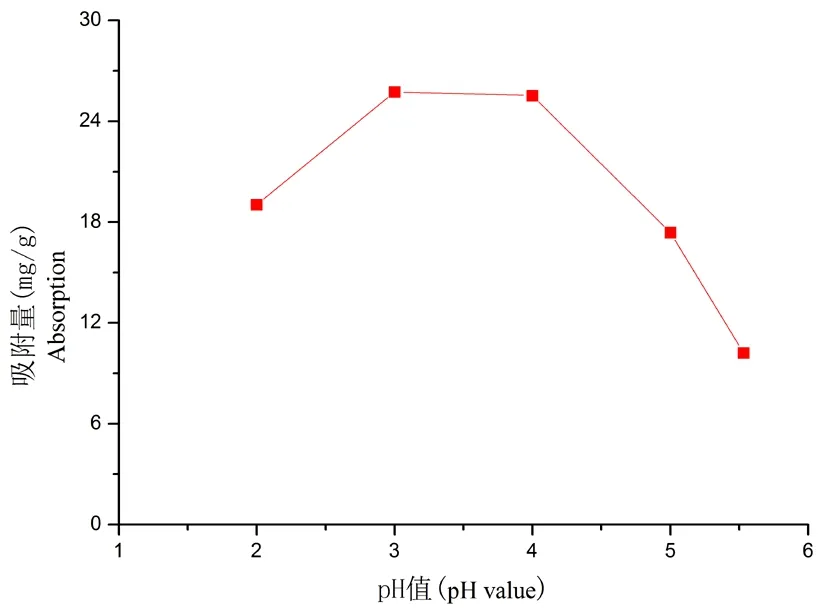
图1 不同pH下D-101大孔吸附树脂吸附能力变化
Fig.1 Effect of pH of sample solution on adsorption ratio of D-101 macroporous adsorption resin
2.1.2 料液比对D-101大孔吸附树脂吸附能力的影响
研究表明,D-101大孔吸附树脂对石榴皮中黄酮的吸附能力随料液比的增加呈先增后降的趋势。料液比(树脂:黄酮溶液体积(g:mL))在1∶2到1∶4,随料液比的增加,吸附能力增大;料液比在1∶4到1∶15,随料液比的增加,吸附能力降低。可能是当黄酮浓度过大时,大孔吸附树脂的选择性降低,而黄酮溶液浓度较低时,吸附不够完全所致。D-101大孔吸附树脂对石榴皮中黄酮含量的吸附最大容量为1∶4。 图2

图2 不同料液比下D-101大孔吸附树脂吸附能力变化
Fig.2 Effect of sample solution volume/D-101 resin weight ratio adsorption ratio of D-101 macroporous adsorption resin
2.1.3 温度对D-101大孔吸附树脂吸附能力的影响
研究表明,当温度为30℃时,吸附率较高,随着温度的升高,吸附量下降,这是由于温度升高,打破了吸附平衡。图3

图3 不同温度下D-101大孔吸附树脂吸附能力变化
Fig.3 Effect of temperature of sample solution on adsorption ratio of D-101 macroporous adsorption resin
2.1.4 D-101大孔吸附树脂静态吸附动力学
研究表明,D-101大孔吸附树脂对石榴皮中黄酮溶液的静态吸附平衡时间较慢,在1~6 h取样测定时,吸附量基本保持不变,后续吸附量开始迅速增大,到10 h之后吸附量逐渐接近平衡。图4

图4 D-101大孔吸附树脂静态吸附动力学曲线
Fig.4 Static adsorption curve of D-101 macroporous adsorption resin towards total flavonoids from citrus peel
2.2 动态吸附和洗脱
2.2.1 动态吸附过程考察D101型树脂对黄酮溶液的吸附穿透曲线
在室温下,称取5 g预处理好的树脂,湿法装柱,上样液pH值为4,黄酮溶液浓度为0.03 mg/mL,控制0.25 mL/min的流速,测定层析柱的穿透曲线。当黄酮溶液的上柱体积为160 mL时,检测到流出液浓度达到0.03 mg/mL,此时达到饱和。图5
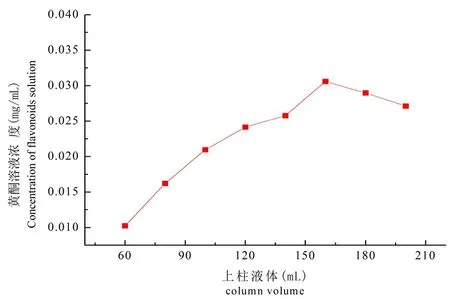
图5 穿透曲线
Fig.5 Breakthrough curve
2.2.2 最佳洗脱液体积分数的确定
根据前期试验可知[3],当乙醇浓度为87.9%时,黄酮类化合物的提取率较高,在乙醇-水溶剂中溶解性较高,另外D101大孔吸附树脂是弱极性,所以选择乙醇-水作为洗脱液。利用上述上样液的最佳pH、料液比、温度条件,依次用体积分数为20%、30%、50%、60%、80%、90%和95%的乙醇溶液各30 mL在相同的流速下进行等度洗脱,收集洗脱液测定含量,绘制曲线。
乙醇溶液体积分数较高时对树脂的解吸附效果最好。乙醇体积分数过低时对树脂的解吸附效果不太理想,这是因为D101大孔吸附树脂是弱极性,低浓度乙醇极性较大,根据相似相容原理,选择极性较小的洗脱液效果较好,90%和95%的乙醇溶液洗脱效果相差不大,从节约环保角度考虑,选择90%乙醇溶液作为洗脱液。图6
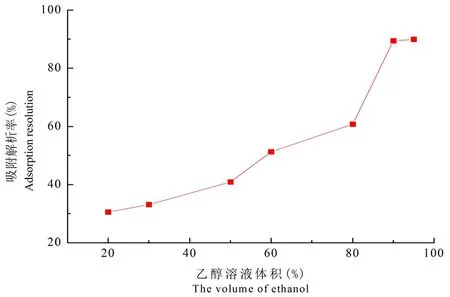
图6 不同洗脱液体积下大孔树脂解吸附率变化
Fig.6 Effect of Elution volume on desorption ratio of D101 macroporous adsorption resin
表2 正交试验结果
Table 2 The result of orthogonal test

试验号 NumberA温度Temperature(℃)B pHC洗脱液体Exhaust volume(%)D料液比Material ratio(g:mL)纯化率Purification rate(%)1303801:216.32304901:417.933051001:612.64353901:614.453541001:213.96355801:412.574031001:414.28404801:613.19405901:28.9K115.60014.96713.96713.033K213.60014.96713.73314.867K312.06711.33313.56713.367R3.5333.6340.4001.834
2.3 D101大孔树脂纯化石榴皮总黄酮正交试验
试验因素的影响大小为:pH(B)>温度(A)>料液比/%(D)>洗脱液体积(C),最优工艺为:B2A1D2C2,即提取液pH为4、温度30℃、料液比1∶4(g/mL)、洗脱液乙醇体积为90%。表2
2.4 验证试验
按照上述较佳纯化工艺:提取液pH为4、温度30℃、料液比1∶4(g/mL)、洗脱液乙醇体积为90%,对石榴皮中黄酮类物质进行纯化,计算纯度。D101大孔吸附树脂纯化后石榴皮黄酮含量由7.25 mg/g提高到17.32 mg/g,较纯化前提高2倍。表3
表3 D101大孔吸附树脂纯化前后石榴皮中黄酮提取率比较
Table 3 Before and after comparison of flavonoid extraction rate in the peel of purified Pomegranate by D101 macroporous resin
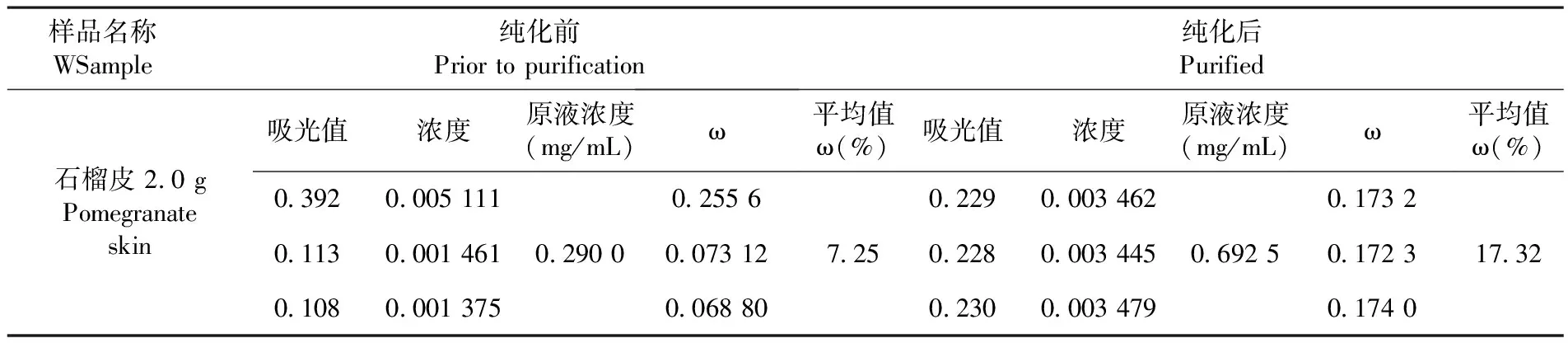
样品名称WSample纯化前 Prior to purification纯化后Purified石榴皮 2.0 gPomegranate skin吸光值浓度0.3920.005 1110.1130.001 4610.1080.001 375原液浓度(mg/mL)0.290 0ω0.255 60.073 120.068 80平均值ω(%)7.25吸光值浓度0.2290.003 4620.2280.003 4450.2300.003 479原液浓度(mg/mL)0.692 5ω0.173 20.172 30.174 0平均值ω(%)17.32
*标准曲线:A=0.057 97C+0.028 26,R2=0.998 5;*ω(%)=(C×V×D/W)×100,式中C为样品溶液质量浓度(mg/mL);V为所测样品溶液总体积(mL);D为所测样品溶液稀释倍数;W为样品质量(g)
Standard curve:A=0.057 97C+0.028 26,R2=0.998 5 ω(%)=(C×V×D/W)×100,Cis the mass concentration of the sample solution(mg/mL);Vis the total volume of the sample solution measured(mL);Dis the dilution multiple of the sample solution measured;Wis the sample quality(g)
3 讨 论
应用大孔吸附树脂分离纯化有效成分在中药产品研究和产业化生产等领域具有十分广阔的前景,与其他纯化方法相比较,在富集有效成分、减少杂质方面显示出其优越性[17]。树脂的吸附能力由树脂孔径、比表面积、表面电性或形成氢键等综合性能决定,一般情况下,非极性吸附树脂适合从极性溶液吸附非极性物质,反之亦然。团队在前期提取石榴皮中总黄酮时发现,石榴皮提取液中总黄酮提取得率随着乙醇浓度和提取温度的增加反而降低,根据"相似相溶"原理,得出石榴皮中可能存在的黄酮类化合物极性较大的结论[3],故石榴皮中黄酮类物质生成氢键的能力较强,有利于非极性大孔树脂分离纯化,因此,研究选择D-101型大孔吸附树脂。实验对D-101大孔吸附树脂的静态吸附与pH、吸附料液比、温度的关系进行了考察,样液pH为3~4时,吸附料液比为1∶4(g/mL),温度30℃时树脂对石榴皮中黄酮的吸附容量达到较大值,与吴斌[17]等采用柱层析方法分离纯化籽瓜中L-瓜氨酸的研究结果不一致,这可能与分离纯化的样品不同有关。研究针对于单因素试验结果,对D101大孔树脂纯化石榴皮总黄酮设计正交试验验证,得出试验因素的影响大小为:pH>温度>料液比/%>洗脱液体积,这可能是由于黄酮类化合物的分子结构比较特殊,轻基酚在不同的pH下,以分子状态或烽盐存在,故pH的影响较大[18-19]。
石榴皮作为石榴副产物,在石榴产品加工中石榴皮大部分被丢弃,没有使石榴附产物得到很好的再利用,造成新疆石榴资源的严重浪费[2]。因此,研究新疆石榴皮黄酮分离纯化方法,为新疆石榴综合利用的品种筛选、原料检测分级、深加工和功能食品的研发等提供理论依据。
4 结 论
通过对D101大孔吸附树脂的研究,采用静态和动态吸附-解析两种方法,确定最佳分离纯化石榴皮中黄酮类物质的条件为温度30℃、吸附料液比1∶4(g/mL)、pH为4、洗脱液体积为90%,在此条件下,黄酮类物质的吸附量较大,洗脱集中,洗脱液用量较少。在此工艺下,石榴皮提取物黄酮类化合物含量由7.25 mg/g增加到17.32 mg/g。该工艺简单可行,可用于石榴皮中黄酮类化合物的分离纯化。

