下调NDUFA4对人结直肠癌SW480细胞体外生长的影响
刘士明,丁 涛,雷良玉,胡 琳,冒 灵,陈 超,郭萌萌,徐 林
(贵州省基因检测与治疗特色重点实验室暨贵州省生物治疗人才基地暨遵义医科大学 免疫学教研室,贵州 遵义 563099)
结直肠癌是最常见的原发性恶性肿瘤之一,近年来,其发病率和死亡率逐年上升并呈现年轻化的趋势,对人的生命健康造成重大的威胁[1-2]。RNA干扰(RNA interference, RNAi)是真核生物在进化过程中一种高度保守的机制, 它与共抑制、协同抑制、基因沉默、基因阻滞以及发育等许多重要的生物学过程密切相关[3-4],也可利用其干扰肿瘤细胞中特定基因的表达,用于肿瘤发生机制的探讨和基因治疗策略的开发[5-6]。Ⅰ型辅酶脱氢酶1α亚复合物4(NADH dehydrogenase 1 alpha subcomplex 4,NDUFA4),是由定位于人7号染色体p21.3上的NDUFA4 基因编码的线粒体呼吸链蛋白质,也是哺乳动物线粒体细胞色素C氧化酶(COX;Complex IV)中的重要亚基,分子量约为9 kb,具有NADH脱氢酶和氧化还原酶活性,能够将电子从NADH转移至呼吸链,参与能量代谢[7-8]。已有研究显示NDUFA4基因的异常改变与包括肿瘤在内的多种疾病发生发展密切相关[9-10]。然而,NDUFA4在人结直肠癌发生中的可能作用和机制尚未清楚。因此,本研究旨在利用RNA干扰技术(RNAi),观察下调NDUFA4表达对人结直肠癌SW480细胞体外生长的影响,并初步探讨其作用机制,为后续深入研究NDUFA4分子在人结直肠癌发生中的作用提供前期实验依据。
1 材料与方法
1.1 材料 细胞株、质粒和主要试剂:人结肠癌SW480细胞株购于中国生命科学院,p-Cont质粒(P-EGFP-N1质粒)由本实验室保存,NDUFA4-RNAi重组质粒、PCR引物均购于上海吉玛制药技术有限公司;Leibovitz’s L-15 培养基、优质胎牛血清(FBS)均购自美国Gibco 公司,磷酸盐缓冲液(PBS)、1%结晶紫染液均购自北京索莱宝科技有限公司;Cell Counting Kit-8( CCK-8) 试剂盒购于东仁化学科技(上海)有限公司;Lipofectamine3000(L3000150)试剂盒购于赛默飞中国; Trizol试剂、SYBR Premix Ex Taq、Premix Ex Taq Version2.0,以及RNAisoTMPlus均购自北京宝日医生物技术有限公司;RevertAidTMFirst Strand cDNA Synthesis Kit反转录试剂盒购自美国Fermentas公司;兔抗NDUFA4(Ab129752)、β-Actin单克隆抗体、p-AKT、AKT一抗以及兔抗ERK1/2、p-ERK1/2一抗、HRP标记的羊抗兔二抗均购自Abcam中国;ECL试剂盒、RIPA裂解液购于联科生物技术公司。
1.2 方法
1.2.1 细胞培养和转染 将人结肠癌SW480细胞置于含10%优质胎牛血清、三抗(青霉素和链霉素-两性霉素混合液)的 Leibovitz’s L-15细胞培养基、37 ℃,5%CO2,100%湿度的细胞培养箱中培养,当SW480细胞培养密度达到80%融合时,使用0.25%胰蛋白酶于37 ℃细胞培养箱中消化2 min,离心收集细胞后用于后续相关实验。将待转染细胞设置实验组别:p-Cont组和p-NDUFA4组。按照相应密度将细胞接种于6孔板和96孔板,继续按照上述培养条件培养细胞,转染当天待贴壁细胞密度达到80%融合时,使用Lipofectamine3000转染试剂盒进行转染。48 h后荧光显微镜下观察转染情况。
1.2.2 Real-time PCR和蛋白质免疫印迹检测各组转染细胞中NDUFA4 mRNA相对表达量和蛋白水平
1.2.2.1 Real-time PCR检测NDUFA4的mRNA相对表达量同前期工作[11]。
1.2.2.2 Western blot检测各组转染细胞中NDUFA4蛋白水平 细胞蛋白质样品的制备及BCA法定量蛋白的检测参考文献[11]。分别制备分离胶和浓缩胶;SDS-PAGE电压80V跑浓缩胶,120V跑分离胶;上样Marker和制备好的NDUFA4蛋白样品;电泳1 h后采用半干法将目的蛋白NDUFA4转至PVDF 膜;转膜完毕后立刻把膜置于配置5% 脱脂奶粉的TBST溶液中封闭1 h;将兔抗人的内参β-Actin、NDUFA4(稀释比例均为1∶1 000)一抗加入含有封闭液中进行孵育;4℃冰箱过夜;次日,加入HRP标记的羊抗兔二抗NDUFA4,室温下用PBST 洗膜;加入等量底物显色液进行蛋白曝光。
1.2.3 CCK-8法检测人结直肠癌SW480细胞的增殖情况 实验分组如1.2.1所示,并设置三个复孔。按8×103个细胞接种于96孔板,常规条件下培养细胞,待细胞密度达80%左右,Lipofectamine3000瞬时将NDUFA4-RNAi质粒和p-Cont对照组质粒转染人结直肠癌SW480细胞,吸附5~6 h,更换新鲜培养基。于转染24、48、72、96、120 h后避光分别向每孔加入10 μL CCK-8 试剂,并置于37 ℃细胞培养箱中继续培养3 h,在酶标仪下读取每孔吸光度(OD450)值变化,记录并绘制标准曲线。
1.2.4 检测人结直肠SW480细胞的克隆形成能力 0.25%胰蛋白酶将已转染的两组细胞消化后置于显微镜下进行细胞计数,并以200/孔和800/孔接种于6孔板中,用于克隆形成实验,然后,将细胞置于细胞培养箱中静置培养,培养条件同前1.2.1。14 d后,当培养皿中出现肉眼可见克隆时,弃去培养液,PBS液小心漂洗2次,空气干燥。每孔加入4%多聚甲醛固定液固定15 min,弃固定液后室温干燥。用结晶紫染液染色,并对菌落克隆数量拍照和统计学分析。
1.2.5 实时荧光定量PCR检测人结直肠癌SW480细胞中与生长相关基因的表达 细胞生长周期相关的CDKs表达的检测同前期工作[11]。
1.2.6 Western blot检测SW480细胞中AKT、ERK、磷酸化AKT、磷酸化ERK蛋白的表达情况
1.2.7 免疫印迹试验检测总AKT、ERK 1/2和AKT、ERK1/2磷酸化水平的变化方法同前期工作[11]。
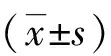
2 结果
2.1 瞬时转染NDUFA4-RNAi后SW480细胞中NDUFA4的表达水平 我们将NDUFA4-RNAi质粒和p-Cont质粒体外分别转入人结直肠癌SW480细胞后,利用实时荧光定量PCR和蛋白质印迹分别检测两组转染细胞中NDUFA4的mRNA和蛋白表达水平。结果显示,与p-Cont组相比,p-NDUFA4组中NDUFA4的表达水平明显下调(P<0.05,见图1 A、B)。

A:NDUFA4的相对表达量;B:NDUFA4的蛋白水平;**:与p-Cont组比较,P<0.01。 图1 转染NDUFA4-RNAi质粒后SW480细胞NDUFA4的mRNA和蛋白表达变化
2.2 瞬时转染NDUFA4-RNAi抑制SW480细胞体外生长 CCK8结果显示:与p-Cont组相比,转染48 h后,p-NDUFA4组细胞的增殖速度均明显低于p-Cont组细胞的增殖速度(P<0.05,见图2)。

*:与p-Cont组比较,P<0.05。图2 转染NDUFA4-RNAi对SW480细胞增殖的影响
2.3 瞬时转染NDUFA4-RNAi抑制SW480细胞的克隆形成能力 实验结果显示,在接种200细胞/孔和800细胞/孔条件下,p-NDUFA4组SW480细胞的克隆形成率较p-Cont组明显降低(P<0.05,见图3)。

*:与p-Cont组比较,P<0.05。 图3 瞬时转染NDUFA4 -RNAi对SW480细胞克隆形成的影响
2.4 下调NDUFA4抑制细胞生长周期相关的CDKs分子的表达 结果显示:与p-Cont组相比,p-NDUFA4组中肿瘤细胞生长周期相关的周期蛋白依赖性激酶CDK3、CDK4的表达水平均显著下调(P<0.05,见图4)。

*:与p-Cont组比较,P<0.05。 图4 瞬时转染NDUFA4-RNAi对SW480细胞中细胞生长周期相关的CDKs表达的影响
2.5 抑制NDUFA4明显下调SW480细胞p-ERK,p-AKT的蛋白水平 Western Blot检测结果显示:与p-Cont组相比,p-NDUFA4组中p-ERK,p-AKT的蛋白表达水平明显降低(P<0.05,P<0.01,见图 5A、B)。
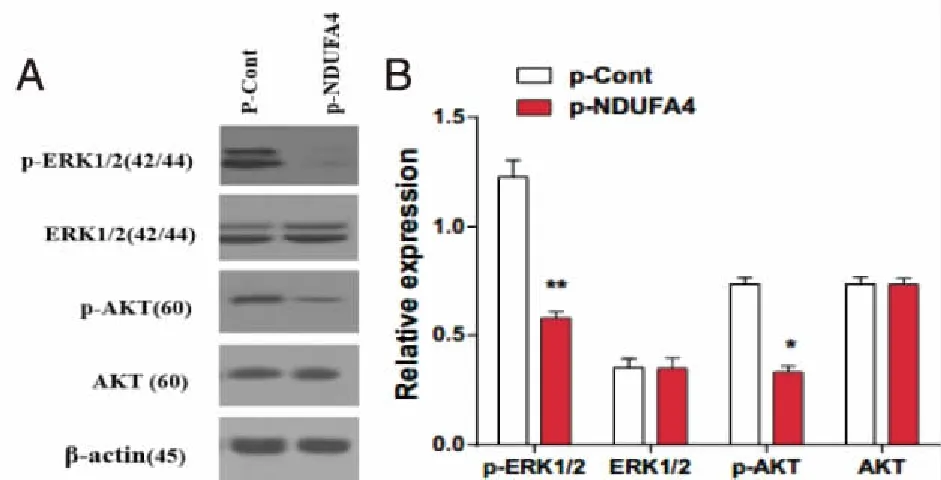
与p-Cont组比较,*:P<0.05, **:P<0.01。 图5 Western Blot检测NDUFA4-RNAi转染SW480细胞中总AKT、ERK 1/2和AKT、ERK1/2磷酸化水平的变化
3 讨论
近来研究显示,Ⅰ型辅酶脱氢酶1α亚复合物4(NADH dehydrogenase 1 alpha subcomplex 4 ,NDUFA4)参与了肿瘤的发生发展过程[9],然而其在人结直肠癌发生中的可能作用及机制鲜有研究探讨。近年来,RNA干扰技术在基因功能、基因治疗、遗传性疾病的治疗及肿瘤的治疗方面发挥着重要的作用[12-13]。例如,罗麟洁等[14]利用RNA干扰技术可有效沉默肺腺癌A549细胞的STAT3基因,同时细胞生长受到抑制,提示STAT3基因在肺癌细胞生长中的重要作用。类似地,訾永宏等[15]也利用RNA干扰技术成功下调人结直肠癌细胞中ADP-核糖基化样因子4C(ADP-ribosylation factor-like 4C,Arl4c)的表达,探讨Arl4c基因在人结直肠癌发生中的作用。在本研究中,我们也尝试利用RNAi技术来下调人结直肠癌细胞中NDUFA4基因的表达,发现细胞中NDUFA4的表达水平明显降低,为后续深入探讨NDUFA4在人结直肠癌发生发展中的作用提供了重要基础。
有意义的是,CCK-8实验和克隆形成实验显示,下调NDUFA4表达后,SW480细胞的增殖能力和克隆形成能力明显减弱,提示RNA干扰下调NDUFA4表达后,人结直肠癌细胞的体外生长能力受到明显抑制。为了进一步明确下调NDUFA4对人结直肠癌细胞体外生长的效应,我们进一步检测了细胞中生长周期相关分子CDKs 家族成员CDK3和CDK4等的表达,发现CDKs家族成员CDK3和CDK4明显下调,提示NDUFA4抑制人结直肠癌细胞体外生长的效应与细胞周期变化有关。 类似地,我们在前期研究中发现,过表达NDUFA4可促进人肺癌细胞的生长[11]。这些研究进一步提示NDUFA4作为促癌基因在肿瘤发生中具有重要作用。现已知,AKT和ERK信号途径与肿瘤细胞生长密切相关[16-17]。为了初步探讨NDUFA4参与人结直肠癌细胞体外生长的可能机制,我们检测了细胞中p-AKT和 p-ERK等蛋白的表达情况,且发现下调NDUFA4表达后,肿瘤细胞中p-AKT和 p-ERK等蛋白的表达水平均明显下调,提示,下调NDUFA4表达可显著抑制人结直肠癌细胞体外生长,其效应可能与相关信号途径传递变化有关。然而,NDUFA4与这些相关信号途径的确切关系仍待研究探讨。
综上所述,本研究首次利用RNAi技术下调NDUFA4表达,发现人结直肠癌细胞的体外生长受到抑制,且AKT和ERK等信号途径传递发生变化,为后续深入探讨NDUFA4在人结直肠癌发生中的作用及机制提供了前期实验基础。然而,鉴于NDUFA4分子在细胞能量代谢中的重要作用,以及AKT等信号途径与能量代谢的密切关系,因此,NDUFA4下调对人结直肠癌细胞体外生长的确切分子机制,包括细胞能量代谢改变,仍有待后续研究探讨。
——一道江苏高考题的奥秘解读和拓展

