大黄素对布鲁菌感染 BALB/c 小鼠模型的治疗作用
周小仙,朱 珠,陈泽慧,陈安林,杨智芳
(1.遵义医科大学附属医院 检验科,贵州 遵义 563003;2.遵义医科大学 检验医学院,贵州 遵义 563006)
布鲁菌是一种兼性细胞内寄生菌,人体感染后可引起复发性发热和流感样症状,并导致多器官受累,家畜感染后可引起流产和不孕。布鲁菌作为胞内寄生的隐匿性病原体,对宿主免疫机制具有调节作用。布鲁菌感染后,宿主中性粒细胞几乎不能被激活,导致其能通过抵抗吞噬细胞杀伤机制而逃避天然免疫系统和特异性免疫系统的清除作用[1-3]。大部分抗菌药物不能渗透巨噬细胞膜而发挥抗菌作用,以上这些因素均可能导致布鲁菌感染治疗失败率高、复发率高、周期长、副作用大[3],甚至已有强力霉素耐药和利福平耐药的布鲁菌出现[4]。因此,寻找一种安全有效、毒副作用小且能够透过细胞膜而用于治疗布鲁菌病的药物具有十分重要的意义。大黄素是一种蒽醌类化合物,具有水溶性差、脂溶性好的特点[5],对金黄色葡萄球菌、铜绿假单胞菌等病原菌具有一定的抑菌作用[6]。本课题组前期研究发现,大黄素可通过增加IL-6、TNF-α 和IFN-γ 的表达量,增强巨噬细胞对布鲁菌的杀伤能力[7]。为了进一步证实其疗效,本课题组通过构建布鲁菌感染BALB/c小鼠模型以观察大黄素对布鲁菌感染小鼠的治疗效果,以期为大黄素抗布鲁菌感染提供实验依据。
1 材料与方法
1.1 实验动物 BALB/c 小鼠,雌雄各半,SPF级6~8周,购自第三军医大学实验动物中心,体重18~20 g。
1.2 试剂 大黄素(纯度 ≥ 99.0%)购自美国Sigma公司;胰蛋白胨大豆琼脂、胰蛋白胨大豆肉汤平板购自青岛高科园海博生物科技有限公司;基因组DNA 提取试剂盒及PCR 扩增试剂盒购自上海生工生物公司;Mueller-Hinton Broth 肉汤购自英国OXOID 公司;试管凝集试验试剂盒购自北京赛诺利康生物技术有限公司。
1.3 仪器设备 VITEK 2 Compact全自动微生物分析系统及比浊仪为法国梅里埃公司产品;T100TMThermal Cycler PCR 扩增仪为德国BIO RAD 公司产品;DYCP-31DN 型电泳仪为北京六一仪器厂产品;FA1104B 电子天平为美国奥豪斯公司产品。
1.4 方法
1.4.1 实验菌株分离培养鉴定 采用VITEK 2 Compact 全自动微生物鉴定仪对临床分离菌株进行初步鉴定,16S rDNA 分子技术对该菌株再次进行菌种鉴定,16S rDNA 进行PCR 扩增的引物序列为:27 F:5'-AGAGTTTGATCMTGGCTCAG-3';1492 R: 5'-TACGYTACCTTGTTACGACTT-3'。
1.4.2 构建布鲁菌感染小鼠模型 70 只BALB/c 小鼠随机分为对照组和实验组(1×102、1×103、1×104、1×105、1×106和1×107CFU/mL菌液),每组10 只,雌雄各半。对照组,每只小鼠腹腔注射200 μL PBS 溶液,实验组每只小鼠腹腔注射200 μL按照上述分组设定的菌液构建小鼠感染模型[8]。注射菌液后第1周和第2周脱颈处死小鼠,进行血清试管凝集试验(Serum tube agglutination test,SAT)和脾脏载菌量检测(取脾脏研碎稀释后接种于平板上,观察是否有细菌生长,并采用VITEK 2 Compact 全自动微生物鉴定仪和16S rDNA分子技术对其进行细菌学鉴定),确定成功构建布鲁菌感染小鼠模型的菌液浓度及时间。
1.4.3 布鲁菌感染小鼠不同时间对肝脾的影响 将40 只小鼠随机分为对照组和实验组,每组20 只,雌雄各半。对照组每只腹腔注射200 μL 生理盐水,实验组注射上述成功构建小鼠感染模型浓度的布鲁菌液200 μL。分别于1、2、4、6周时脱颈处死小鼠,取出肝脾组织,称量肝脾湿重后,计算肝脾指数(指数=脏器湿重/小鼠体重×100 %),HE 染色观察肝脾组织病理变化。
1.4.4 大黄素对布鲁菌感染小鼠的治疗效果 将50 只布鲁菌感染小鼠随机分为磷酸盐缓冲溶液(Phosphate buffer solution,PBS) 组、多西环素组和大黄素组(2、4、8 mg/mL),每组10 只,雌雄各半。第1周每只小鼠每天用1 mL相应药物灌胃1次,第2~3周每3 d灌胃1次。最后一次灌胃结束1 d脱颈处死小鼠,通过体重称量、腹腔积液菌落计数、肝脾指数测量及肝脾组织HE 染色观察病理变化。
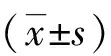
2 结果
2.1 实验菌株鉴定结果 实验菌株经VITEK 2 Compact全自动微生物鉴定仪GN 鉴定卡鉴定该菌株为羊布鲁菌 ,生物编码为0000001300001001,置信度99% 。16S rDNA分子技术鉴定结果中,PCR扩增该菌的目的基因片段长度为1 500 bp(见图1),与文献报道一致[9],并将此PCR 扩增产物送北京六合华大基因科技有限公司进行测序,所得序列(见图2)经Blast 对比分析,其与羊布鲁同源性为97%(见图3)。

Sam1、Sam2和 Sam3为重复实验菌株。 图1 实验菌株16S rDNA PCR扩增产物琼脂糖凝胶电泳结果

图2 实验菌株16S rDNA PCR扩增产物测序结果

图3 实验菌株16S rDNA PCR扩增产物序列比对结果
2.2 成功构建布鲁菌感染小鼠模型菌液浓度 以1×105CFU/mL菌液腹腔注射小鼠2周时,出现SAT(++)、脾脏载菌(+),由此判定小鼠感染布鲁菌的菌液浓度可能为1×105CFU/mL(见表1)。细菌学检查发现,1×105CFU/mL菌液腹腔注射小鼠2周后在脾脏组织中检出羊布鲁菌,而对照组无细菌检出,表明通过腹腔注射1×105CFU/mL菌液2周可成功构建布鲁菌感染小鼠模型。
2.3 布鲁菌感染小鼠不同时间对肝脾指数的影响 布鲁菌感染小鼠2周后开始出现肝脾指数增加,且随着时间延长,增加越明显。1、2、4、6周时,对照组的肝脏指数分别为5.835±0.626、5.665±0.131、6.258±0.621和6.410±0.993,实验组肝脏指数分别为6.002±0.459、7.157±0.203、8.429±0.954和8.305±0.756;1、2、4、6周时,对照组的脾脏指数分别为0.478±0.033、0.494±0.043、0.537±0.111和0.478±0.047,实验组脾脏指数分别为0.547±0.061、0.752±0.070、1.083±0.197和1.931±0.236(见图4)。
表1不同浓度的布鲁菌液感染小鼠不同时间SAT和脾脏载菌情况

组别1周SAT脾脏载菌量2周SAT脾脏载菌量对照组----1×102 CFU/mL-+-+1×103 CFU/mL-+-+1×104 CFU/mL-+-+1×105 CFU/mL-++++1×106 CFU/mL-++++1×107 CFU/mL-++++
SAT“++”及以上血清稀释度判断为该血清抗体阳性。

a: 与相应时间的对照组比,P <0.05;b: 与第1周的实验组比,P <005;c: 与第1周的实验组比,P <0.01。图4 布鲁菌感染小鼠不同时间对肝脾指数的影响
2.4 布鲁菌感染小鼠的肝脾组织病理变化 实验组肝细胞结构排列紊乱,细胞间隙增宽,胞浆发生脂肪样变性,细胞核固缩;脾脏结构紊乱,脾小体、脾小粱基本不可见,红、白髓分界不明,白髓区明显减少,其间出现纤维样改变(见图5)。
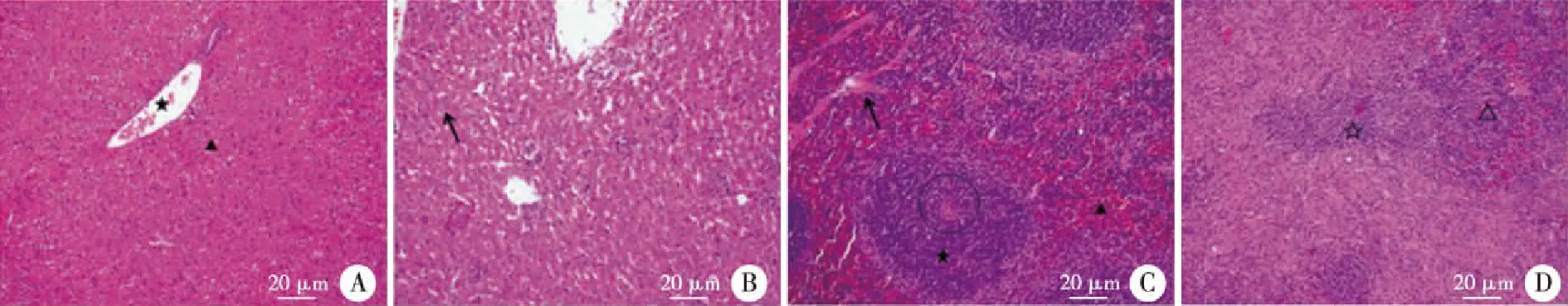
以上病理组织切片均采自布鲁菌感染小鼠4周的组织病理切片,其中肝脏组织病理切片中,★为中央静脉,▲和↖均为肝细胞。脾脏组织病理切片中★和☆均为白髓,▲和△均为红髓,○为中央动脉,↖为脾小粱。图5 布鲁菌感染小鼠肝脾组织的病理变化
2.5 大黄素对布鲁菌感染小鼠体重和腹腔载菌量的影响 与PBS 组相比,大黄素组(2、4、8 mg/mL)和多西环素组小鼠腹腔细菌量明显减少(P<0.05),体重明显增加(P<0.05),且8 mg/mL大黄素组和多西环素组无统计学差异(P> 0.05)。PBS组、多西环素组和大黄素组(2、4、8 mg/mL)的腹腔载菌量(lg CFU值)分别为5.161±0.501、4.003±0.093、5.175±0.361、4.771±0.498和4.023±0.199;PBS组、多西环素组和大黄素组(2、4、8 mg/mL)的体重分别为(18.047±0.418)g、(18.921±0.291)g、(19.043±0.252)g、(18.816±0.445)g和(19.008±0.430)g(见图6)。
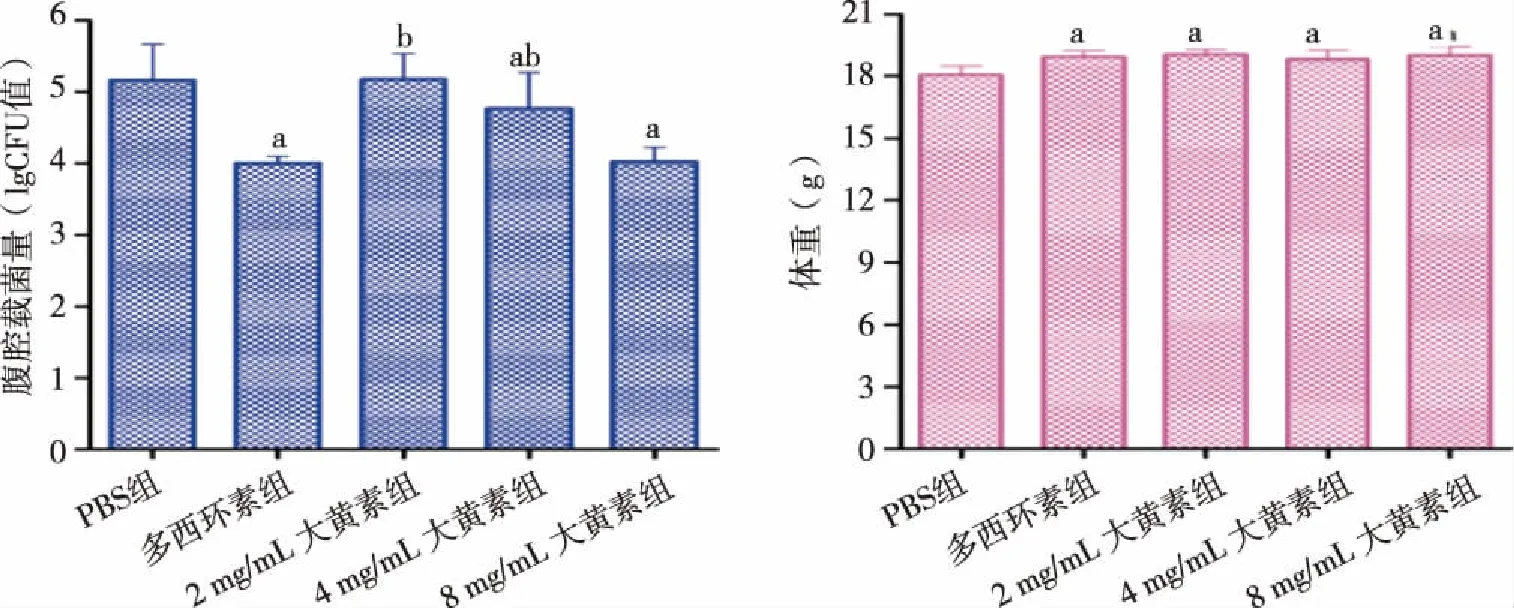
a:与PBS组相比,P <0.05; b:与多西环素组相比,P <0.05。图6 不同浓度大黄素对布鲁菌感染小鼠体重和腹腔载菌量的影响
2.6 大黄素对布鲁菌感染小鼠肝脾的影响 8 mg/mL大黄素组小鼠肝脏指数较PBS 组小鼠明显降低,病理切片见中性粒细胞、淋巴细胞和浆细胞等各种炎症细胞浸润明显减少,肝细胞排列紧密而规则,分界清楚,未见变性和坏死(见表2和图7)。
大黄素组(2、4、8 mg/mL)和多西环素组脾脏指数较PBS组小鼠明显减低(P<0.05),且8 mg/mL大黄素组和多西环素组差异无统计学意义(P> 0.05),小鼠脾脏组织变化显示,大黄素组(2、4、8 mg/mL)和多西环素组均有不同程度改善,结构排列规则有序,红白髓分界清楚,脾小体数量曾多。其中8 mg/mL大黄素组和多西环素组小鼠脾脏组织结构接近正常组小鼠(见图8和表2)。
表2大黄素对布鲁菌感染小鼠肝脾指数的检测结果
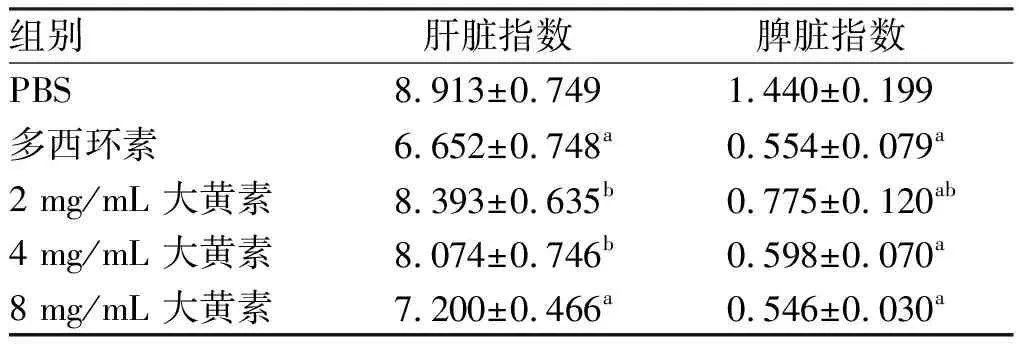
组别肝脏指数脾脏指数PBS8.913±0.7491.440±0.199多西环素6.652±0.748a0.554±0.079a2 mg/mL 大黄素8.393±0.635b0.775±0.120ab4 mg/mL 大黄素8.074±0.746b0.598±0.070a8 mg/mL 大黄素7.200±0.466a0.546±0.030a
a: 与PBS组相比,P<0.05;b:与多西环素组相比,P<0.05。

A:PBS组;B:多西环素组;C:2 mg/mL大黄素组;D:4 mg/mL大黄素组;E:8 mg/mL大黄素组。图7 不同浓度大黄素对布鲁菌感染小鼠肝脏组织病理学变化

A:PBS组;B:多西环素组;C:2 mg/mL大黄素组;D:4 mg/mL大黄素组;E:8 mg/mL大黄素组。图8 不同浓度大黄素对布鲁菌感染小鼠脾脏组织病理学变化
3 讨论
布鲁菌属是高致病性病原体,而羊布鲁菌又是布鲁菌属中最常见、毒性最强、病情最严重的亚种,人们常通过接触被感染牲畜或被污染牲畜产品引起致病,其感染后可在人体肝脾、淋巴结等器官中生存繁殖,导致全身各个系统不可逆的损害[2]。临床上常根据布鲁菌生化反应、基因组及蛋白组学的不同进行细菌学鉴定,但因单一鉴定方法容易出现错误鉴定结果,最好采用两种方法同时进行鉴定[9]。本次研究通过采用VITEK 2 Compact 全自动微生物鉴定仪及16S rDNA基因序列分析两种方法均鉴定为羊布鲁菌,确保了试验结果的可靠性。
布鲁菌可经呼吸道、消化道和皮肤接触等多种途径引起宿主感染,采用肺递送、滴鼻和腹腔注射3 种方式均可构建小鼠感染模型[8,10-11],此次研究中通过腹腔注射1x105CFU/mL菌液200 μL成功构建小鼠感染模型,结果与付湘云和韦超等报道一致,均显示布鲁菌感染的小鼠肝脾组织发生了病理损伤[10-11]。布鲁菌感染导致肝脾损伤的原因可能是,布鲁菌感染机体后,主要寄生在巨噬细胞、胎盘滋养层细胞和树突细胞中,菌体的脂多糖(LPS)、T4SS 分泌系统和BvrR/BvrS 系统等毒力因子可与宿主细胞表面相互作用,形成含有布鲁菌的空泡对宿主细胞产生损伤[12]。宿主感染布鲁菌以细胞免疫为主[13],参与细胞免疫的专职抗原提呈细胞主要是巨噬细胞和树突细胞[14]。在巨噬细胞上有较多的布鲁菌识别受体,当布鲁菌感染宿主后优先侵染巨噬细胞,通过减少胞内TNF-α 的分泌而抑制其凋亡。布鲁菌与巨噬细胞内溶酶体融合,形成布氏小体,逃逸机体的免疫监视、免疫应答和免疫杀伤作用,为自己创造在细胞内生存繁殖的良好生存环境[15]。肝脾又是巨噬细胞最丰富的器官,小鼠被布鲁菌感染后可能会造成肝脾损伤。
目前,临床对布鲁菌感染的治疗仍以联合应用抗菌药物为主,WHO 推荐多西环素联合利福平6周、多西环素联用强力霉素45 d、多西环素和链霉素联用21 d治疗布鲁菌感染患者[16]。多西环素、利福平等抗菌药物长期服用增加药物毒副作用,尤其是对肝脏的损害。近年来随着大量抗菌药物的使用,逐渐出现了利福平、复方新诺明对布鲁菌耐药的报道[4],所以寻找新的药物治疗布鲁菌病已成为研究热点。大黄素是一种分离自大黄、虎杖、何首乌、芦荟和决明子等中药的天然蒽醌类产物,具有抗病毒,抗菌,抗炎,抗过敏,抗肿瘤,抗骨质疏松,治疗糖尿病,免疫抑制和保护神经等多种药理活性[17]。朱珠等[7]研究发现,大黄素能增强巨噬细胞对布鲁菌的杀伤能力。本次研究发现,大黄素可减少小鼠腹腔积液中细菌的量,增加体重,改善肝脾组织的病理损伤,且8 mg/mL大黄素与多西环素的治疗效果相同。大黄素作为天然植物提取物,与临床常用的抗生素、激素等相比,在使用时不易产生耐药性,可从干扰核糖、蛋白、能量转化、细胞壁和细胞膜的完整性等各个环节而抑制布鲁菌生长[18-19]。研究发现,大黄素仅在较高剂量(4 000 mg/kg)作用下才可引起不可逆的病理改变,产生 肝毒性、肾毒性和生殖毒性,低中剂量不会造成病理改变[20]。而此次研究显示所需大黄素为8 mg/mL以下就有抗感染效果,远远低于中毒剂量。因此,临床上针对布鲁菌感染患者,可选用大黄素辅以治疗,减少抗菌药物的毒副作用及耐药性。

