miR-214与MIR31HG在非小细胞肺癌中的表达及其临床意义
韩云,毛宇强,徐然,王一北,石岱旺,石文君
肺癌是一种严重威胁人类健康的的恶性肿瘤,根据国家癌症中心公布的2015年癌症统计数据显示,新发肺癌患者达73.33万[1],且发病率有逐渐增高的趋势,虽然近年来手术、放化疗及分子靶向治疗取得较大进展,但肺癌病死率仍较高,5年生存率为20.99%[2]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)是肺癌最常见病理类型,但约70%患者诊断时已为中晚期,寻找无创、耗时短、灵敏度高的筛查方法对早期诊断NSCLC具有重要的意义,因此,有必要深入研究NSCLC发生发展的分子生物学机制。微小RNA(micro RNAs,miR)是一类长度为18~25个核苷酸的小型内源非编码RNA,参与细胞分化、细胞周期和凋亡调控,与肿瘤、免疫、炎性反应等病理生理过程有关[3]。有学者在非小细胞肺癌癌株A549、H1299发现miR-214表达降低的现象,当miR-214过表达时能抑制肿瘤细胞的增殖,促进其凋亡,这与miR-214能够调节肿瘤细胞增殖和凋亡相关蛋白表达有关[4]。长链非编码RNA(lncRNA)是长度大于200个核苷酸的RNA调控因子,在多种恶性肿瘤的发生发展中发挥重要的调节作用,因此寻找关键lncRNA对于NSCLC的诊断、治疗和预后具有重要意义[5]。LncRNA MIR31HG,又称为Loc554202,位于9p21.3,在结直肠癌、NSCLC等多种肿瘤中存在表达增高的现象[6-7],通过激活Wnt /β-钙黏蛋白信号通路,发挥促进肿瘤细胞增殖和抑制凋亡的作用。本研究通过检测NSCLC癌组织中miR-214、MIR31HG的表达,分析两者与临床病理特征之间的关系,初步探讨其临床意义,报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2016年2月—2017年2月于中国医科大学附属盛京医院胸外科行手术治疗的104例NSCLC患者的临床资料。患者纳入标准:(1)所有NSCLC患者均经术后病理检查明确诊断;(2)入选患者均为初次诊治,既往未接受过放化疗、免疫治疗等抗肿瘤治疗;(3)临床病理资料完整。排除标准:(1)合并有急性感染性疾病,如泌尿系感染、呼吸道感染等;(2)合并其他器官恶性肿瘤;(3)合并严重的心、肝、肺、肾等器官功能不全。本组患者男61例,女43例,年龄31~79(57.12±7.61)岁;腺癌71例,鳞癌33例;肿瘤TNM分期参考第七版美国癌症联合会NSCLC分期标准[8]:Ⅰ期29例,Ⅱ期37例,Ⅲ期38例;组织学分级:高分化29例,中分化35例,低分化40例;肿瘤直径≤5 cm者58例,>5 cm者46例;伴淋巴结转移38例,无淋巴结转移66例。本研究经医院伦理委员会审核批准通过,患者及家属知情同意并签署知情同意书。
1.2 检测方法 收集104例患者术中获取的部分癌组织,以距离癌组织3 cm以上的癌旁组织96份作为对照,将其置于冻存管内液氮罐速冻后,转运至实验室后置于-80℃冰箱保存。各取约100 mg组织,采用Trizol法提取组织中总RNA。紫外分光光度计测定RNA溶液的吸光度值鉴定其浓度及纯度,将合格的总RNA置于-80℃冰箱保存。以总RNA为模板,用TaqMan RNA反转录试剂盒反转录合成cDNA。反应体系为20 μl,反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min。实验步骤严格按照反转录试剂盒说明书进行。miR-214特异性茎环引物正向序列:5'-CACCGCATCCGCTCACCTGTACAGC-3',反向引物序列:5'-AAACGCTGTACAGGTGAGCGGATGC-3',内参基因U6上游引物序列:5'-CGCTTCGGCAGCACATATACTAA-3',下游引物序列:3'-TATGGAACGCTTCACGAATTTGC-5';MIR31HG上游引物序列:5'-TTCTGTCCTCCTACTCGGACCC-3',下游引物序列:5'-CCTCCAGAGTTTGGTTTTGTGTC-3',以GAPDH作为内参照,上游引物序列:5'-GCACCGTCAAGGCTGAGAAC-3',下游引物序列:5'-GCCTTCTCCATGGTGGTGAA-3'。总反应体系20 μl,包括2 μl cDNA,0.1 μl TaqDNA聚合酶、1 μl上下游引物、1 μl 20×SYBR Green Ⅰ及0.4 μl浓度为10 mmol/L dNTPs。荧光实时定量PCR反应条件为:95℃ 5 min,95℃变性15 s,60℃退火60 s,72℃延伸10 s,40个循环。所有反应均在ABI7900实时定量PCR仪上完成,每个样本重复3次。采用相对Ct值方法进行计算:表达量=2-ΔΔCt。

2 结 果
2.1 癌组织与癌旁组织中miR-214、MIR31HG表达比较 癌组织miR-214相对表达量低于癌旁组织(P<0.01),而MIR31HG相对表达量高于癌旁组织(P<0.01),见表1。
2.2 癌组织中miR-214、MIR31HG表达与临床病理特征之间的关系 癌组织中miR-214、MIR31HG表达与肿瘤分期及组织学分级有关(P均<0.01),而与患者病理类型、肿瘤直径及是否存在淋巴结转移无关(P均>0.05)。肿瘤分期为Ⅲ期、低分化癌组织中miR-214表达水平分别低于肿瘤分期为Ⅰ~Ⅱ期、高中分化癌组织(P均<0.01)。肿瘤分期为Ⅲ期、低分化癌组织中MIR31HG表达水平分别高于肿瘤分期为Ⅰ~Ⅱ期、高中分化癌组织(P均<0.01),见表2。

表1 癌组织与癌旁组织中miR-214、MIR31HG表达比较

表2 癌组织中miR-214、MIR31HG表达与临床病理特征之间的关系
2.3 癌组织中miR-214与MIR31HG表达的相关性 NSCLC癌组织中miR-214相对表达量与MIR31HG的相对表达量呈负相关(r=-0.618,P=0.000,95%CI0.487~0.741),见图1。

图1 癌组织中miR-214与MIR31HG相对表达量的相关性
2.4 miR-214与MIR31HG对NSCLC预测价值分析
以癌旁组织为阴性样本(n=96)、以癌组织为阳性阳本(n=104),再将miR-214及MIR31HG水平划分成8个组段,建立ROC曲线分析模型。经ROC曲线分析,miR-214及MIR31HG对NSCLC的发生具有较高的预测价值,AUC均在0.8左右。在其理论阈值点处,敏感度均大于0.8,特异度均大于0.7。见表3、图2。
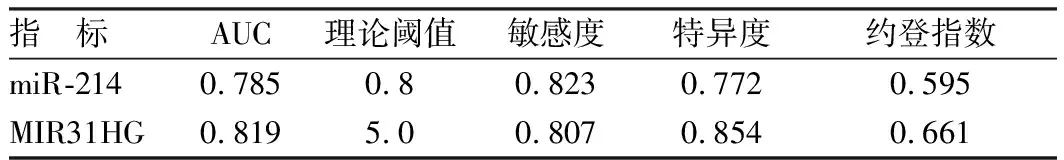
表3 miR-214与MIR31HG对NSCLC预测价值分析
3 讨 论
非编码RNA(包括lncRNA、miRNA等)在癌症起始和进展中发挥重要的作用,参与调节多条信号通路的信号转导,如notch信号转导通路、mTOR信号转导通路等,影响肿瘤细胞增殖、凋亡、浸润转移等生物学行为[9]。在NSCLC中已经鉴定出多种lncRNA表达异常的现象[10-11],以往研究报道MIR31HG在多种癌症中发挥着不同的作用,如在食管鳞状细胞癌组织和血浆中发现MIR31HG显著上调,通过抑制MIR-31的表达促进肿瘤细胞增殖、浸润和转移[12]。此外,在NSCLC中发现多种miRNA表达的变化,如miR-214、miR-141及miR-224等,miRNA可以与靶基因3′UTR区域的特定靶点结合改变靶基因mRNA的生物稳定性,直接抑制靶基因mRNA的翻译过程,引起下游信号传导分子表达异常,可参与炎性反应、免疫、代谢及肿瘤等多个病理生理过程[13-14]。
本研究中,NSCLC癌组织中miR-214的相对表达量低于癌旁组织,目前其表达降低的机制尚不清楚,可能与长链非编码RNA催化组蛋白赖氨酸三甲基化(H3K27me3)并导致靶基因miRNA的转录沉默有关,进而使下游PTEN/AKt信号通路活化,促进肿瘤细胞的增殖和转移[15-16]。本研究结果表明,NSCLC癌组织中miR-214的表达与肿瘤分期及组织学分级有关,肿瘤分期Ⅲ期、低分化癌组织中miR-214表达水平分别低于肿瘤分期Ⅰ~Ⅱ期、高中分化癌组织(P均<0.01)。其机制可能是lncRNA如SNHG6作为内源性竞争性RNA表达增加,与miR-214结合并抑制其抑癌作用,进而调节下游转录因子EZH2的表达,而SNHG6基因的拷贝数增加多发生于高级别、进展期恶性肿瘤中,与患者不良预后密切相关[17]。miR-214的表达可以在转录后、翻译后水平受其他因子的调控。本研究中,癌组织中miR-214的相对表达量与MIR31HG的相对表达量呈负相关,其原因可能是MIR31HG作为miR-214的靶基因,miR-214结合于MIR31HG mRNA,降低mRNA稳定性,减少MIR31HG表达,而肿瘤细胞中miR-214表达下降,对MIR31HG表达抑制作用减弱。

图2miR-214与MIR31HG表达的ROC曲线
MIR31HG是一种长度> 2 166个核苷酸的lncRNA,在胰腺导管腺癌中MIR31HG表达升高,表现出原癌基因的潜能,促进肿瘤的发生发展[18]。研究表明,MIR31HG表达上调通过EGFR/PI3K/AKT信号通路增加了NSCLC细胞系中的吉非替尼耐药性[19]。本研究癌组织中MIR31HG相对表达量高于癌旁组织,其机制可能是肿瘤细胞中转录因子SP1表达增加,其能够结合MIR31HG基因启动子区域并促进基因转录[20]。本研究癌组织中MIR31HG表达与肿瘤分期及组织学分级有关,肿瘤分期Ⅲ期、低分化癌组织中MIR31HG表达水平分别高于肿瘤分期Ⅰ~Ⅱ期、高中分化癌组织(P均<0.01)。结果表明MIR31HG表达随着分期和组织学分级的升高而表达增加,与肿瘤发生发展有关,而在沉默MIR31HG表达后,肿瘤细胞的增殖、浸润及转移能力降低[21]。其机制可能是MIR31HG促进相关蛋白信号通路的表达,促使肿瘤细胞增殖并发生上皮间质转换,导致肿瘤进展。MIR31HG的高表达水平可能提示患者预后不良和较短生存时间,但本研究为回顾性分析,未对研究对象进行随访观察,在今后的研究中应进一步考察患者的复发及生存情况。
ROC曲线分析表明miR-214及MIR31HG的敏感度和特异度均较高,具有一定的预测价值。但本研究仅是利用了NSCLC患者的癌组织和癌旁组织进行研究,不足之处在于:一是没有设置独立的阴性对照样本(最好是初步诊断为NSCLC,但在术中病理被否定的患者样本);二是本研究获取的是组织样本,而没有获取血液样本。因此,以后将进行进一步的研究,既设立独立对照组,也采集和分析各样本的血液资料。
综上所述,NSCLC癌组织中miR-214及MIR31HG均异常表达且呈负相关,两者共同参与NSCLC的发生发展过程,有希望成为新的诊断、治疗及评估预后的肿瘤标志物,但两者的具体作用机制有待进一步研究。
利益冲突:无

