姜黄素后处理对缺血再灌注肾损伤大鼠Notch2/Hes-1通路的影响*
(沈阳医学院附属中心医院,辽宁 沈阳 110024)
肢体缺血再灌注损伤(limb ischemia-reperfusion injury,LIRI)并非局限于肢体,还可以对远隔脏器造成损伤,特别是血运丰富的肾脏,严重的LIRI甚至可以诱发急性肾功能不全[1-2]。姜黄素(Curcumine,Cur)是从姜科姜黄属植物姜黄根茎中提取的一种酚性色素,是植物姜黄的主要活性成分之一,具有很强的抗炎及抗氧化作用,其对心、脑、肾及肠等脏器损伤有保护作用[3];研究表明,LIRI是由多种信号通路和因子参与的复杂过程[4]。Notch信号通路广泛存在于脊椎动物和非脊椎动物,在进化上高度保守,人和大鼠都具有4种Notch受体[5]。文献已经证明,姜黄素预处理可减轻大鼠肾缺血再灌注损伤[6],但是有关姜黄素后处理是否对肢体缺血再灌注肾损伤有保护作用,目前研究甚少。此次实验性研究旨在进一步探讨姜黄素后处理对大鼠肢体缺血再灌注肾损伤时Notch2/Hes-1通路的影响。
1 材料与方法
1.1 材料与试剂
选成年雄性SD大鼠80只(由中国医科大学实验室中心提供),体重280~320 g,6~8月龄,姜黄素(批号:86M1611V,美国Sigma公司),γ-分泌酶抑制剂(DAPT)(美国Santa Cruz公司),碱性磷酸酶标记二抗(美国Santa Cruz公司)。Trizol裂解液(美国Invitrogen公司),Hes-1-mRNA引物[宝生物工程(大连)有限公司],兔抗大鼠Notch2受体多克隆抗体、兔抗大鼠β-actin多克隆抗体(美国Abeam公司)。
1.2 仪器与设备
ES-1000 SPM 超声血流仪(日本 Hayashi Denki公司),DYY-6B型电泳仪(北京六一仪表厂),PCR扩增仪(德国Biometra公司),BX-41型显微镜(日本Olympus公司),Scion Image图像分析系统(美国Apple公司)。
1.3 方法
1.3.1 动物分组与模型复制采用随机数字表法将80只SD大鼠分为4组(n =20):假手术组(Sham组)、缺血再灌注组(I/R组)、姜黄素后处理组(I/R+Cur)、抑制剂组(I/R+DAPT组)。采用参考文献[7-8]复制大鼠肢体缺血再灌注肾损伤模型。动物饲养于温度湿度可以调控的宽敞空间内,室温控制在(23±2)℃,湿度控制于50%~60%,12 h昼/夜交替照明,自由饮水,模型复制前12 h禁食。腹腔注射3%戊巴比妥钠40 mg/kg麻醉,右颈外静脉置管建立静脉通路。于大鼠双后肢股三角区切开皮肤,分离股动脉和股静脉。采用无创微动脉夹于近腹股沟韧带处夹闭股动脉,使双后肢缺4 h,随后松开无创微动脉夹,再灌注4 h。应用ES-1000 SPM超声血流仪监测血流,以未监测到血流为缺血标志,监测到血流为再灌注成功标准。实验过程中静脉输注生理盐水 1.5 ml/(kg·h)。Sham组仅分离股动脉和股静脉,不夹闭;I/R组复制肢体缺血再灌注模型;I/R+Cur组于缺血后4 h即刻腹腔注射姜黄素 200 mg/kg(溶于2 ml生理盐水中),再灌注4 h;I/R+DAPT 组于缺血后 4 h即刻腹腔注射 DAPT 0.5 μmol(溶于 2 ml生理盐水),再灌注 4 h ;Sham 组和I/R组以等量生理盐水替代。
1.3.2 生化指标检测于再灌注 4 h 时颈动脉取血3 ml,检测肌酐(Creatinine,Cr)(酶法检测)、血尿素氮(blood urea nitrogen,BUN)(二乙酰 - 肟 - 硫氨脲法检测)、丙二醛(Malondialdehyde,MDA)(紫外分光光度法),随后放血处死大鼠。
1.3.3 肾组织HE 染色 处死大鼠后迅速开腹,取右肾中部组织置10%中性甲醛中固定,常规石蜡包埋,HE染色,使用BX-41型光学显微镜观察右肾组织病理学改变,同时采用肾小管间质半定量评分法对肾炎症细胞浸润、肾间质水肿、肾小管损伤分别进行半定量分析[8]:炎症细胞浸润数量≤25%为1分,>25%≤49%为2分,>49%≤75%为3分,>75%为4分;肾间质水肿轻度为1分,重度为2分;肾小管损伤仅有上皮细胞空泡颗粒变性为1分,伴刷状缘脱落为2分,伴坏死为3分。肾小管间质半定量评分为上述各评分之和。
1.3.4 Westernblotting 检测肾组织 Notch2 受体蛋白表达 取右肾上极组织 1 cm×1 cm×1 cm,用 4℃生理盐水冲去残血,滤纸吸干水分,制备10%组织匀浆,离心提取总蛋白,应用DYY-6B型电泳仪进行蛋白测定。经SDS-聚丙烯酰胺凝胶电泳分离、转模、封闭后,分别加入兔抗大鼠Notch2受体蛋白多克隆抗体、兔抗大鼠β-actin多克隆抗体,4℃孵育过夜;加入碱性磷酸酶标记二抗,室温孵育2 h,酶法显色,扫描。采用Scion Image图像分析系统分析,目的产物与β-actin灰度值的比值反映Notch2受体蛋白表达水平。
1.3.5 逆转录- 聚合酶链反应(RT-PCR)检测靶分子 Hes-1 mRNA 的表达 取右肾下极 1 cm×1 cm×1 cm 制备10%肾组织匀浆,Trizol法抽提总RNA,逆转录合成cDNA,然后应用PCR扩增仪进行扩增,引物序列如下:Hes-1 mRNA(163 bp)正向5'-TGGAAATGACAGTGAAGCACCTC-3',反向 5'-TCG TTCATGCACTCGCTGAAG-3';β-actin(215 bp)正向5'-TGGCACCCAGCACAATGA-3',反向 5'-CTAAGTCA TAGTCCGCCTAGAAGCA-3'。Hes-1 mRNA反应条件:94℃预变性 2 min ;95℃变性 45 s,57℃退火 45 s,72℃延伸 60 s,共 35个循环;72℃延伸 5 min。β-actin反应条件:94℃预变性 2 min ;94℃变性 40 s,58℃退火 40 s,72℃延伸 60 s,30个循环 ;72℃延伸 5 min。扩增产物经2%琼脂糖凝胶电泳,溴乙锭染色,凝胶成像仪成像。采用Scion Image图像分析系统分析,目的产物与β-actin灰度值的比值反映靶分子Hes-1 mRNA表达水平。
1.3.6 ELISA检测 TNF-α 和 IL-1β 的表达 于左肾上极和左肾下极各取肾组织 1 cm×1 cm×1 cm,制备10%肾组织匀浆,分别测定肿瘤坏死因子-α(TNF-α)和白细胞介素-1(IL-1β),每组取5孔,将TNF-α标准品按倍比梯度稀释,然后分别加入检测孔(100 μl/孔)。收集上清液,依次加入待测孔(100 μl/孔),封板,37℃温箱避光孵育2 h。洗涤,加入生物素化抗体工作液100 μl/孔,封板,室温孵育1 h。洗涤。加入HRP工作液100 μl/孔,室温孵育20 min。洗涤,加入显色剂100 μl/孔,避光孵育20 min。加入终止液50 μl/孔,轻轻摇匀后置于酶标仪上测 450 nm 处光密度(optical density,OD)值作为测量值。计算与空白孔OD值,并取平均值作为测量值,采用Curve Expert软件做出标准曲线,并输入相应的OD值计算TNF-α浓度;同理,检测IL-1β。
1.4 统计学方法
数据分析采用SPSS 13.0统计软件,正态分布、方差齐计量资料以均数±标准差(±s)表示,比较采用方差分析,进一步两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组生化指标及肾小管间质半定量评分
各组肾小管间质半定量评分、Cr、BUN和MDA比较,差异有统计学意义(P<0.05)。与Sham组比较,I/R组Cr、BUN和MDA均升高,肾小管间质半定量评分增高(P<0.05);与I/R组比较,I/R+Cur组Cr、BUN和MDA降低,肾小管间质半定量损伤评分降低(P<0.05);与I/R+Cur组比较,I/R+DAPT组各指标比较,差异无统计学意义(P >0.05)。见表1。
2.2 肾组织HE染色结果
与Sham组比较,I/R组可见满视野炎症细胞浸润,肾小管周围有大量颗粒状物质沉积,肾小管扩张明显,偶可见散在的肾小管管型和萎缩肾小球;与I/R组比较,I/R+Cur组肾间质有少量炎症细胞浸润,沉积现象减少,但仍可见少量肾小管管型;I/R+DAPT组镜下所见与I/R+Cur组相同。见图1。
2.3 肾组织Notch2受体蛋白表达
Notch2受体蛋白在Sham组(0.07±0.02)、I/R组(0.93±0.05)、I/R+Cur组(0.57±0.04)及 I/R+DAPT组(0.61±0.05)中表达比较,差异有统计学意义(F =4.173,P =0.000)。与 Sham组比较,I/R组Notch2受体蛋白表达升高(P<0.05);与I/R组比较,I/R+Cur组Notch2受体蛋白表达下降(P<0.05);与I/R+Cur组比较,I/R+DAPT组Notch2受体蛋白表达差异无统计学意义(P >0.05)。见图2。
表1 各组肾小管间质半定量评分、血浆中Cr、BUN和MDA水平的比较(n =20,±s)
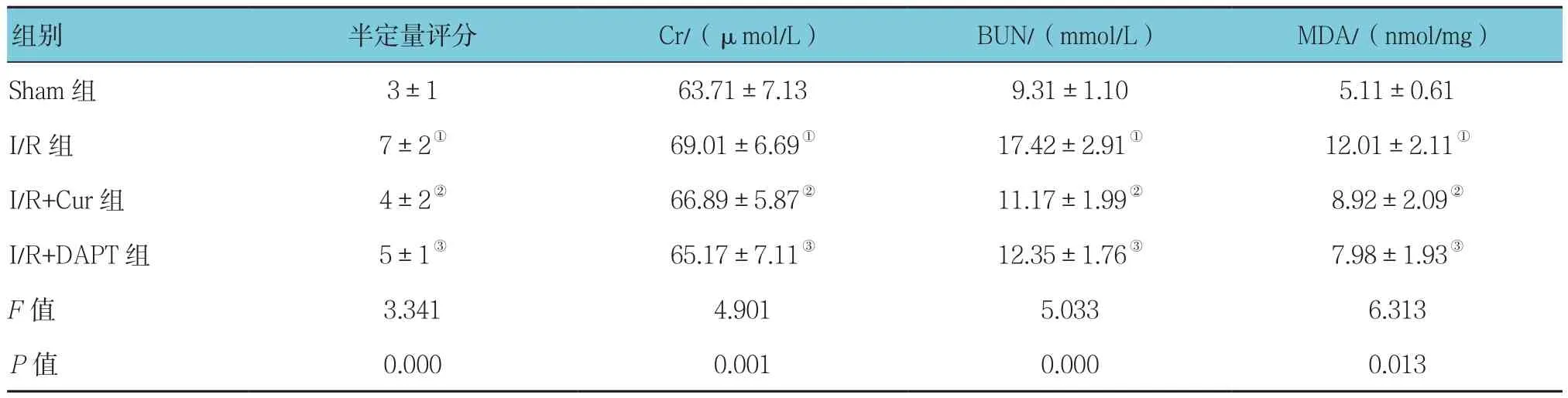
表1 各组肾小管间质半定量评分、血浆中Cr、BUN和MDA水平的比较(n =20,±s)
注:①与 Sham 组比较,P<0.05;②与 I/R 组比较,P<0.05;③与 I/R+Cur组比较,P >0.05。
组别 半定量评分 Cr/(μmol/L) BUN/(mmol/L) MDA/(nmol/mg)Sham 组 3±1 63.71±7.13 9.31±1.10 5.11±0.61 I/R组 7±2① 69.01±6.69① 17.42±2.91① 12.01±2.11①I/R+Cur组 4±2② 66.89±5.87② 11.17±1.99② 8.92±2.09②I/R+DAPT组 5±1③ 65.17±7.11③ 12.35±1.76③ 7.98±1.93③F值 3.341 4.901 5.033 6.313 P值 0.000 0.001 0.000 0.013
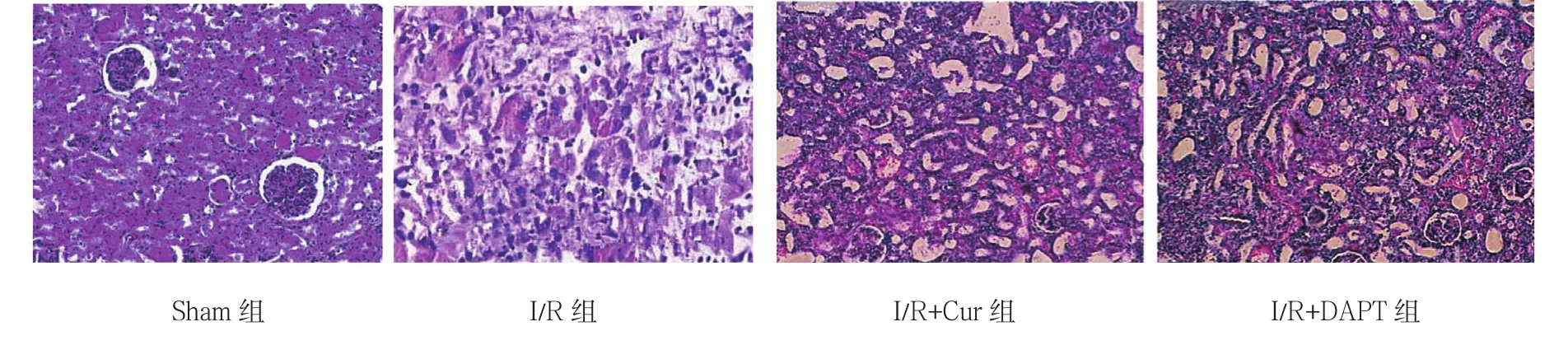
图1 各组肾组织光镜下形态结构(HE×200)
2.4 靶分子Hes-1 mRNA的表达
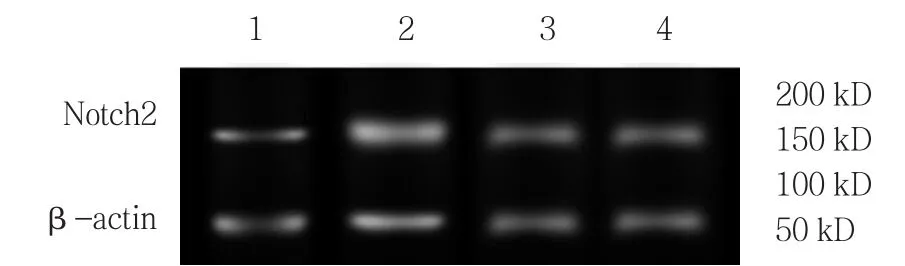
图2 各组肾组织Notch2受体蛋白表达

图3 各组肾组织Hes-1 mRNA表达
Hes-1 mRNA 在 Sham 组(0.21±0.06)、I/R 组(0.91±0.03)、I/R+Cur组(0.66±0.07)及 I/R+DAPT组(0.69±0.08)中的表达比较,差异有统计学意义(F =3.279,P =0.011)。与Sham组比较,I/R组Hes-1 mRNA表达升高(P<0.05);与I/R组比较,I/R+Cur组 Hes-1 mRNA 表达下降(P<0.05);与 I/R+Cur组比较,I/R+DAPT组Hes-1 mRNA的表达差异无统计学意义(P >0.05)。见图3。
2.5 TNF-α和IL-1β的表达
各组TNF-α和IL-1β表达比较,差异有统计学意义(P 0.05)。与 Sham 组比较,I/R组 TNF-α和IL-1β表达升高(P<0.05);与I/R组比较,I/R+Cur组 TNF-α 和 IL-1β 表达降低(P<0.05);与 I/R+Cur组比较,I/R+DAPT组TNF-α和IL-1β表达差异无统计学意义(P >0.05)。见表2。
表2 各组肾组织TNF-α和IL-1β表达水平的比较(n =20,±s)
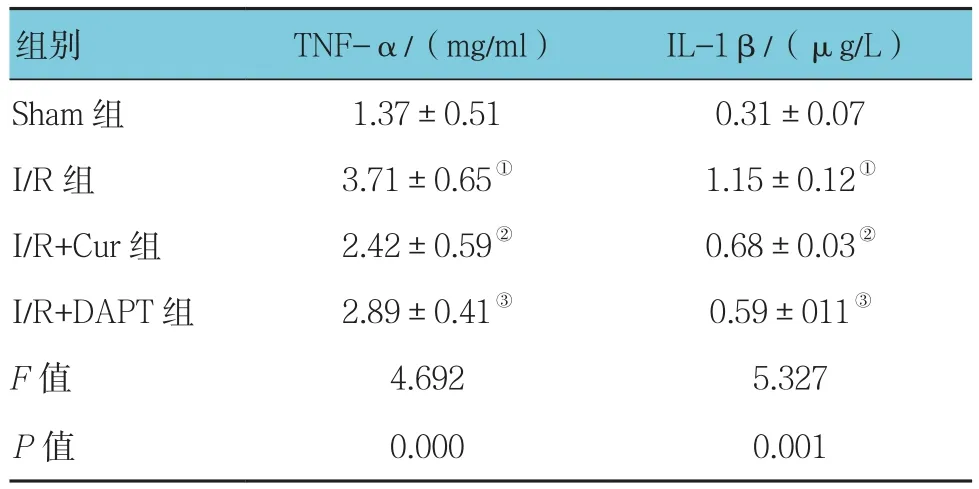
表2 各组肾组织TNF-α和IL-1β表达水平的比较(n =20,±s)
注:①与Sham组比较,P<0.05;②与I/R组比较,P<0.05;③与 I/R+Cur组比较,P >0.05。
组别 TNF-α/(mg/ml) IL-1β/(μg/L)Sham 组 1.37±0.51 0.31±0.07 I/R组 3.71±0.65① 1.15±0.12①I/R+Cur组 2.42±0.59② 0.68±0.03②I/R+DAPT组 2.89±0.41③ 0.59±011③F值 4.692 5.327 P值 0.000 0.001
3 讨论
有研究证明,姜黄素具有抗氧化应激、抑制炎症细胞因子释放、抗细胞凋亡等广泛的药理活性[9-10]。其中,姜黄素抗炎和抗氧化作用已引起国内外学者的广泛认同。
目前较为公认,缺血再灌注损伤主要影响因素是氧自由基及其引发的细胞膜脂质过氧化反应[11]。脂质过氧化还可以继发激活Kupffer细胞,释放大量氧自由基,被公认为是缺血再灌注损伤早期最主要的损伤因素[12]。生理正常状态下,大鼠肾脏组织中自由基的产生和消除速率处于动态平衡状态,但在肢体发生缺血再灌注肾损伤时,机体通过儿茶酚胺的自身氧化途径、中性粒细胞呼吸爆发、吞噬细胞系统产生大量的氧自由基。氧自由基是肾脏缺血再灌注损伤过程中最重要的有害物质[13]。大量氧自由基的生成,可激活核因子-κB,使炎症因子TNF-α和IL-1β等大量释放。
MDA是机体细胞膜中的不饱和脂肪酸受到氧自由基攻击后所产生的毒性过氧化物的代谢终产物。由于所产生的过氧化物性质极不稳定,极难测得其具体含量,但其最终代谢产物MDA的性质却十分稳定,所以检测MDA的含量即可以间接地反应肾脏组织的过氧化程度[14]。
在实验研究中可见,大鼠肢体缺血再灌注发生后,镜下可见肾小管出现小管明显扩张,管腔内可见管型,刷状缘消失、肾间质炎症细胞浸润等病理表现;同时Notch2受体蛋白和靶分子Hes-1 mRNA表达升高;炎症细胞因子TNF-α和IL-1β大量释放。证实Notch2/Hes-1信号通路很可能参与大鼠肢体缺血再灌注所造成的肾脏损伤。TNF-α和IL-1β是启动炎症反应的主要细胞因子[15-16]。上述实验结果表明,大鼠肢体缺血再灌注激活了肾组织Notch2/Hes-1信号通路,上调Notch2受体蛋白表达,在相关酶的作用下产生胞内结构域(NICD),NICD继而进入细胞核与靶分子Hes-1集合形成NICD-Hes-1下游炎症控制基因激活复合物,促使炎症细胞因子TNF-α和IL-1β大量释放,最后导致肾损伤;但I/R+Cur组镜下可见肾间质内炎症细胞浸润明显减少,仅偶可见管腔内管型出现;并且Notch2受体蛋白和靶分子Hes-1 mRNA表达均下降;TNF-α和IL-1β释放远远低于I/R组。实验结果证实,姜黄素后处理很可能锚定于上游Notch2受体蛋白作为其作用靶点,抑制Notch2受体蛋白的胞内端裂解产生胞内段NICD,继而间接地抑制NICD进入细胞核,下调下游Hes-1 mRNA转录基因的表达,从而抑制下游炎症因子TNF-α和IL-1β的释放,最终实现下调Notch2/Hes-1信号通路,对肾脏产生保护性作用。
综上所述,姜黄素后处理可减轻大鼠缺血再灌注肾损伤,其作用机制可能与下调Notch2/Hes-1信号通路有关。

