西藏热泉1株产纤维素酶真菌的鉴定及产酶条件优化
卢雨欣,赵航轲,唐小飞,刘开辉,2,邓百万,3,丁小维,2
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.陕西科技大学 食品与生物工程学院,陕西 西安 710021; 3.陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
纤维素是世界上较丰富、分布较广的可再生生物质资源,每年的生成量高达1.0×1011t,相当于年消耗生物资源的20多倍[1-4]。粗略估计,世界范围内有89%的植物生物质资源未被利用[5],通常作焚烧处理,进而造成了资源的大量浪费及各种环境问题[6-7]。纤维素主要依赖于羧甲基纤维素酶进行水解[8-9]。由于真菌分离的纤维素酶具有酶系统完整、易于纯化的优点,目前的研究对象主要集中于真菌产纤维素酶[10]。然而大部分产纤维素酶真菌不具耐高温等特点,严重制约了其在生产上的应用。因嗜热真菌在高温环境下仍可产生纤维素酶,已经成为研究中的热点。
嗜热真菌是一类特殊的真菌,其生长温度最低20 ℃,最高50 ℃[11]。主要存在于温泉、堆肥、火山等各种高温环境,且这些特殊的环境使得嗜热真菌对高温表现出较强的适应能力,形成了特殊的代谢机制。嗜热真菌所产的酶通常更具有耐热性,甚至在高温下依然能保留部分活性,具有生产应用潜力[12]。其中,嗜热纤维素酶在食品[13]、酿酒[14]、纺织洗涤[15]、农业和环境保护[16]等方面得到了广泛应用。目前,国内外报道的产纤维素酶嗜热真菌仅有ThermotogamaritimeMSB8[17]、Thermotoganeapolitana[18]、AspergillusfumigatusZ5[19]、Gladaxporismsp.SCSIO 43503[20]等。鉴于此,本研究从西藏尼木热泉沉积物中筛选具有产纤维素酶能力的嗜热真菌,对其产酶培养基及发酵条件进行初步优化,为后续嗜热纤维素酶资源的开发利用奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试菌株 从西藏尼木热泉沉积物中分离得到的1株嗜热真菌。
1.1.2 培养基 刚果红培养基[21]:(NH4)2SO42.0 g/L、K2HPO41.0 g/L、MgSO4·7H2O 0.5 g/L、NaCl 0.5 g/L、羧甲基纤维素钠2.0 g/L、刚果红0.4 g/L、琼脂22.0 g/L,pH值自然;PDA培养基:去皮马铃薯200.0 g/L、葡萄糖20.0 g/L、琼脂18.0 g/L,pH值自然;基础发酵培养基:羧甲基纤维素钠20.0 g/L、蛋白胨6.0 g/L、K2HPO42.0 g/L、MgSO4·7H2O 0.5 g/L,pH值自然。
1.2 方法
1.2.1 菌株筛选 嗜热真菌在45 ℃下培养,观察刚果红培养基上透明圈大小,初步判断产酶活性。
1.2.2 菌株鉴定 将筛选所得的产纤维素酶菌株接种于PDA培养基,在45 ℃下培养,观察其形态特征。同时采用插片法观察其显微形态,结合参考文献[22]进行初步鉴定。
利用CTAB[23]法提取真菌DNA,真菌引物(ITS1/ITS4)进行PCR扩增。扩增产物送至生工生物工程(上海)股份有限公司测序。所得序列在NCBI中进行比对,利用Mega 7软件进行邻接(NJ)树的构建。
1.2.3 纤维素酶活力测定 葡萄糖标准曲线(Y=0.412 5X+0.045 8,R2= 0.999 8)参照文献[24]进行绘制。其中,Y代表葡萄糖含量,X代表酶解反应产物显色后的吸光值。
纤维素酶活力测定[25]:将粗酶液进行适当稀释,取0.5 mL加1.5 mL 0.5%羧甲基纤维素钠溶液,50 ℃水浴30 min,加入二硝基水杨酸(DNS)试剂3 mL终止反应,沸水浴5 min,冷却定容,测OD540值。酶活力单位:该条件下1 mL酶液水解1 min生成1 μg葡萄糖的酶量(U/mL)。
1.2.4 产纤维素酶菌株培养基组分的优化 菌株活化:将斜面菌株接种至PDA培养基上,45 ℃培养5 d。
碳源筛选:将活化菌株取0.5 mm2小块分别接种至用淀粉、乳糖、玉米芯粉、稻草粉替代羧甲基纤维素钠的基础发酵培养基中,各组分含量不变,45 ℃、150 r/min发酵3 d,测定纤维素酶活力,筛选最佳碳源,并进一步筛选出最适含量。
氮源筛选:将活化菌株取0.5 mm2小块分别接种至用酵母粉、NH4Cl、NH4NO3和(NH4)2SO4替代蛋白胨的基础发酵培养基中,各组分含量不变,45 ℃、150 r/min发酵3 d,测定纤维素酶活力,筛选出最佳氮源,并进一步筛选出最适含量。
正交法优化培养基组分:在单因素基础上,以乳糖(A)、(NH4)2SO4(B)、K2HPO4(C)、MgSO4·7H2O(D)作为 4个影响产纤维素酶培养基组分的因素,正交试验方案如表1所示。

表1 产纤维素酶菌株培养基组分优化的正交试验方案Tab.1 Orthogonal experimental design for optimal medium of cellulase producing strain g/L
1.2.5 产纤维素酶菌株发酵条件的优化 选取发酵温度(41、45、49、53、57、59 ℃)、起始pH值(4.5、5.5、6.5、7.5、8.5)、发酵时间(2、3、4、5、6、7 d),检测各因素对菌株产纤维素酶活力的影响,初步确定发酵条件。
正交法优化发酵条件:在单因素基础上,以发酵温度(A)、起始pH值(B)、发酵时间(C)作为3个影响产纤维素酶发酵条件的因素,设计三因素三水平正交试验方案,如表2所示。

表2 产纤维素酶菌株发酵条件优化的正交试验方案Tab.2 Orthogonal experimental design for optimal fermentation condition of cellulase producing strain
1.2.6 数据分析 采用SPSS 22.0进行数据分析。
2 结果与分析
2.1 产纤维素酶菌株的筛选及鉴定
2.1.1 产纤维素酶菌株的筛选 菌株THN8在刚果红培养基上的透明圈直径为30 mm,菌落直径为6 mm,直径差为24 mm(图1)。

图1 产纤维素酶菌株THN8的筛选Fig.1 Screening of cellulase producing strain THN8
2.1.2 菌株形态特征 菌株THN8于45 ℃下在PDA培养基上生长迅速,3 d满皿,菌丝纤细、白色似网状,粗壮菌丝偶有螺旋环状形成,且表面湿润(图2A);观察显微形态发现,菌丝分枝无隔,在菌丝顶端或中部膨大形成卵圆形产孢结构,并有浅层气生菌丝附着表面(图2B),与JATINDER等[22]所描述的Melanocarpussp.形态特征相似。因此,该菌株初步被鉴定为Melanocarpussp.。
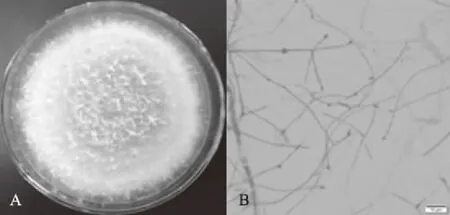
A:菌落形态; B:显微形态A:Strain colony morphology; B:Microscopic morphology图2 菌株THN8的形态特征Fig.2 Morphological characteristics of strain THN8
2.1.3 菌株系统发育分析 将菌株THN8所测得序列与NCBI数据库进行比对,其与Melanocarpusalbomyces(NR145150)和Melanocarpusalbomyces(KX976679)序列的相似性≥99%,且在系统发育树中与Melanocarpusalbomyces聚于同一个分支上,其自展支持率为100%。因此,该菌株被鉴定为Melanocarpusalbomyces(图3)。
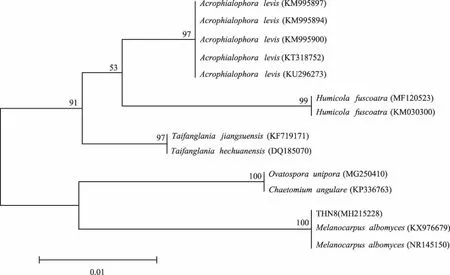
图3 菌株THN8的ITS序列系统发育树Fig.3 ITS phylogenetic tree of strain THN8
2.2 菌株THN8培养基组分优化
2.2.1 碳源 5种供试碳源均能诱导菌株THN8产生纤维素酶(图4),其中,以乳糖为唯一碳源时,菌株THN8产纤维素酶活力最高,为3.8 U/mL,所以确定乳糖为最佳碳源。乳糖的最适质量浓度为90 g/L(图5)。

图4 不同碳源对菌株THN8产纤维素酶活力的影响Fig.4 Effects of different carbon sources on cellulase activity of strain THN8

图5 不同乳糖含量对菌株THN8产纤维素酶活力的影响Fig.5 Effects of different lactose contents on cellulase activity of strain THN8
2.2.2 氮源 5种供试氮源均能诱导菌株THN8产生纤维素酶(图6),其中,以(NH4)2SO4为唯一氮源时,菌株THN8产纤维素酶活力最高,为4.2 U/mL,所以确定(NH4)2SO4为最佳氮源,其最适质量浓度为6 g/L(图7)。
2.2.3 菌株THN8产纤维素酶培养基组分的正交试验优化 由表3中R值(极差)可知,乳糖(A)、(NH4)2SO4(B)、K2HPO4(C)、MgSO4·7H2O(D) 4个因素对产纤维素酶活力影响的大小顺序为A>B>C=D,但B与C、D基本接近。正交试验表明,最佳产纤维素酶培养基方案为A3B2C3D3。对表3中各因素进行方差分析, 如表4所示,4个因素均达到极显著水平,其对产酶活力影响的大小顺序为,A>B>D>C,因素A对产纤维素酶活力影响最大,因素B、C、D基本接近,与极差分析结果基本一致。因此确定最佳配方为乳糖 92.0 g/L、(NH4)2SO46.0 g/L、K2HPO43.0 g/L、MgSO4·7H2O 0.55 g/L。

图6 不同氮源对菌株THN8产纤维素酶活力的影响Fig.6 Effects of different nitrogen sources on cellulase activity of strain THN8
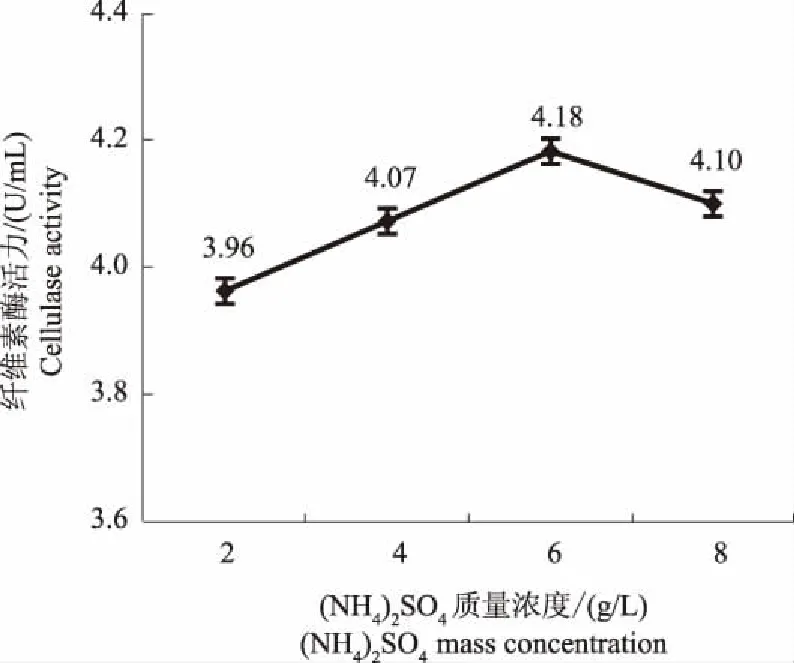
图7 不同(NH4)2SO4含量对菌株THN8产纤维素酶活力的影响Fig.7 Effects of different (NH4)2SO4 contents on cellulase activity of strain THN8
2.3 菌株THN8发酵条件优化
2.3.1 发酵温度 由图8可知,菌株THN8产纤维素酶活力在发酵温度41~57 ℃时处于逐步上升状态,在57 ℃时,菌株THN8产纤维素酶活力达到最大,为25.8 U/mL,此后开始下降。因此,发酵温度初步确定为57 ℃。
2.3.2 起始pH值 由图9可知,菌株THN8产纤维素酶活力在起始pH值 4.5~5.5时处于上升状态,在起始pH值为5.5时,菌株THN8产纤维素酶活力达到最高,为22.6 U/mL,此后持续下降。因此,起始pH值初步确定为5.5。

表3 菌株THN8产纤维素酶培养基组分优化正交试验结果Tab.3 Orthogonal experimental results for optimal medium of cellulase producing strain THN8
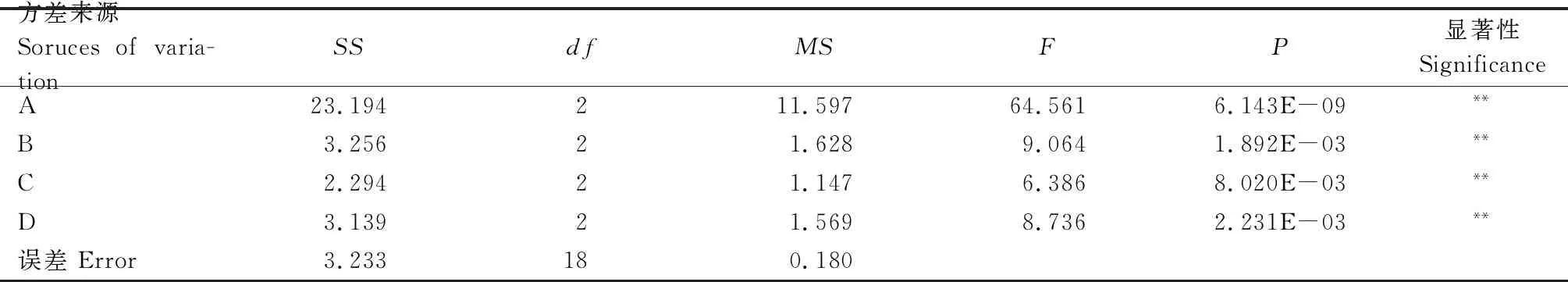
表4 菌株THN8产纤维素酶培养基组分优化正交试验的方差分析Tab.4 Analysis of variance of orthogonal experiment for optimal medium of cellulase producing strain THN8
注:**表示该因素的影响达到极显著水平(P<0.01),*表示该因素的影响达到显著水平(P<0.05),下同。
Note :** indicate the influence of this factor is extremely significant(P<0.01),and * indicate the influence of this factor is significant(P<0.05),the same below.
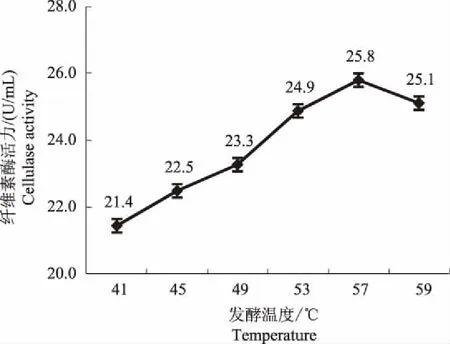
图8 不同发酵温度对菌株THN8产纤维素酶活力的影响Fig.8 Effects of different temperature on cellulase activity of strain THN8
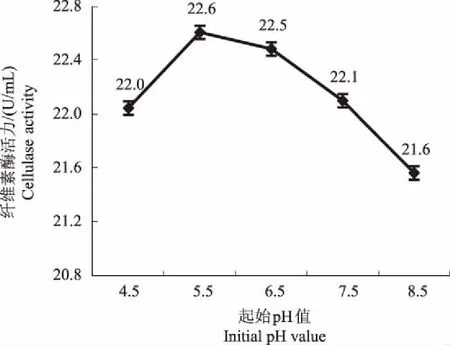
图9 不同起始pH值对菌株THN8产纤维素酶活力的影响Fig.9 Effects of different initial pH value on cellulase activity of strain THN8
2.3.3 发酵时间 由图10可知,菌株THN8产纤维素酶活力在发酵2~5 d时处于稳步上升状态,在发酵5 d时,菌株THN8产纤维素酶活力达到最高,为23.9 U/mL,发酵5~7 d时,菌株THN8产纤维素酶活力下降后又趋于保持平稳。因此,发酵时间初步确定为5 d。
2.3.4 菌株THN8产纤维素酶发酵条件的正交试验优化 由表5中R值可知,发酵温度(A)、起始pH值(B)、发酵时间(C)3个因素对产酶活力影响的大小顺序为A>B>C。正交试验表明:3个因素的最佳水平组合为A3B2C1,在该组合条件下,产纤维素酶活力最高,为28.1 U/mL。对表5中各因素进行方差分析,结果如表6所示,3个因素对产纤维素酶活力影响的大小顺序为A>B>C,与极差分析结果一致。因此,最终确定菌株THN8产纤维素酶发酵条件的最佳组合为发酵温度58 ℃、起始pH值 5.5、发酵时间4 d。

图10 不同发酵时间对菌株THN8产纤维素酶活力的影响Fig.10 Effects of different fermentation time on cellulase activity of strain THN8
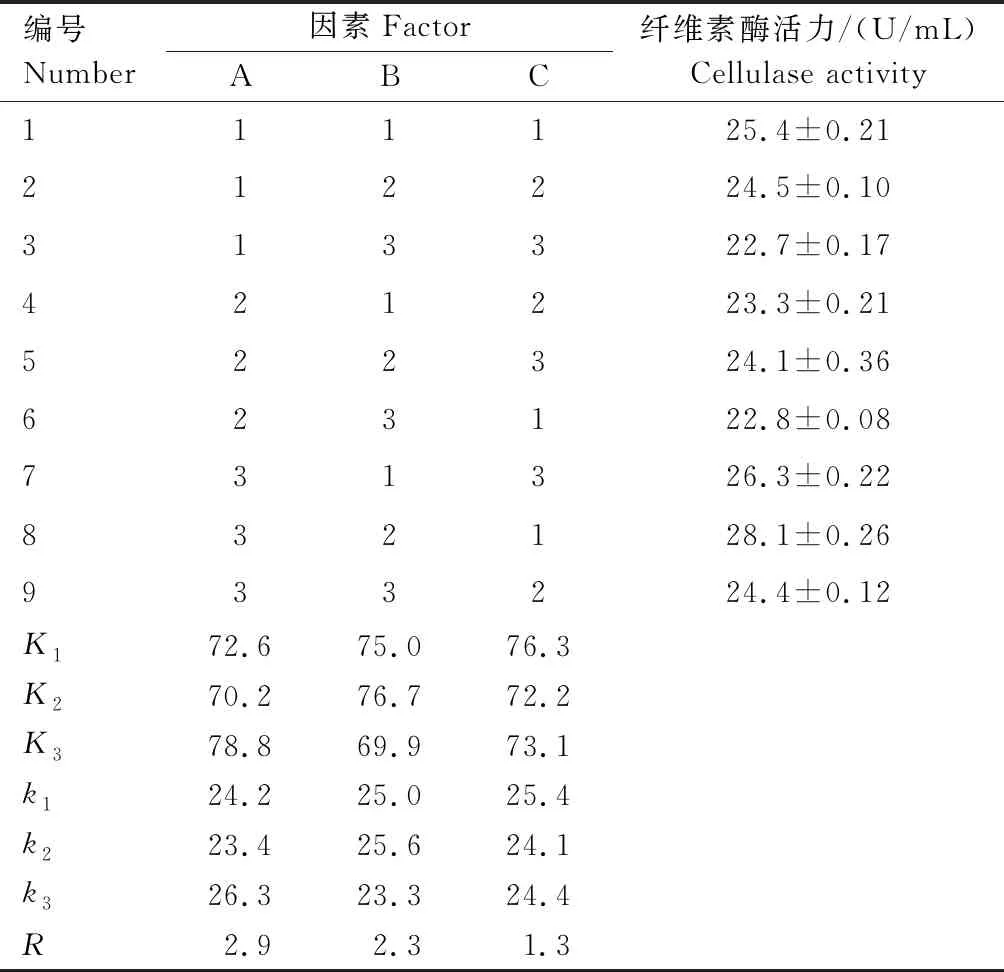
表5 菌株THN8产纤维素酶发酵条件优化正交试验结果Tab.5 Orthogonal experimental results for optimal ferme-ntation condition of cellulase producing strain THN8

表6 菌株THN8产纤维素酶发酵条件优化正交试验的方差分析Tab.6 Analysis of variance of orthogonal experiment for optimal fermentation condition of cellulase producing strain THN8
3 结论与讨论
本研究从西藏尼木热泉嗜热真菌中筛选出1株产纤维素酶菌株THN8,根据形态学和ITS序列分析将该菌株鉴定为Melanocarpusalbomyces。菌株产纤维素酶的最佳培养基配方为乳糖 92.0 g/L、(NH4)2SO46.0 g/L、K2HPO43.0 g/L、MgSO4·7H2O 0.55 g/L,最佳发酵条件为发酵温度58 ℃、起始pH值5.5、发酵时间4 d,在该条件下菌株THN8产纤维素酶活力为28.1 U/mL。
产纤维素酶嗜热真菌与一般真菌相比,其在高温发酵过程中纤维素酶活力较稳定或下降较慢,同时较高的温度也可在发酵过程中降低污染,因此嗜热真菌产纤维素酶可以在生产中广泛应用。金伟等[26]从土壤中分离出耐热烟曲霉XT3,产纤维素酶活力为3.836 U/mL;严芬等[27]从造纸厂污泥中筛选出土曲霉XM5,产纤维素酶活力为4.3 U/mL;赵旭等[28]从双孢菇培养料中分离筛选得到降解纤维素的耐高温芽孢杆菌属菌株X3,产纤维素酶活力为20.36 U/mL。本研究从西藏尼木热泉中分离得到的产纤维素酶嗜热真菌THN8,通过培养基及发酵条件优化,其产纤维素酶活力达到28.1 U/mL,与上述报道的菌株相比,菌株THN8产纤维素酶活力更高,热稳定性更好,在生产中具有广阔的应用潜力,可以在降解利用纤维素类农业废弃物方面进一步开发利用。

