间充质干细胞治疗克罗恩病肛瘘的研究进展
张国兴,石 荣,陈昌捷,梁瑞文
克罗恩病(crohn' s disease, CD)是一种发病机制尚未明确的慢性炎症性肠病,病变多位于回肠末端,主要临床症状是腹痛、腹泻和黏液脓血便。瘘管是其主要的肠道并发症之一,并且大部分为复杂性肛瘘,易反复,明显影响患者生活质量。已发表的流行病学研究[1-2]表明,至少26%的患者在诊断CD后的前20年内会并发肛瘘,尤其是病变位于结肠和直肠的患者。联合用药和手术在CD肛瘘(perianal fistulizing crohn' s disease, PFCD)治疗中具有很好的疗效,但并未达到瘘管长期愈合,并且不能充分改善患者的生活质量,常引起脓血症、肛门狭窄和失禁等并发症。因此,需要新兴和改进的治疗方法。间充质干细胞(mesenchymal stem cells, MSC)是一种非造血功能的多能干细胞,能够下调免疫反应并促进组织愈合,其在抗炎治疗、组织再生及自身免疫性疾病等方面的治疗作用已得到证实。近年研究表明,MSC在治疗PFCD方面具有一定的安全性和有效性,有广泛的应用前景。本文就MSC在PFCD治疗中的应用作一综述。
1 MSC的作用机制
MSC具有免疫调节和抗炎作用,抑制T细胞分裂增殖,阻断T细胞周期,使T细胞停留在G0/G1期[3]。MSC可抑制B细胞的增殖和分化[4-5],对多能造血干细胞树突细胞(dendritic cell,DC)分化和树突状细胞的成熟也有一定的抑制作用[6-7]。MSC可影响DC的募集、成熟、迁移和活化T细胞的能力,诱导促炎性的M1型巨噬细胞转化为抗炎性的M2型巨噬细胞[8]。MSC可明显减少促炎因子如肿瘤坏死因子(tumor necrosis factor,TNF)和白细胞介素-1β(interleukin-1β,1L-1β)的分泌,促进抗炎因子白细胞介素-10的表达[9]。MSC通过增加CD4+Th2淋巴细胞及CD4+,调节的T淋巴细胞的相对比例,从而抑制CD8+细胞毒性T淋巴细胞的活性,有利于促进促炎作用并抑制T淋巴细胞介导的免疫反应[10]。
MSC能选择性地迁移到组织损伤和炎症的部位[11-12],帮助组织修复。有研究表明[13],MSC在注射后停留在结肠中至少15天。MSCs被分化成各种细胞类型,进入损伤和炎症的组织中促进组织修复和黏膜愈合。目前尚未有关于MSC对PFCD的确切作用机制的研究,但从MSC在免疫调节过程中的作用来看,MSC能够抑制DC的成熟,间接地防止了T细胞的活化,亦能直接对T细胞起作用。同时能抑制NK细胞的细胞毒性,还对B细胞、单核巨噬细胞系统、补体系统、Treg等起作用。正是因为这些特点,MSC成为了治疗PFCD的新兴治疗手段。
2 MSC在PFCD治疗中的应用
2.1 MSC治疗PFCD的临床试验 目前已有11项Ⅰ~Ⅲ期临床研究[14-24]证实,MSC治疗PFCD的疗效和安全性(表1),超过半数患者达到完全缓解。3项研究[16,21,23]表明,与对照组相比,MSC治疗在6至24周和24至52周终点时,治愈率均明显提高。在治疗过程中,不良反应主要是肛周疼痛、肛周脓肿,无其他明显的不良反应发生。2018年的一项Meta分析和系统评价[25]表示,MSCs治疗PFCD的疗效明显优于对照组,且仅出现了轻度不良事件。总之,无论MSCs的来源、剂量和给药方式如何,研究结果均证实了MSC用于PFCD治疗的有效性和安全性。
2.2 临床应用MSC的来源 MSC来源广泛,可以从骨髓、脂肪组织、脐带、胎盘或大多数器官的结缔组织中分离[26-27]。在目前的研究中[14-15,21-22,28],治疗CD肛瘘的细胞来源大多是脂肪组织,仅有2项研究[20,23]的细胞来源是骨髓组织,可能是由于脂肪组织在临床上相比骨髓组织更容易取得。Ribeiro等[28]学者研究表明,相比与脐带来源和骨髓来源的MSC,脂肪来源MSC对T细胞的免疫抑制作用最强。相反,Xishan等[29]表明,骨髓来源MSC对T淋巴的免疫抑制作用强于脂肪来源MSC。此外,Li等[30]证实,脂肪组织和脐血MSC对T细胞的抑制作用优于骨髓MSC。对于不同来源的MSC所带来的疗效和安全性的差异,仍需更多的临床研究加以证实。
自体细胞相比异体细胞而言,理论上具有较低的排斥性和较好的耐受性,但在治疗过程中,自体细胞的抽取会延缓治疗的进程,而异体MSC则避免了这个问题。目前,尚未有临床研究进行比较自体与异体细胞之间的愈合率。另外,有研究[31-32]表明,由于同种异体间充质干细胞具有较低的人白细胞抗原Ⅰ类表达水平,且缺乏Ⅱ类或共刺激分子(CD80,CD86或CD40),所以同种异体MSCs可能不会产生临床相关的抗体,阻碍后续使用的疗效。
2.3 MSC的临床应用剂量和频率 11项Ⅰ~Ⅲ期临床研究[14-24]的剂量和频率都不同。在Molendijk等[23]学者的研究中,局部注射10×106或30×106或90×106MSC进行临床比较,结果表明,最有效的剂量是30×106MSC。Cho等[17]的研究是基于瘘管长度注射9×10~12×107MSC,Lee等[18]学者的研究是Cho等学者研究的延伸。Lee等人发现,基于瘘管长度注射MSCs,第一次注射时的平均剂量为15.8×107MSC时,治愈率最佳。此外,在Panes等[22]的大型Ⅲ期临床研究表明,增加的细胞数量与瘘管愈合的速率无关。
目前尚无研究表明MSCs在炎症部位停留时间长短,有研究[33]发现,在MSCs注射的第5天,可在肠道炎症区域被检测到。也有研究[34-35]发现,MSCs在注射后第一周,肠道组织的追踪分析每次均能发现在肠道炎症区。总之,重复注射可能是有利的,未来的研究应该解决,在治疗过程中,重复注射MSCs或基于瘘管长度递送MSCs的数量,能否提高治疗效果。
2.4 MSC的临床应用途径 大量研究[14-23]证实,局部注射是治疗PFCD的有效途径。同时,自体MSC附着于可吸收的基质并置入瘘管,也是治疗PFCD的有效途径。2017年,Dietz等[24]的Ⅰ期临床研究是利用应用生物可吸收的基质吸附MSCs,递送至瘘管中。其原理的将脂肪组织提取的间充质干细胞进行培养,之后将细胞接种至生物支架上继续培养。等支架上增殖足够多的干细胞之后,将支架填充至瘘管内。研究结果表明,12名患者中,有9名在3个月内达到临床治愈,10名在6个月达到临床治愈。此外,也有研究[16]是利用肛瘘栓或纤维蛋白胶与MSCs结合递送到瘘管。2018年的Meta分析[25]中表示,MSCs与纤维蛋白胶结合注射的治愈率为71%,与肛瘘栓结合注射的治愈率为83%,直接注射的治愈率为50%。相比于直接注射而言,利用生物支架递送的方式会优于直接注射,这可能是因为生物支架材料能让MSCs停留在瘘管中。未来还需要更多的临床研究比较MSC不同的应用途径的疗效和安全性。
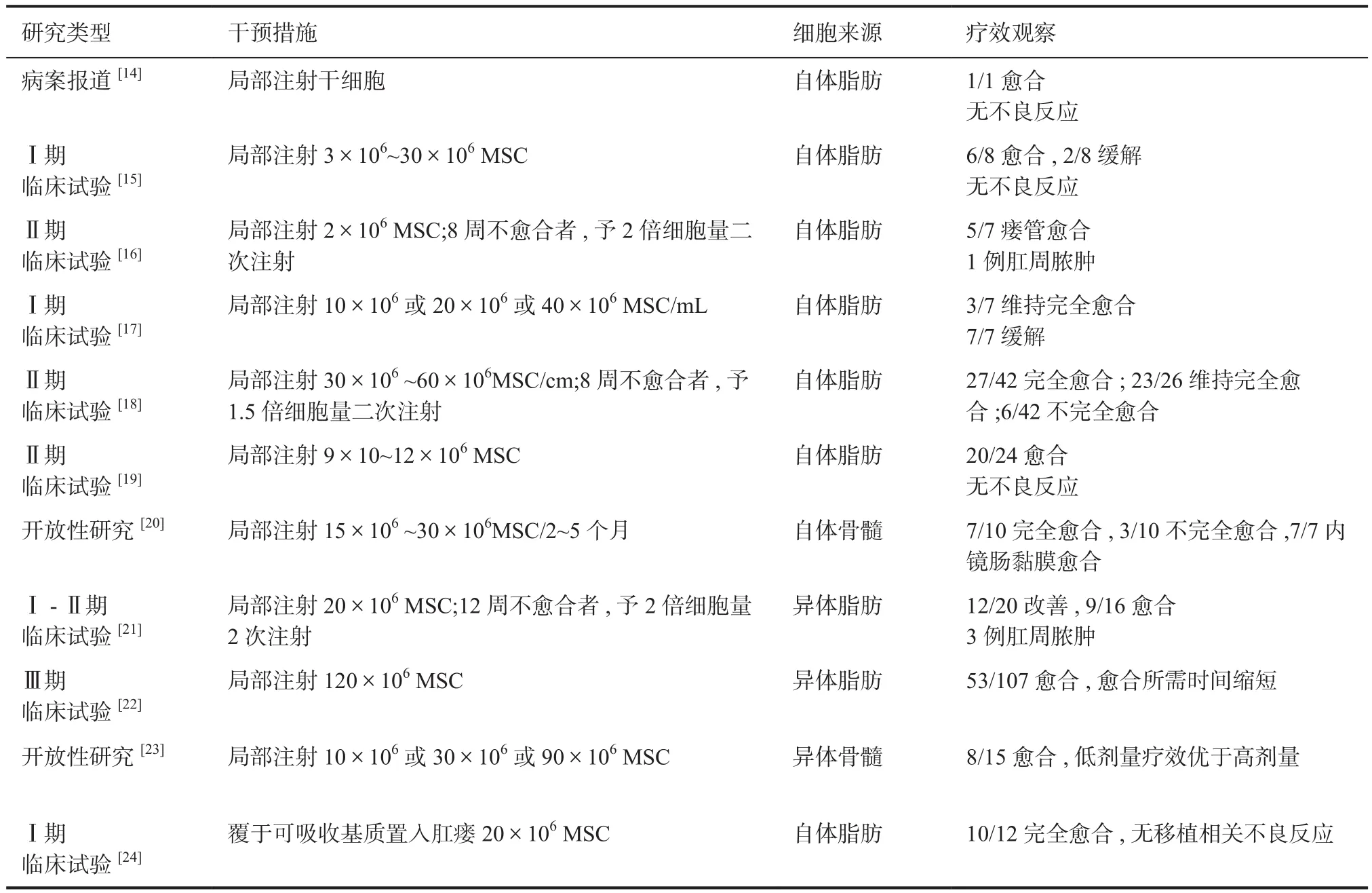
表1 MSC治疗CD并发肛瘘的临床试验
3 MSC治疗PFCD存在的问题和未来展望
总体而言,MSC治疗PFCD的安全性较高,2018年的Meta分析[25]中表示,大多数的不良反应是肛周脓肿、疼痛,无严重不良反应。其次,MSC的免疫调节机制极其复杂,其是否具有潜在的致癌作用目前尚未明确。一方面,干细胞具有癌基因激活、抑癌基因失活的典型肿瘤细胞特征,且MSC分泌的一些趋化因子可增加肿瘤细胞的增殖和转移。2018年的Ma[36]和Liu等[37]学者的动物研究表明,MSC可促进肿瘤的进展。另一方面,MSC可能减少肿瘤细胞在体内的凋亡。Ayuzawa等[38]研究表明,MSC可以明显减缓人乳腺癌细胞的生长速度,有望成为抗肿瘤治疗的新手段。在本次纳入的11项研究中,Portilla等[21]报道了1例子宫平滑肌瘤,但考虑到子宫平滑肌瘤为多因素共同作用的结果,所以该研究未揭示MSC治疗具有致癌风险。未来,在MSC治疗中的安全性仍需更多的临床研究加以证实。
再次,MSC技术方案方面使用自体组织还是异体组织、最佳剂量、局部注射还是附着于生物支架、注射的频率和间隔时间等问题,均需要循证医学证据来给出答案。为了确保MSC临床应用的规范性,亟需制订标准化的临床治疗方案。
最后,明确MSC治疗PFCD的确切机制,是未来需要解决的一个大问题,这将会优化未来治疗时的干预措施。
综上所述,MSC代表了复杂肛瘘的一种新型微创替代方案,可以减少PFCD患者对于系统性免疫抑制或手术的需求,同时避免了肛门失禁、狭窄等并发症。虽然在临床试验研究中肯定了MSC的疗效和安全性,但是由于研究之间对肛瘘的临床愈合标准不统一,存在明显的异质性,且缺乏治愈后的随访,对于术后复发的概率无统计学数据。在未来的研究中,尽量达成瘘管愈合的标准化定义及临床治疗的标准化方案。随着对MSC的不断探索,其生物学特点和免疫调节能力将为治疗PFCD提供新的思路和方法。

