腹腔镜ISR术治疗超低位直肠癌的疗效及对肛门功能的影响
梁磊,赵德明
直肠癌在恶性肿瘤中为常见疾病之一,具有较高的患病率与死亡率,其中以超低位直肠癌最为常见,在全部直肠癌中占比75%,超低位直肠癌为肿瘤下缘与肛缘距离<5 cm的一类直肠肿瘤[1]。当前临床仍以外科手术切除为主要的治疗方式,传统的低位前切除术虽能治疗超低位直肠癌,但对患者生活质量等造成严重的影响。随着临床对超低位直肠癌的不断深入研究及医疗技术的不断进步,使得该疾病的治疗方式在有效保留患者肛门功能的同时还可显著改善患者生活质量。经括约肌间切除(intersphincteric resection,ISR)术为近几年新兴的超低位直肠癌保肛术之一,在治疗超低位直肠癌保肛根治治疗中虽能取得较为显著的治疗效果,但该治疗方式在腹腔镜下的研究却相对较少[2]。故本研究对腹腔镜ISR术治疗超低位直肠癌进行了研究分析,旨在探讨腹腔镜ISR术在超低位直肠癌中的应用效果,并以此为临床治疗提高可靠的依据,现将结果报道如下。
1 资料与方法
1.1 一般资料
本次研究对象选取2013年1月至2016年1月来两院进行诊治的超低位直肠癌患者80例,采用随机数字表法将所选病例分为治疗组与对照组,各40例。治疗组中,男21例,女19例,年龄35~65岁,平均(50.3±6.9)岁;病程1个月至5年,平均(2.2±0.3)年;瘤肛距(2.3±1.1)cm;肿瘤直径(2.5±0.7)cm;TNM分期Ⅰ期28例,Ⅱ期9例,Ⅲ期3例。对照组中,男22例,女18例,年龄36~66岁,平均(51.4±7.1)岁;病程2个月至6年,平均(3.3±0.4)年;瘤肛距(2.4±1.2)cm;肿瘤直径(2.6±0.8)cm;TNM分期Ⅰ期26例,Ⅱ期10例,Ⅲ期4例。两组性别、年龄、病程、瘤肛距、肿瘤直径及TNM分期等一般资料均无统计学差异(P>0.05),具有分组研究价值。
1.2 入选标准
1.2.1 纳入标准 ①符合《结直肠癌诊疗规范》[3]中有关超低位直肠癌的相关诊断标准;②患者经病理检查确诊为超低位直肠癌;③肿瘤与肛缘距离<5 cm,肿瘤下缘与齿状线距离<1 cm;④无胃肠道相关手术史者;⑤经腔内超声、MRI及盆腔CT检查显示,患者肿瘤为T1-T2期,不宜通过肛局部做切除者;⑥未发现患者耻骨直肠肌与肛门括约肌有损害情况;⑦本研究经两院医学伦理委员会批准,患者及家属签署知情同意书。
1.2.2 排除标准 ①肿瘤出现远处转移、穿透肌层者;②肛门括约肌功能出现障碍者;③治疗依从性差者;④无法顺利完成手术者。
1.3 治疗方法
1.3.1 治疗组 本组患者行腹腔镜ISR术治疗。患者全麻后,在脐下缘开10 mm的孔,将腔镜放入,在患者左下腹及右下腹分别开5 mm及10 mm的孔以便于将手术器械放入;对其行CO2气腹,保持患者腹腔内压力为12~14 mmHg,充分分离肠系膜下静脉与下动脉,将肠系膜下动脉根部结扎离断(图1),顺着直肠前间隙Denonvillier筋膜与直肠后间隙Waldeyar筋膜表面对直肠侧方与前壁做充分游离(图2),同时确保直肠的完整性,对盆腔神经及输尿管做好保护措施,向上分离内外括约肌时,应采用抓钳在肛提肌与直肠交角处进行指引,以准确切除患者直肠[4]。
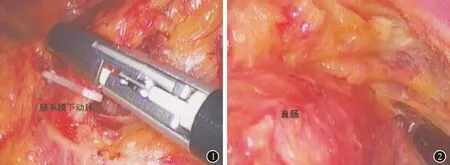
图1 肠系膜下动脉根部结扎离断 图2 直肠侧方与前壁游离
1.3.2 对照组 本组患者行低位前切除术。患者全麻后,在其下腹部正中位置做切口,将肠系膜下动脉与肠系膜下静脉进行结扎,并在离肿瘤上缘10~15 cm位置将乙状结肠与相应的系膜进行切除,顺着直肠前间隙Denonvillier筋膜及直肠后间隙Waldeyer筋膜表面对直肠做充分游离,顺着坐骨结节间将肛门移向盆腔内3~4 cm;术者对患者直肠裂孔清楚观察后,对肛提肌施压,并充分分离内外括约肌,切除直肠[5]。
1.4 观察指标
①观察两组患者手术指标,包括手术时间、术中出血量。②观察两组患者恢复情况,包括饮食恢复正常时间、肠功能恢复正常时间及住院时间。③记录两组患者术后吻合口瘘、肠梗阻、切口疝等并发症发生情况;④采用压力换能器与高分辨率多通道胃肠功能检测系统(由瑞典CTD-SYNEC-TICS公司提供)对两组患者术前、术后1个月及6个月的肛门功能进行检测,包括肛管最大收缩压、肛管最大静息、直肠顺应性及直肠便意感觉容量;⑤随访观察两组患者术后1年预后情况,对两组术后1年的排便控制情况采用Kirwan分级进行评价;其中,以控便良好为Ⅰ级,难以控制排气为Ⅱ级,偶有粪污为Ⅲ级,粪污频繁为Ⅳ级,便失禁为Ⅴ级。同时,随访调查两组患者复发、癌变转移及死亡情况。
1.5 统计学方法
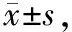
2 结果
2.1 两组手术指标比较
治疗组手术时间长于对照组(P<0.01);而术中出血量显著少于对照组(P<0.01),见表1。
2.2 两组术后恢复情况比较
治疗组饮食恢复正常时间、肠功能恢复正常时间及住院时间均明显短于对照组,差异具有统计学意义(P<0.01),见表2。

表1 两组手术指标比较

表2 两组患者术后恢复情况比较
2.3 两组并发症发生率比较
治疗组术后出现吻合口瘘、肠梗阻及切口疝等并发症发生率为7.50%,显著低于对照组的25.00%,两组比较,差异具有统计学意义(P<0.05),见表3。
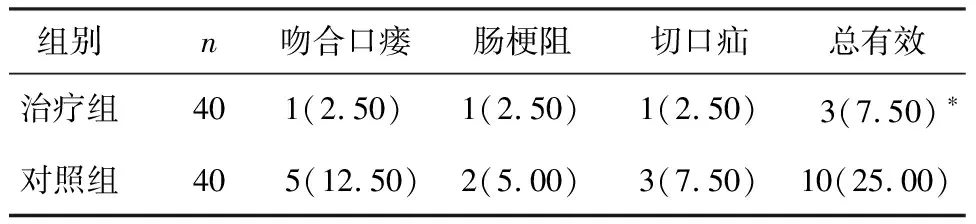
表3 两组治疗效果比较 [n(%)]

2.4 两组不同时间段肛门功能恢复情况比较
经重复测量方差分析结果显示,两组不同时间段肛肠功能肛管最大收缩压、肛管最大静息压、直肠顺应性、直肠便意感觉容量比较差异具有统计学意义(P<0.01);术后1个月两组肛肠各测量指标比较差异无统计学意义(P>0.05);术后6个月两组肛肠各测量指标比较差异具有统计学意义(P<0.01);经组间两两比较结果显示,两组术后1个月肛门功能各指标较均显著术前降低,两组术后6个月肛门功能各指标逐渐升高,治疗组术后6个月肛门功能指标各指标与术前比较无显著性差异(P>0.05);对照组术后6个月肛门功能各指标仍显著低于术前(P<0.01),见表4。
2.5 两组预后情况比较
两组患者术后随访1年,治疗组排便控制情况显著优于对照组(P<0.05),1年内两组均无复发、癌变转移及死亡情况,见表5。

表4 两组不同时间段肛门功能恢复情况比较
注:*与术前比较,P<0.01,#与术后1个月比较,P<0.01;△与对照组比较,P<0.01

表5 两组1年后排便控制情况(Kirwan分级)比较 [n(%)]
注:两组比较,Z=-3.512,P=0.000
3 讨论
直肠癌为一种胃肠道肿瘤,其患病率仅次于食道癌与胃癌,其中以超低位直肠癌最为多见,其是指腹膜返折以下的直肠[7]。在我国,超低位直肠癌的患病率极高,且多数患者发现时已属中晚期,失去了最佳的治疗时机。当前,手术治疗为超低位直肠癌的主要治疗手段,其能有效切除病变部位,延长患者生命,有效改善其生活质量。
肛管括约肌的组成包括两部分互相重叠的管状肌结构。外部肌构成为盆底诸横纹肌,包括耻骨直肠肌、外括约肌及肛提肌[8];内部肌为直肠平滑肌的延续,于直肠末端逐渐变厚,并缓慢形成环形肌,其在外部肌头侧,并止于齿状线1.5 cm位置[9]。IRS术的要点在于通过患者腹部并根据TME原则对其直肠做充分游离,使之到达肛提肌平面,再在括约肌沟处将肛管皮肤切开,吻合结肠-肛管[10-11]。采用IRS术治疗,可有效保护患者肛管括约肌环与肿瘤下缘正常肠管切除距离[12]。腹腔镜术能将手术区域进行放大,从而使术者准确观察盆腔植物神经丛,以此有效保护患者泌尿生殖功能与肛门[13]。腹腔镜能充分显露盆腔较为狭窄区域,使术者能充分分离盆腔深部近提肛肌水平[14]。腹腔镜术中所使用的器械能减小对组织的伤害,降低患者出血量,以此有效提高保肛可能性[15]。腹腔镜ISR术治疗超低位直肠癌具有如下优势:①腹腔镜ISR术为一种微创手术,创伤小,出血量及术后并发症少,患者痛苦小,术后恢复快;②采用腹腔镜能使术者在较为狭小的小骨盆内做相关操作,可对直肠至盆腔做更深入的分离,以此促进ISR操作[16-17];③腹腔镜ISR术通过腹腔镜对患者直肠做充分游离,并通过肛门切除患者直肠,对患者造成的创伤较小,充分符合微创的治疗方式[18];④通过腹腔镜治疗超低位直肠癌可更准确、更有效的辨别与保护患者盆腔植物神经从,改善其预后情况促进患者术后肛门功能的恢复[19]。本次研究结果显示,治疗组手术时间长于对照组,术后出血量少于对照组,治疗组饮食恢复正常时间、肠功能恢复正常时间及住院时间均明显少于对照组,治疗组术后出现现吻合口瘘、肠梗阻及出血等并发症发生率(7.50%)显著低于对照组(25.00%),表明治疗组经超低位直肠癌经腹腔镜ISR术治疗手术时间略长,但出血量少,术后恢复快,且并发症发生率低,有利于术后病情恢复,其中手术时间略长可能与手术过程复杂、手术医师操作技术熟练程度有关。
此外,腹腔镜可放大病变部位,使术者对盆腔筋膜壁层与脏层做全面、清晰、细致的观察,有效避免其盆腔神经受损,以此在最大程度上保护患者的排尿、排便功能[20]。且腹腔镜对于肥胖及骨盆狭小者具有显著的治疗优势,其能在腹腔镜的放大效应下降肿瘤完全切除,并从肛门取出,以此有效防止出现医源性肿瘤移植[21]。同时经腹腔镜ISR术治疗超低位直肠癌,对患者造成的手术创伤较小,能有效提高其恢复速度,从而促进患者肛门功能的恢复。本次研究结果显示,两组术后1个月肛门功能肛管最大收缩压、肛管最大静息压、直肠顺应性、直肠便意感觉容量较术前明显降低,术后6个月,两组肛门功能各指标较术前1个月明显升高,治疗组术后6个月肛门功能各指标恢复至术前水平,对照组术后6个月肛门功能各指标恢复情况不如对照组,表明超低位直肠癌经腹腔镜ISR术治疗后,通过患者不断训练,可有效恢复患者肛门功能[22]。同时,本研究比较了两组术后1年内排便情况及病理分级情况,结果显示治疗组Kirwan分级明显优于对照组,这一结果证实了ISR手术在保肛方面具有重要价值。两组术后1年内无复发、转移及死亡病例,说明两种术式均能成功切除患者的肿瘤。
由此可见,采用腹腔镜ISR术治疗超低位直肠癌手术效果好,可减少术中出血量,促进患者病情恢复,术后并发症少,住院时间短,并能改善患者肛门功能及预后,值得临床广泛推广应用。

