浅部真菌病荧光染色显微成像及计算机辅助诊断系统的初步临床应用
田靓 刘越 毛叶红 连昕 李宁 吕晓华 陶娟 曾绍群 冉艺 曾敬思
1华中科技大学-武汉光电国家研究中心 Britton Chance 生物医学光子学研究中心,武汉 430074;2华中科技大学同济医学院附属协和医院皮肤性病科,武汉 430022
田靓现在武汉大学中南医院设备处 430071
刘越现在华中科技大学同济医学院附属协和医院医学工程科 430022
浅部真菌病是一大类常见的真菌感染性疾病,其菌学诊断目前仍依赖于致病真菌的镜检和培养鉴定。尽管荧光染色液的应用提高了镜检的准确性和效率[1-3],特别是一步法荧光染色液的应用使检验变得更加便捷[4-5]。但仍需专业技术人员对结果进行判读,如果面临大量样本待检,检验人员将承受巨大的劳动强度。目前显微成像系统(图像自动扫描)不仅限于生物基础研究领域,如脑神经成像[6],而且已开始应用于临床组织病理切片图像的采集[7],这为采用人工智能对影像数据做出结果判别提供了可能。国外已有学者[8]研发出图像处理系统,用于自动识别浅表真菌病临床标本荧光显微图像中的真菌菌丝,取得满意效果,但尚未用于临床检验。本研究采用自主研发的荧光染色显微成像及计算机辅助诊断系统(automated fluorescence microscopic imaging and computer aided diagnosis system,AFMICADS)检测临床疑似浅部真菌病送检真菌标本,以观察该系统在临床真菌学检验中应用的效果。
一、材料和方法
1.标本及来源:据2016年华中科技大学同济医学院附属协和医院皮肤性病科真菌室分离、鉴定的病原真菌统计分析,致病菌最多分离自体股癣患者,其次为甲真菌病和手足癣患者(数据未发表)。故将来自上述疾患部位的皮屑、甲屑作为研究标本。2018年7-9 月华中科技大学同济医学院附属协和医院各临床科室门诊及住院疑似浅部真菌感染患者 106 例,男 50 例,女56 例,年龄6 ~ 72 岁。本研究获得华中科技大学同济医学院医学伦理委员会批准([2017]伦审字S008号),并免除知情同意。
2.主要试剂和仪器:一步法真菌荧光染色液Ⅱ型(南京汉瑞生物科技有限公司);Leica DM500荧光显微镜(瑞士莱卡生物系统贸易有限公司);荧光染色显微成像及计算机辅助诊断系统(AFMICADS)为华中科技大学同济医学院附属协和医院皮肤性病科与武汉光电国家研究中心合作研发(专利申请号CN201810863813.1),计算机配置GeForce GTX1080显卡,Excel 2007分析软件。
3.方法:每例患者每个检查部位取1个标本,送检标本126 份,其中皮肤鳞屑83 份,甲屑43 份。将每一标本分成3 份,分别用于常规镜检(10%氢氧化钾溶液制片)、改良沙氏培养基培养(25 ℃)及荧光染色镜检。荧光染色镜检包括荧光染色人工镜检(下简称“人工荧光镜检”)及AFMICADS荧光镜检。镜检发现菌丝和/或孢子(包括芽孢)均认为镜检结果为阳性。培养分离所得菌株进行常规的形态学观察(菌落及镜下形态)、生理和生化实验方法鉴定菌种。其中酵母及酵母样菌的菌种鉴定使用API20 C AUX酵母菌鉴定系统。
荧光染色镜检方法:将1 滴荧光染液(约50 μl)滴加到放置于载玻片上的标本处,加盖盖玻片后,轻压至标本薄如云雾状,吸去盖玻片周围溢出的多余染液。先人工荧光镜检,后用AFMICADS 荧光镜检。AFMICADS 荧光镜检的简要流程为:将玻片上标本中心置于扫描镜头下(×200 倍),1 次扫描(25 个视野,0.202 mm2/视野)后进行分析,分别提取并显示概率值(可疑区域疑似为阳性的平均概率值)最高的5 个真菌成分截图,经人工确认后,若为阳性结果,即给出检验报告。否则逐个增加扫描次数,获得阳性结果即止,最多增加4 个扫描。增加的扫描点位于初次扫描点的左上、左下、右上、右下,扫描范围与初次扫描点相邻,不重叠。同样提取增加的每个扫描点中概率值最高的5个真菌成分截图,一旦经人工确认阳性后,即给出检验报告。完成5次扫描后,经人工确认均未见真菌成分时,结果判断为阴性,给出检验报告。分别记录常规镜检及两种荧光染色镜检方法检验一个标本所需时间。
标本取材、10%KOH和荧光染色制片、常规镜检、培养鉴定由1 名经验丰富的检验员单独完成,荧光人工镜检和AFMICADS 荧光镜检由另一接受过专业培训的人员独立完成。
4.数据统计分析:皮肤癣菌病(体股癣、手足癣和甲癣等)菌学诊断的阳性标准是常规镜检和/或真菌培养阳性(培养得到的菌落鉴定为皮肤癣菌时为阳性结果,仅满足任意1 项即可为阳性)。对于由念珠菌感染引起的皮肤黏膜念珠菌病、非皮肤癣菌性霉菌等感染引起的浅表皮肤感染(包括非甲癣的甲真菌病、手足部感染等),菌学诊断的阳性标准是常规镜检和培养均阳性,且镜检所见真菌菌丝、孢子形态特征与分离培养所得菌株相符合。计算2种荧光镜检和阳性标准方法(常规镜检和/或真菌培养)检测所有标本的阳性率。以常规镜检和/或真菌培养阳性为标准,计算2种荧光镜检方法的一致性、敏感性、特异性、阳性预测值和阴性预测值。采用配对四格表χ2检验(McNemar 检验)和Kappa检验,分析2种荧光镜检方法检测阳性率与常规镜检和/或真菌培养结果间有无差异。Kappa 检验所得Kappa值 ≥ 0.75 为高度一致,0.4 ~ < 0.75 为中度一致,< 0.4 为一致性差;检验水准α = 0.05。使用诊断符合率检验[9]分析2种荧光镜检方法之间一致性有无差异,检验水准α=0.05。
二、结果
各种镜检及培养法检测皮屑与甲屑标本阳性率的差异均无统计学意义,见表1。126份标本中,真菌培养阳性59份(46.8%),菌种分别为:红色毛癣菌45 份、犬小孢子菌2 份、指(趾)间毛癣菌2 份、白念珠菌6 份、念珠菌3 份及红色毛癣菌与念珠菌混合感染1 份。人工荧光镜检阳性124 份(98.4%),AFMICDADS 荧光镜检阳性123 份(97.6%),常规镜检阳性95份(75.4%)。人工荧光镜检与AFMICADS荧光镜检阳性率均显著高于常规镜检和/或真菌培养[阳性98例(77.8%),均P< 0.01),Kappa 值分别为0.107 和0.157(均P< 0.001)。见表2。
与常规镜检和/或真菌培养结果相比,人工荧光镜检的敏感性和特异性分别为100.0%和7.1%,一致性为79.4%,阳性预测值79.0%,阴性预测值100.0%;AFMICADS 荧光镜检的敏感性和特异性分别为100.0%和10.7%,一致性为80.2%,阳性预测值79.7%,阴性预测值100.0%(表2)。AFMICADS荧光镜检与人工荧光镜检的一致性差异无统计学意义(诊断符合率检验u=0.125,P> 0.05)。
常规镜检和人工荧光镜检观察到真菌成分的时间约为1 ~2 min,200 倍镜下扫描全片确认无真菌的时间约为8 ~10 min。AFMICADS 完成1 次扫描需2 min,识别并输出阳性结果的时间为3 ~5 min,识别并输出阴性结果的时间为1 ~1.5 min。这样AFMICADS 完成镜检的时间范围最短5 min(1 次扫描,阳性结果),最长21 min(5 次扫描,阳性结果)。
三、讨论
尽管显微成像系统结合计算机辅助识别技术已用于一些常见肿瘤组织病理诊断,但尚未见将计算机辅助识别技术用于浅部真菌病临床检验的报道。Mäder 等[8]使用与本研究中AFMICADS 不同的算法,即分析真菌的形态特征及直方图特征,根据统计信息判断是否有阳性感染,对浅部真菌病的临床标本图像识别的敏感性和特异性分别达到了83%和79%,但尚未见该研究成果的转化及在临床上实际应用效果的报道。本研究中AFMICADS系统采用深度语义分割算法,虽未分别识别真菌菌丝和孢子或研究分析各自的敏感性,但与Mäder 等[8]使用的算法相比,AFMICADS 系统具有分割准确、不易遗漏及敏感性更高等特点。
本研究结果显示,AFMICADS 荧光镜检与人工荧光镜检的一致性相当。两者均呈现出敏感性高,特异性低的特点。以常规镜检和/或真菌培养结果为参照,特异性反映的是受试方法判断出真阴性的比例。两种荧光镜检阳性率均高于常规镜检和/或真菌培养结果,30份按阳性标准判断为阴性的标本中分别有25 份和26 份被AFMICADS 荧光镜检与人工荧光镜检判断为阳性,从而使两种荧光镜检的真阴性标本数大幅减少,特异性明显下降。因此,参照目前的标准得出荧光镜检的特异性未能客观反映荧光镜检的真实特性。另外,本研究中4 种检测方法检测均为阴性的标本数量少(仅1份),也在一定程度上影响了特异性的精确评估。

表1 3种镜检及培养法检测疑似浅部真菌感染患者的皮屑及甲屑标本中的真菌阳性率比较[阳性数(%)]
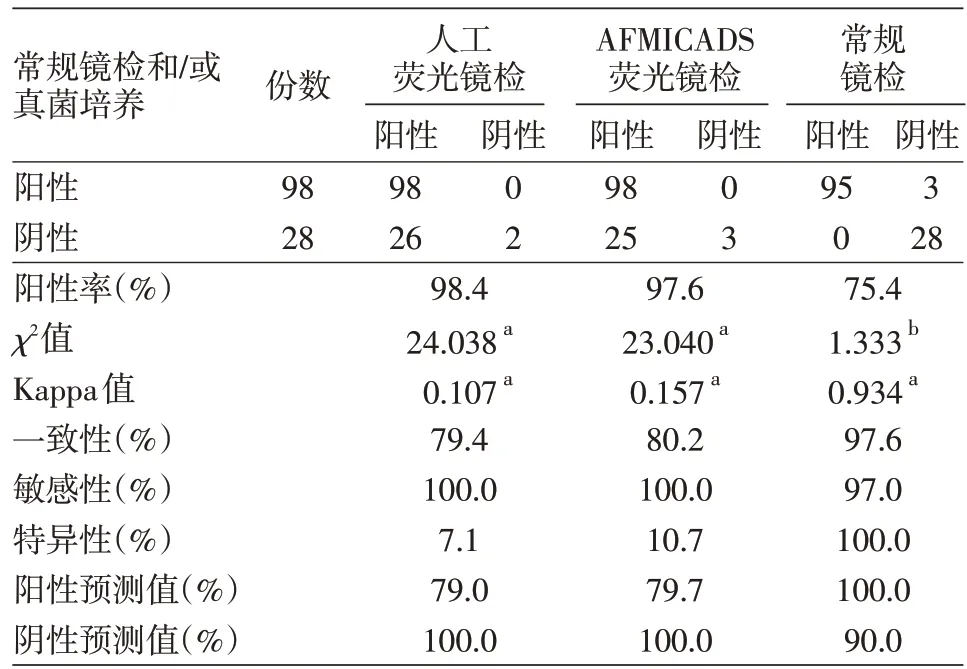
表2 疑似浅部真菌感染患者标本3种镜检法真菌检测结果比较
AFMICADS荧光镜检与人工荧光镜检均有着较高的阳性预测值和阴性预测值。虽然两种荧光镜检的特异性均低,但阳性预测值也接近80%,这与浅表皮肤真菌病患病率高,以及到医院就医患者中浅表皮肤真菌病患者比例较高有关。尽管浅表皮肤真菌病患病率高,但两种荧光镜检的阴性预测值均高,这与两者的敏感性高相关。此结果表明,荧光镜检具有良好的协助临床诊断价值。
已有研究显示,人工荧光镜检明显优于常规镜检[1-3],其在国内外真菌临床检验中也已被广泛应用多年。对于临床浅部真菌感染标本,AFMICADS 荧光镜检是取代人工荧光镜检的可靠方法之一,具有良好的临床应用前景。目前国内外尚未见与AFMICADS类似的商业化诊断系统。
AFMICADS荧光镜检时,无论扫描标本中菌量多少,均不易被遗漏,还能节省人工检验时间,降低检验员的劳动强度。对于细小的、肉眼不易发现的孢子或菌丝也不易被AFMICADS 荧光镜检漏检,常规镜检易将植物纤维和衣物纤维误判为菌丝的情况在AFMICADS 荧光镜检时很少出现,这是该系统的优势。计算机诊断对荧光染色弱的真菌成分识别能力低,易将强荧光着色的背景物质及气泡边缘误判为真菌成分,且在离焦区域误判概率较高,以至于单纯依靠计算机诊断时几乎没有阴性结果,即特异性差。目前,在肿瘤组织病理诊断中计算机识别仅作为辅助手段。因此,本试验所用系统暂采用计算机辅助人工诊断的方法(即人机协同诊断)来提高诊断的特异性。此外,我们将通过标准化地制备样本以减少样本中的气泡,并加大训练样本量和/或改进调焦算法提高采集图像的质量,以减少误判。
AFMICADS 荧光镜检与人工荧光镜检相比,速度上尚无明显优势。但当面临大量标本,特别是进行流行病学调查或疾病筛查时,人工取材和AFMICADS 荧光镜检能同时进行,就会显示出其省时、高效批量处理的优势。当然,对标本进行预处理再制片使涂片厚度趋向均一,改进机器识别策略和算法,提高计算机性能等,均可进一步减少耗时。此外,利用本系统中的荧光显微成像系统便于大量采集、记录临床标本中真菌形态的影像数据,为将来进行大数据分析,探索机器识别镜检图像即对常见致病真菌做出快速菌种鉴定创造条件。
本研究中浅部真菌感染标本经荧光染色后,无论是人工荧光镜检还是AFMICADS荧光镜检阳性率均显著高于常规镜检和/或真菌培养结果。本研究中所使用的真菌荧光染液主要成分为与真菌细胞壁中β-多糖非特异性结合的钙荧光白。尽管有文献[3-4]报道,特异性荧光染液(如荧光素标记的重组几丁质酶染液)用于浅部真菌病真菌镜检时,检出阳性率显著高于常规镜检和钙荧光白染色镜检,但钙荧光白染色法的检出阳性率与常规镜检差异无统计学意义[1-4]。这与本研究结果不一致,不排除受试临床标本种类不同、检验人员技术水平不齐、所用钙荧光白试剂来自不同厂家等因素造成的差异。与常规镜检相比,由于荧光染色使真菌成分易于辨认,荧光染色镜检时在全片中仅见到数个出芽或未出芽孢子的情况较多见,但其是否有临床意义尚待观察研究。
鉴于本研究为将机器视觉用于浅部真菌病致病菌临床镜检的初步尝试,故还存在一些不足,如标本量较少。展望未来研究工作,尚需解决标本涂片厚度均一化的问题,进一步增加训练样本量,改进调焦算法,提高采集图像的质量等,以缩短检验时间,提高特异性,最终实现全自动真菌镜检,并用更大量的标本进行临床应用检验。
利益冲突所有作者均声明不存在利益冲突

