茶树叶片蛋白双向电泳体系建立与应用
周 琳,申加枝,段 玉,王 婷,王玉花,朱旭君,马媛春,房婉萍
(1.南京农业大学茶叶科学研究所, 江苏 南京 210095;2.上海市农业科学院林木果树研究所, 上海 201403)
蛋白质组学技术是深入研究植物响应逆境胁迫的重要工具之一[1],随着技术的不断发展和成熟,其在植物逆境胁迫研究上的应用也越来越深入和广泛。虽然,近年来蛋白质组学中同位素标记相对和绝对定量技术(iTRAQ)在动植物研究中备受关注,但双向凝胶电泳技术(Two-Dimensional Gel Electrophoresis,2-DE)作为蛋白质组学的常用技术之一,在动物、植物和微生物等研究领域的应用仍较为广泛[2]。蛋白双向电泳体系因其准确度、灵敏度和可重复性较好,对于不同物种逆境胁迫下差异蛋白的筛选和分析具有重要意义。因此,蛋白双向电泳体系作为基础,其建立及优化一直备受关注[1,3—5]。
茶树Camellia sinensis 为山茶科山茶属多年生常绿经济作物,喜温暖湿润气候。近年来,春季的“霜冻”和“倒春寒”低温灾害及夏秋季的高温、干旱和强光等灾害,显著降低了茶叶的产量和品质[6—7]。利用2-DE 技术开展低温、干旱等逆境胁迫下差异蛋白分析,可为深入研究茶树对逆境胁迫的响应机理奠定基础。近年来,茶树2-DE 体系的建立和优化备受关注,包括蛋白样品制备[8]、不同组织的体系建立[9—10],以及逆境胁迫的差异蛋白分析[11]。目前,不同研究使用的茶树品种不同,包括‘安徽一号’[8]、‘毛蟹’[10]、‘铁观音’[11]等。近年来,国家级茶树良种‘迎霜’因其较强的抗性而备受欢迎,也是较好的试材。虽然任燕等[9]以‘迎霜’雌蕊为材料,建立其总蛋白质分离双向电泳体系,但该品种叶片2-DE 体系构建尚未有报道。
对于不同的物种、组织和处理条件,其蛋白质组分和理化成分不同[1—3,8—11]。因此,2-DE 没有统一的广谱体系,必须根据材料和具体处理方法,筛选合适的蛋白提取和双向电泳条件。本研究以茶树品种‘迎霜’的一芽二、三叶为材料,筛选提取方法,对双向电泳的IPG 胶条选择、上样量、分离胶浓度、染色方法进行条件优化,建立适于‘迎霜’叶片的2-DE 体系,并应用于低温和干旱胁迫下差异蛋白初步分离,为‘迎霜’茶苗在逆境胁迫下蛋白表达差异的研究奠定基础。
1 材料与方法
1.1 材料
实验于2011 年10 月至2012 年3 月开展,以南京农业大学茶叶科学研究所栽培的一年生‘迎霜’和‘安吉白茶’茶苗为材料,栽培方法参照李磊等[12],取健壮植株的一芽二、三叶,称重后,迅速放入液氮,立即贮存于-80 ℃冰箱用于2-DE 体系建立。另取4 ℃低温处理和聚乙二醇6000(PEG 6000)模拟干旱胁迫处理12 h 的‘迎霜’一芽二、三叶片,用于2-DE 体系的验证和应用。
1.2 方法
1.2.1 茶树叶片蛋白提取 蛋白提取方法分别使用TCA-丙酮沉淀法和改良Tris-HCl 抽提法。TCA-丙酮沉淀法操作步骤参照郭春芳等[11]提取‘铁观音’叶片的方法。参照李勤等[8]、谷瑞升等[13]的改良Tris-HCl抽提法,并对部分试剂用量和操作时间进行改良,研磨时添加交联聚乙烯吡咯烷酮(PVPP) 0.3 g;4 ℃温控摇床震荡浸提1.5 h;冷丙酮和80%冷丙酮洗涤各3 次。两种提取方法均采用低温真空冷冻干燥,随后置于-80 ℃冰箱保存。
1.2.2 蛋白质沉淀的溶解和含量测定 蛋白质沉淀的溶解参照任燕等[9]方法;蛋白质含量测定采用Bradford 法[14]。
1.2.3 蛋白双向电泳
1.2.3.1 第一向等电聚焦(IEF) 第一向等电聚焦使用设备和操作步骤参照任燕等[9]方法,针对叶片的特征,调整等电聚焦程序,具体程序见表1。使用17 cm (pH 4~7)线性胶条(上样量为1.6 mg),比较2 种蛋白质提取方法的提取效果;利用TCA-丙酮法提取的蛋白质,使用17 cm 的pH 3~10、4~7 和5~8胶条(上样量为1.6 mg),比较不同pH 范围胶条的蛋白质分离效果;使用17 cm (pH 4~7)线性胶条比较不同上样量(1.0、1.6、1.8 和2.2 mg)的分离效果。
1.2.3.2 IPG 胶条的平衡和聚丙烯酰胺凝胶电泳(SDS-PAGE)
IPG 胶条的平衡、聚丙烯酰胺凝胶配制和电泳,使用的试剂、设备以及操作步骤均参照任燕等[9]的方法,并比较不同SDS-PAGE 胶浓度(12.5%、13.5%)对蛋白质分离的效果。

表1 等电聚焦电泳程序Table 1 Isoelectric focusing (IEF) procedure
1.2.4 染色方法 参考Blue-silver 法[14]和Wang 等[15]高敏考马斯亮蓝R-250 染色法。
1.2.5 凝胶扫描和分析 使用Bio-Rad-GS800 扫描仪进行图像采集,利用PDQuest 8.0.1 软件进行2-DE图谱分析,使用Excel 2007 和SPSS 16.0 对不同处理的蛋白点数量进行统计分析。
2 结果与分析
2.1 提取方法对2-DE 的影响
TCA-丙酮沉淀法和改良Tris-HCl 法提取蛋白质的得率分别为40.56±0.53 mg·g-1、10.87±0.66 mg·g-1,可见TCA-丙酮沉淀法获得的蛋白量较多。2 种提取方法获得的蛋白质的双向电泳图谱如图1 所示。上样量为1.6 mg时,相同电泳条件下, TCA-丙酮沉淀法、改良Tris-HCl 法分别获得778±23 个、835±19 个蛋白点,改良Tris-HCl 法获得的蛋白点数略高于TCA-丙酮沉淀法;Tris-HCl 法提取的蛋白双向电泳效果更好,获得的蛋白点形状规则,背景清晰,更适用于差异蛋白的分析。由此可见,采用TCA-丙酮沉淀法和Tris-HCl 法均可进行茶苗叶片总蛋白的提取,但为便于建立茶树叶片蛋白双向电泳体系,本实验后期蛋白提取方法采用TCA-丙酮法,以方便多次重复。
2.2 IPG 胶条pH 范围对2-DE 的影响
由图2 可见,IPG 胶条pH 为3~10 时,茶树叶片蛋白质大部分集中在pH 3~8 之间;pH 3~4 之间的蛋白质点高度集中且存在重叠,使得大部分蛋白质点不能有效区分,极大影响2-DE 的分辨率。采用pH 5~8 的IPG 胶条,蛋白在pH 5~6 内的堆积不利于分离;同时与pH 3~10 的胶条一样,在pH≥8 处蛋白点较少。在IPG 预制胶条pH 范围为4~7 时,集中在pH 5~7 之间蛋白质点得到了有效分离,明显提高了双向电泳的分辨率(图2: B)。因此,在不改变胶条长度情况下,选择pH 4~7 的IPG 胶条能使茶树叶片中大量蛋白质得到有效分离,且分辨率较高,利于后续分析。

图1 不同提取方法对茶树叶片蛋白双向电泳的影响Fig. 1 Effects of different extraction methods on 2-DE maps of leaf protein A. TCA-丙酮沉淀法;B. 改良Tris-HCl 提取法
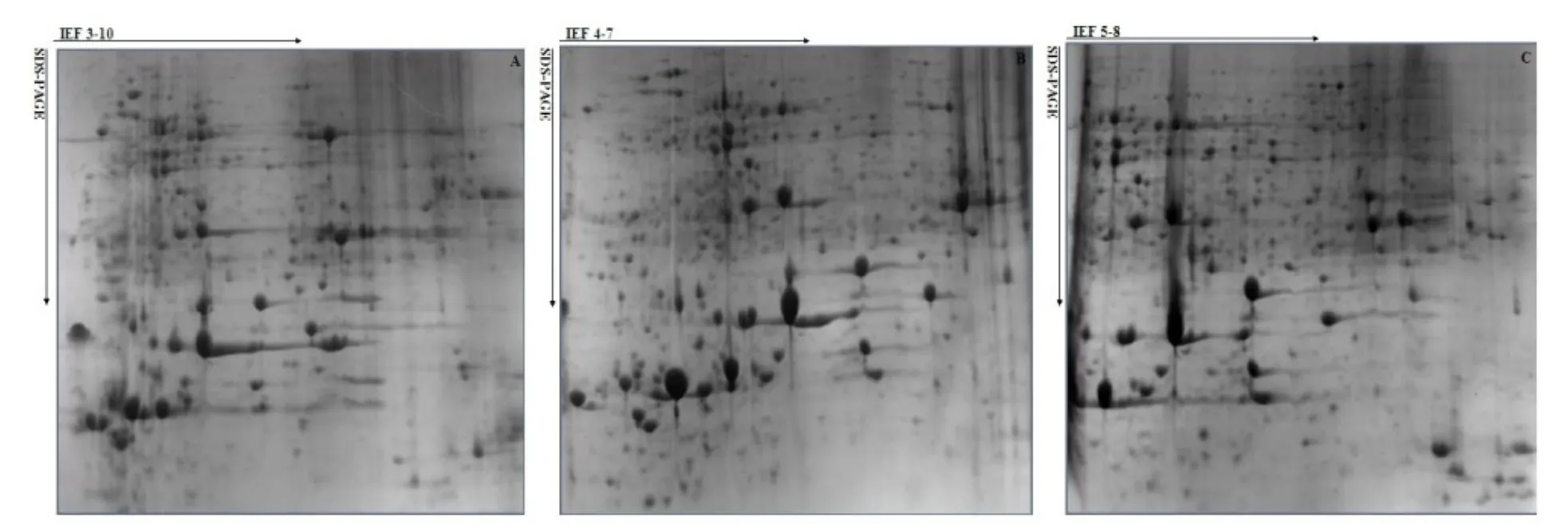
图2 IPG 胶条pH 范围对茶树叶片蛋白双向电泳的影响Fig. 2 Effects of different pH gradients of IPG strip on 2-DE maps of leaf protein A. pH 3~10;B. pH 4~7;C. pH 5~8
2.3 上样量对2-DE 的影响
为获取最佳蛋白上样量,以TCA-丙酮法提取的‘迎霜’叶片蛋白干粉为材料,选择17 cm pH 4~7 IPG胶条,分别用1.0、1.6、1.8 和2.2 mg 上样量进行双向电泳。利用PDQuest 8.0.1 软件分析后,4 个不同上样量处理的2-DE 图谱中,检测到的蛋白点分别为516±19 个、789±21 个、1069±17 个和1286±29 个(图 3)。由图3: A 可见,上样量为1.0 mg 时,图谱中有效蛋白点数少且分辨率较低;上样量为1.6、1.8 和2.2 mg 时(图3: B,C,D),随着上样量的增加,图谱中蛋白质点也随着增加,图谱中有效蛋白点数较多,且能有效分离。因此,‘迎霜’叶片蛋白双向电泳适宜的上样量在1.6~2.2 mg 间。
2.4 分离胶浓度对2-DE 的影响
如图4 所示,上样量为1.6 mg,SDS-PAGE 胶浓度为12.5%时,2-DE 图谱上茶苗叶片蛋白点分离不够清晰,胶中上部的蛋白质点可有效分离,而胶下部的蛋白质点则重叠,总蛋白质整体分离效果欠佳;当浓度为13.5%时,小分子蛋白充分分离,且蛋白点均匀分布在整个胶面内,背景清晰,没有重叠的蛋白点,表明分离‘迎霜’茶苗叶片蛋白分离胶的适宜浓度为13.5%。
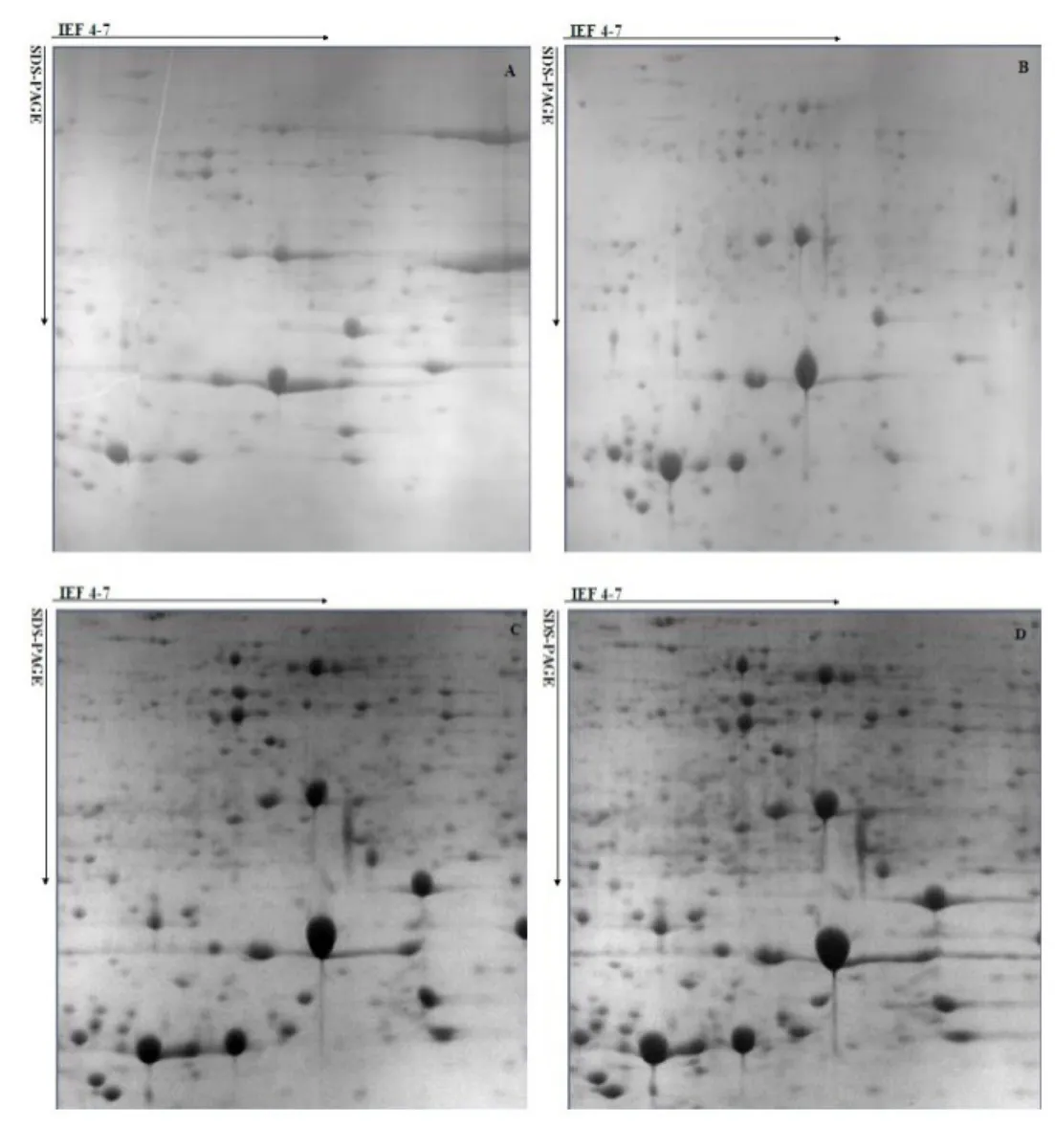
图3 上样量对茶树叶片蛋白双向电泳的影响Fig. 3 Effects of sample loading on 2-DE maps of leaf protein A.1.0 mg;B.1.6 mg;C.1.8 mg;D. 2.2 mg

图4 分离胶浓度对茶树叶片蛋白双向电泳的影响Fig. 4 Effects of different gels on 2-DE maps of leaf protein A.12.5%分离胶;B.13.5%分离胶
2.5 染色方法对2-DE 的影响
由于上样量为1.6 mg,不宜使用银染法,因此比较两种考马斯亮蓝染色法(Blue-silver 法、高敏考马斯亮蓝R-250 法)对双向电泳效果的影响。染色后,高敏考马斯亮蓝R-250 法总点数为809±15 个,Blue-silver 法总点数为677±21 个;高敏考马斯亮蓝R-250 法总体背景较清晰,分辨率高,且获得蛋白质点的数量显著高于Blue-silver 法(图5)。可见,高敏考马斯亮蓝R-250 法比Blue-silver 法更适合于‘迎霜’叶片蛋白质的染色。
2.6 2-DE 体系的应用
基于前期体系的建立,采用Tris-HCl 法提取‘迎霜’和‘安吉白茶’茶苗叶片总蛋白,选用17 cm pH 4~7 IPG 胶条,使用1.6 mg 上样量、13.5%聚丙烯酰胺凝胶进行分离,最终用高敏考马斯亮蓝R-250法进行染色,‘迎霜’和‘安吉白茶’叶片分别获得819±17、878±19 个清晰的蛋白质点,表明建立的2-DE 体系适用于不同茶树品种。采用相同体系,分别对低温和干旱胁迫12 h 的‘迎霜’茶苗叶片总蛋白进行双向电泳,可分别分离到856±13 个和1129±21 个蛋白点。由图6 可见,低温和干旱胁迫处理下的叶片蛋白质点充分分离且背景清晰、分辨率高,可用于差异蛋白分析、筛选、挑取和检测。
3 结论与讨论

图5 染色方法对叶片蛋白双向电泳的影响Fig. 5 Effects of different staining methods on 2-DE maps of leaf protein A.Blue-silver 法;B.高敏考马斯亮蓝R-250 法
样品制备方法、胶条的选择、上样量、分离胶浓度以及染色方法等,均影响双向电泳的分辨率、蛋白质的分离效果、差异蛋白的筛选等,是蛋白质双向电泳的关键技术。蛋白质样本的制备是实验的第一步,由于茶树中富含次生代谢产物,且在逆境胁迫下,其可溶性物质如可溶性蛋白、可溶性糖、游离脯氨酸等含量显著增加[6—7,12],极易影响2-DE 效果。李勤等[8]研究表明,TCA-丙酮沉淀法蛋白质提取效率较高,在本实验中该方法提取效率显著高于Tris-HCl 法;然而,也有研究表明,TCA-丙酮沉淀法极易因不能有效去除次生代谢产物和盐分,导致蛋白质点的分离受到干扰,最终获得的蛋白质点数少且横纵条纹较多[17—18]。本实验采用TCA-丙酮沉淀法和Tris-HCl 法所获得的蛋白质除了蛋白点有差异外,其他差异并不显著,且不存在横纵条纹严重等问题,这可能与物种、品种和取样部位相关。本实验使用的材料为一年生茶苗的一芽二、三叶,蛋白质提取过程中受干扰的因子少,且改良Tris-HCl 法提取时,针对茶树次生代谢产物较多,将PVPP 增加至0.3 g;为提高提取效率,4 ℃温控摇床震荡浸提时间延长至1.5 h;为降低盐分和杂质,冷丙酮和80%冷丙酮洗涤次数增加至3 次。
胶条长度、pH 范围、上样量、分离胶浓度和染色方法决定蛋白质可否有效分离以及2-DE 图像的分辨率,同时,这几项条件之间也存在着相关性。例如,胶条长度决定着上样量,上样量决定分离胶浓度和染色方法(过高上样量不适用于银染法)。因此,优化各项指标,可提高双向电泳的分辨率、准确性和重复性,有利于后续差异蛋白的筛选和质谱验证。胶条的选择,需要兼顾总蛋白质的等电点和蛋白质点的分离效果。本研究比较了17 cm 的pH 3~10、4~7 和5~8 胶条对蛋白质的分离效果,结果显示叶片蛋白集中在pH 4~7 间,与茶树品种‘毛蟹’[10]、‘铁观音’[11]研究结果一致。这可能是与植物叶片蛋白绝大多数集中在pH 4~7 间[19—20],且碱性蛋白分离较为困难有关。上样量决定着差异蛋白分离的准确性和有效性,本研究发现,对于‘迎霜’茶苗叶片而言,上样量为1.6~2.2 mg 较为合适。与以往研究相比[8,10—11],上样量较大,样品中盐离子浓度可能会偏高,因此调整了等电聚焦的程序。等电聚焦程序上,先在低电压下(100、200、400、600、1000 和4000 V)进行,使样品中的盐离子充分移动到胶条两极,然后在8000 V 恒定电压下聚焦。蛋白质样品在60 000Vh 的情况下能得到充分地聚焦。分离胶浓度会影响蛋白质分离的程度和清晰度,浓度过高或过低均会影响蛋白质分离效果,降低差异蛋白的筛选效率[21]。本研究比较了12.5%和13.5%分离胶的分离效果,最终选择13.5%的分离胶浓度作为最适浓度,可使蛋白得到有效分离。目前,常规银染方法虽灵敏度高且已被广泛使用,但其步骤繁琐、染色条件亦难控制,且对蛋白质质谱分析有干扰[22];近年来大量研究中使用考马斯亮蓝染色法[23—26],与银染法相比,其更为简便且适用于质谱分析。本研究使用高敏考马斯亮蓝R-250 染色法,获得的2-DE 图谱蛋白点较多且清晰,适于上样量1.6 mg 的叶片蛋白质。

图6 低温和干旱胁迫下叶片蛋白双向电泳Fig. 6 2-DE maps of leaf protein under cold and drought stress A.低温胁迫(4℃, 12 h);B.干旱胁迫(PEG6000, 12 h)
本研究表明,采用TCA-丙酮法或Tris-HCl 法提取‘迎霜’叶片总蛋白,选用17 cm pH 4~7 IPG胶条,选择1.6~2.2 mg 上样量,13.5%聚丙烯酰胺凝胶进行分离,使用高敏考马斯亮蓝R-250 法进行染色,能较为有效地分离‘迎霜’茶苗叶片各分子量的蛋白,获得分辨率高、背景清晰、重复性好的双向电泳图谱,该双向电泳体系既适用于正常生长的叶片,也适用于低温和干旱胁迫的茶树叶片蛋白质双向电泳分析,可用于低温和干旱胁迫下茶树差异蛋白分析。

