铁皮石斛种子共生萌发形态学观察*
张 盈 李媛媛 陈晓梅 郭顺星
(中国医学科学院药用植物研究所,北京 100193)
0 引 言
兰科植物是被子植物中最大、最进化的家族之一,许多种类具有较高的药用、观赏价值,如天麻(gastrodiaelata)、铁皮石斛(dendrobiumofficinale)、福建金线莲(anoectochilusroxburghii)、蝴蝶兰(phalaenopsisaphrodite)等.兰科植物种子微小、没有胚乳,构造简单的种皮中包裹着一个未分化的胚[1],因此,兰科植物种子自身无法提供充足的营养以启动萌发.在自然条件下,种子必须与合适的菌根真菌建立共生关系才能够完成早期发育,这一特殊的萌发过程被称为共生萌发(symbiotic germination)[2].由于极低的自然繁殖率、独特的生存环境,以及人类对兰科植物生存环境的破坏和资源的过度利用,导致其处于濒危状态,野生自然资源几近枯竭.采用人工培养基进行种子非共生萌发是生产兰科植物种苗的主要来源[3].这种繁殖方式效率高,但获得的幼苗往往十分脆弱,移栽后生长缓慢、存活率低、易感染病害[4].随着兰科植物种子共生萌发研究的开展,科研工作者和业内人士开始认识到其优势.与非共生萌发相比,共生萌发得到幼苗的周期短,并且幼苗在萌发阶段就与菌根真菌建立共生关系,能够提高移栽成活率,有利于濒危植物回归自然生存环境[5].此外,菌根真菌还能保护种子免受其他微生物的侵害,提高抗逆性.这些特点吸引了越来越多的学者对兰科植物种子共生萌发进行深入研究.
兰科植物种子和共生萌发形成的原球茎体积很小,肉眼不易观察.虽然有关共生萌发的报道很多,但形态学方面的研究很有限.目前最常用的方法是在体视镜下观察共生萌发过程的各个阶段,进一步检测种子和原球茎是否被菌根真菌侵染,则采用石蜡切片、半薄切片和超薄切片方法进行观察[6-11].切片观察操作复杂,且周期较长.能否借鉴其他菌根共生形态学研究方法,找到一些操作简单,耗时短的观察方法应用于兰科植物种子共生萌发,检测菌根真菌在种子和原球茎中的定殖是值得研究的问题.铁皮石斛是我国传统的名贵中药,具有重要的药用价值和商业价值[12].本课题组经过多年研究,建立了铁皮石斛种子-胶膜菌属菌根真菌共生的稳定实验体系[13].因此,本研究以该共生体为实验材料,利用多种真菌特异性染剂结合显微观察仪器,以期为兰科植物种子共生萌发提供简单高效的检测方法,为兰科植物种子共生萌发机制进行更加深入的研究.
1 材料与方法
1.1 植物材料与供试菌株
铁皮石斛成熟蒴果于2018年12月采自云南西双版纳.促进铁皮石斛种子萌发的菌根真菌为胶膜菌属真菌(Tulasnellasp)S6(纯培养时具有念珠状细胞,在侵入种子的菌丝中不存在),分离自金钗石斛成年植株根部[13].
1.2 试剂
磷酸盐吐温(PBST)缓冲液(0.01 mol/L,pH 7.4):1 000 mL磷酸盐(PBS)缓冲液(0.01 mol/L,pH 7.4)加入1 mL 吐温20.
Hoyer′s 溶液:7.5 g 阿拉伯树胶、100 g 水合三氯乙醛、5 mL 甘油、60 mL 蒸馏水,在磁力搅拌器上混合均匀,直至溶液变透明.
苯胺蓝(aniline blue)、氯唑黑E(chlorazol black E)和台盼蓝(trypan blue,0.05% w/v):分别取3种染剂粉末100 mg添加到 100 mL 乳甘油(乳酸 ∶甘油 ∶水=1∶1∶1,v/v/v)溶液中.
麦胚凝集素-异硫氰酸荧光素(wheat-germ agglutinin-fluorescein isothiocyante,WGA-FITC)染剂(100 μg/mL):1 mg WGA-FITC粉末加入到1 mL PBS缓冲液(0.01 mol/L,pH 7.4)中,使用时稀释10倍,至100 μg/mL.
1.3 培养基
共生萌发(oatmeal agar,OMA)培养基[14]:4 g/L燕麦粉+9 g/L琼脂,pH 5.2~5.6.
菌株活化(potato dextrose agar,PDA)培养基[15]:200 g/L去皮土豆+20 g/L葡萄糖+12 g/L琼脂.
1.4 铁皮石斛种子共生萌发
参照Li等[14]的方法进行共生萌发操作. 首先将成熟未开裂的铁皮石斛果实在自来水下冲洗10~20 min,滤纸吸干多余水分后转移到超净工作台内.然后用70%乙醇处理1 min,转移到2.5%次氯酸钠溶液中处理10~15 min,无菌水冲洗3~4次,无菌滤纸吸干多余水分.最后将消毒的果实用无菌手术刀剖开,取出种子,保存在无菌离心管中用于播种.在OMA培养基中间放置一块4 cm ×4 cm 无菌尼龙布(300目),尼龙布4个边缘分别接种1块0.5 mm S6真菌PDA组织块,然后将无菌铁皮石斛种子均匀播在尼龙布上,共播种60皿.石蜡膜封口,光培养室培养.光照周期为12 h/12 h(光/暗),光照强度为1 500~2 000 lx,温度(25.0±2.0)℃.另设不接菌播种的铁皮石斛种子10皿作为对照组.每周于体视显微镜下观察并拍照,记录种子萌发情况.种子萌发和原球茎发育参照Stewart等[16]的划分标准.分别于发育阶段0~5级时取样,进行形态学观察.
1.5 扫描电子显微镜(scanning electron microscope,SEM)观察
收集0~5级的种子和原球茎,不做处理,直接粘在铜制样品台上.EIKOIB-3型金离子溅射仪表面喷涂(日本,EIKO).HITACHIS-3400 N型扫描电子显微镜(日本,日立高新技术公司)观察并照相.
1.6 真菌特异性染色观察
WGA-FITC染色观察:分别收集0~3级的种子和原球茎于离心管中,PBST缓冲液冲洗3次,每次5 min.然后用WGA-FITC(100 μg/mL)染剂室温避光染色90 min.PBST缓冲液冲洗3次,每次10 min.用移液器和尖头小镊子将种子和原球茎轻轻转移到载玻片上,滤纸吸去多余的水分.滴加3~4滴抗荧光衰减封片剂,将种子和原球茎分散均匀,使之处于同一平面.封片后,在LSM510型(德国,蔡司)激光扫描共聚焦显微镜(confocal laser scanning microscopy,CLSM)下观察并拍照.另设对照组,不做WGA-FITC染色处理.
苯胺蓝、氯唑黑E和台盼蓝染色观察:分别收集0~5级的种子和原球茎于离心管中,加入适量10% KOH溶液,90℃水浴 30 min.用吸管吸去10%KOH溶液,去离子水冲洗3次.分别加入苯胺蓝、氯唑黑E和台盼蓝(0.1%w/v)3种染剂,90℃水浴15~20 min.吸去染剂,加入50%甘油室温脱色3次,每次5 min.光学显微镜观察并拍照.另取1和2级萌发阶段的种子和3~5级的原球茎徒手切片,室温条件下,台盼蓝染色15 min.去离子水冲洗掉表面浮色(未与原球茎结合的菌丝)后,光学显微镜观察并拍照.
1.7 Hoyer′s溶液透明观察
滴少许Hoyer′s溶液在5个载玻片上,分别在液滴中放入1~5级的种子和原球茎.盖上载玻片,根据样品大小,室温放置24 h后,微分干涉(differential interference contrast microscope,DIC)显微镜(中国,上海光语生物科技有限公司)观察并拍照.
2 结果与讨论
2.1 宏观形态研究
铁皮石斛种子共生萌发0~5级种子和原球茎的体视镜图如图1所示.成熟的铁皮石斛种子聚集在蒴果中,呈黄色粉状、长梭形,胚位于种皮中央,为0级萌发阶段;共生播种1周时,种子吸水膨胀,胚体积变大,种皮仍旧保持完整,进入1级萌发阶段;共生播种2周时,可见种胚继续膨大,呈纺锤形,种子已经撑破种皮,进入2级萌发阶段;共生播种3周时,形成淡绿色透明的球形原球茎,此时原球茎顶端分生组织处形成明显突起(盾片),基部则出现大量的假根,进入3级萌发阶段;原球茎继续发育,共生播种4周时,盾片不断伸长,进入4级萌发阶段;到了第8周,第1片叶从盾片对面长出,进入5级萌发阶段;不加菌的对照组到第8周时,停留在2级萌发阶段,不再进一步发育.

图1 铁皮石斛种子共生萌发0~5级种子和原球茎的体视镜图(a) 0级;(b) 1~3级;(c) 4~5级
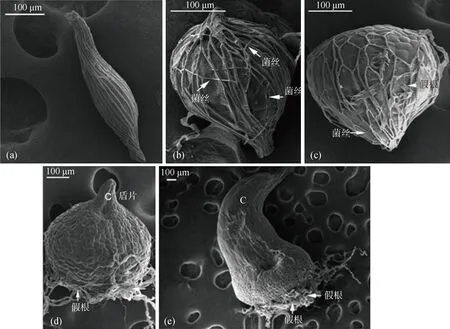
图2 铁皮石斛共生种子和原球茎的扫描电子显微镜图(a) 0级;(b) 1级;(c) 2级;(d) 3级;(e) 4级
2.2 微观形态研究
铁皮石斛共生种子和原球茎的SEM图如图2所示.由图可观察,0级萌发阶段,种子呈纺锤形,种胚被种皮紧密包围,表面纹饰为不规则长形条纹;进入1级萌发阶段,种皮被膨大的胚撑开,菌根真菌的菌丝密集于种子周围,覆盖于种皮表面呈网状;菌丝从种皮任意部位侵入种子内部,并不断产生分支,紧密依附在胚体表面;进入2级萌发阶段,发育的胚突破种皮,并开始出现假根,菌丝附着在裸露的胚体上;进入3级萌发阶段,形成顶端分生组织突起的原球茎,基部产生大量的假根,胚体表面出现气孔,但未见菌丝依附在原球茎表面;进入4级萌发阶段,盾片继续伸长,原球茎基部分化出大量的假根,胚体表面未见菌丝存在.
2.3 真菌特异性染色
2.3.1WGA-FITC染色观察
1~3级萌发阶段的种子和原球茎经WGA-FITC染色后,在激光扫描共聚焦显微镜下能清楚观察到菌丝在种子和原球茎中的定位以及荧光信号的强弱(图3).1级萌发阶段,荧光信号在种胚珠孔端强烈表达,种皮有微弱自发荧光;2级萌发阶段,荧光信号主要集中在原球茎基部,此时菌丝以菌丝团的形式分布在胚细胞内;3级萌发阶段,荧光信号依然只分布在原球茎基部,与2级萌发阶段相比,菌丝团数量增多,基部假根有自发荧光.对照组未见原球茎基部的菌根真菌定殖部位有明显荧光信号.

图3 铁皮石斛共生种子和原球茎WGA-FITC染色观察(a)-(c) 1级;(d)-(f) 2级;(g)-(i) 3级
2.3.2苯胺蓝、氯唑黑E和台盼蓝染色观察
铁皮石斛共生种子和原球茎真菌特异性染剂染色光镜图如图4所示.由图可知苯胺蓝特异性的将菌丝染成蓝色.1级萌发阶段的种子胚柄端可观察到蓝色的菌丝和菌丝团;2级萌发阶段的原球茎基部蓝色菌丝团的数目增多,种子周围的菌丝也被染成蓝色;蓝色的菌丝团由菌丝相互缠绕在一起形成球状.氯唑黑E特异性的将菌丝染成黑色.1级萌发阶段的种子胚柄端黑色的菌丝和菌丝团清晰可见;2级萌发阶段的原球茎可观察到正在从胚柄端侵入胚的菌丝,胚体基部黑色的菌丝团占细胞体积的一半;黑色的菌丝缠绕在一起形成菌丝团,位于胚细胞中央.台盼蓝特异性的将菌丝染成深蓝色.1级萌发阶段的种子外面围绕着大量深蓝色的菌丝,胚柄端细胞内可见深蓝色的菌丝和菌丝团;2级萌发阶段的原球茎已经突破种皮,深蓝色的菌丝团主要聚集在种胚基部;球形深蓝色的菌丝团位于胚细胞中央,几乎占满整个细胞.

图4 铁皮石斛共生种子和原球茎真菌特异性染剂染色光镜图(a) 苯胺蓝染色的1级种子;(b) 苯胺蓝染色的2级原球茎;(c) 苯胺蓝染色的菌丝团;(d) 氯唑黑E染色的1级种子;(e) 氯唑黑E染色的2级原球茎;(f) 氯唑黑E染色的菌丝团;(g) 台盼蓝染色的1级种子;(h) 台盼蓝染色的2级原球茎;(i) 台盼蓝染色的菌丝团
使用台盼蓝对活体种子进行染色,其染色结果如图5所示.在1级萌发阶段的种子中能够直观地看到深蓝色菌丝正在从种子的胚柄端侵入胚,进入胚体后定殖在基部.此时菌丝分布在种子周围的各个部位,但除了胚柄端外,未见菌丝在胚体的其他部位侵染和定殖.当原球茎分化出假根以后,深蓝色的菌丝能够穿透假根.

图5 铁皮石斛共生种子和原球茎台盼蓝染色光镜图(a) 台盼蓝染色的1级种子;(b) 台盼蓝染色的原球茎徒手切片
2.4 Hoyer′s 溶液透明观察
种子和原球茎经过Hoyer′s 溶液透明处理后,在DIC显微镜下呈现三维立体结构(图6).1级萌发阶段,种皮已经被撑开,菌丝聚集在球形胚体的胚柄端进入2级萌发阶段,胚体从种皮中脱离,菌丝已形成菌丝团,位于胚细胞中央;胚细胞中细胞核以及核仁清晰可见.进入3级萌发阶段,原球茎顶端形成突起,分生组织细胞小而紧密,中部和基部细胞较大,菌丝团主要位于原球茎的基部,未在顶端分生组织部位定殖;4级萌发阶段,原球茎基部的假根发达,菌丝团被限制在基部少数几层细胞中.
3 讨 论
铁皮石斛是一种附生型的绿色兰科植物,自然界中种子萌发必须与合适的菌根真菌建立共生关系.一旦菌根真菌在胚细胞中定殖,种子很快发育成原球茎,并进一步分化形成幼苗.形态学方法观察发现,菌根真菌与种子共生关系显示以下规律:首先菌丝从胚柄端侵入胚细胞,随后侵入外皮层细胞形成菌丝团,菌丝继续向内侵染在内皮层细胞中定殖,并最终在内皮层细胞中形成菌丝块被消化吸收. Chen等[6]对铁皮石斛种子共生萌发的形态学进行初步研究,证明铁皮石斛与地生型兰科植物绶草(spiranthessinensis)在共生萌发过程中有类似的超微结构变化.顶端分生组织区域在原球茎整个发育过程中均不被菌丝定殖,这可能与存在植物细胞壁中的一类富含羟脯氨酸的糖蛋白(hydroxyproline-rich glycoproteins, HRGPs)有关,HRGPs集中在原球茎基部细胞的胞壁上,作为潜在的边界区域阻止真菌向上侵染,以保证原球茎顶端分生组织的分化和发育[14].
微观研究结果清晰展示了铁皮石斛种子共生萌发各个级别的三维立体结构.共生萌发过程中,菌丝直接与种子和原球茎接触,如果采用传统方法处理样品后再使用扫描电子显微镜观察,样品表面的真实特征及菌丝分布情况必然发生改变.为了最大程度保持样品原貌,本实验未按照传统方法对共生的种子和原球茎进行处理,而是直接收集新鲜样品喷金后进行观察.结果显示,直接观察法简单有效,不足之处是未经处理的样品在真空中容易发生形变,因此操作时必须迅速,在短时间内找到要观察的样品.尽管如此,直接观察法被证明是可行的,可用于之后的研究.此外,扫描电镜结果显示菌丝可以从种皮任意位置侵入,但是未能观察到菌丝在胚体上的侵入位点.分析原因,可能有以下两点:(1)对共生种子和原球茎进行观察时,未特别定位在种子的胚柄端和原球茎基部;(2)样品数量不够大,本次实验仅观察了15颗种子和原球茎.在后期研究中,应增加样品数量,并将观察重点定位在刚接触菌丝的种子的胚柄端和发育原球茎的基部.
麦胚凝集素(WGA)与几丁质特异性结合,常被用来标记真菌的细胞壁[16].激光扫描共聚焦显微镜对活的样品进行断层扫描和成像,进行无损伤观察和分析细胞的三维空间结构,得到样品的实时动态图像.WGA-FITC染色结合CLSM清晰直观地记录了菌丝在活体种子和原球茎内的定殖情况.结果显示,菌丝最初定殖在种子的胚柄端,随着原球茎的不断发育,菌丝从外皮层细胞扩张到内皮层细胞,并以菌丝团形式存在于胚细胞中.整个发育过程中,菌丝定殖部位始终限制在原球茎基部.WGA-FITC染色结合CLSM的观察方法经常被用在菌根共生研究中[17-18],本实验在前人方法上进行改进,首次用于兰科植物种子共生萌发观察,得到很好的结果.
苯胺蓝、氯唑黑E和台盼蓝是3种常见的真菌特异性染色剂,广泛用于菌根共生研究中[19].3种染剂分别对共生的种子和原球茎进行处理,均得到出色的染色效果.染色的菌丝团定殖在原球茎的基部,与其他形态学方法得到的结论一致.此外,台盼蓝对活体种子和原球茎徒手切片染色结果证明菌根真菌可以从胚柄端和假根两个位点侵入胚细胞,这与前人的研究结果是一致的[8].只需用这3种染剂对样品进行简单处理,即可放在普通光学显微镜下观察,因此不失为一种快速简便的检测兰科植物种子-菌根真菌共生体的方法.
整体透明技术是植物生物学中一种重要的技术,常用于植物生殖生物学研究[20-22].植物组织或器官经过各种透明剂处理后,利用微分干涉差显微镜,可观察到通常不易观察到的组织和细胞.对一些较小的,制作切片困难的材料,用此法可快速观察到内部组织和结构的发育过程.在不破坏整体结构的条件下,对所研究的目标作原位的考察.共生的种子和原球茎经过Hoyer′s溶液透明后,利用DIC显微镜进行整体观察,清楚地观察到菌丝在细胞内的三维结构以及定殖情况,操作简单方便.
本研究在前人基础上,使用多种形态学观察方法对铁皮石斛种子-胶膜菌属菌根真菌共生体这一特殊材料进行观察,得到一系列有价值的研究结果.这些方法操作简单,周期短,为兰科植物种子共生萌发的形态学观察提供方法学上的参考.未来研究中,可以根据实验目的和实验材料,选择合适的方法,用于兰科植物种子-菌根真菌共生体的观察.
致谢:感谢中国台湾自然科学博物馆李勇毅研究员在技术方面的指导.

