剖宫产术前消毒阴道对术后感染的预防作用研究
赵 芳,潘晓玉
(中日友好医院 妇产科,北京 100029)
剖宫产术后感染已成为剖宫产的主要并发症。据报道,10%~25%的女性术后形成子宫内膜炎或伤口感染[1]。研究发现,产程过长、破膜时间长、阴道检查次数多和使用胎心内监护均为剖宫产术后感染的高危因素[2],这些因素都可能导致女性下生殖道细菌大量进入宫腔,引起继发感染。因此有研究者提出术前消毒阴道以减少术后感染的发生[3]。本研究在剖宫产术前加入消毒阴道处理,观察是否可降低剖宫产术后感染的发生率。
1 材料和方法
1.1 研究对象
选择2014年6月~2016年5月在我院行子宫下段剖宫产的患者共665例,随机分为研究组333例,对照组332例。所有孕产妇均于孕35~37周产检或早产入院时行阴道分泌物细菌培养,结果见表1。2组产妇的年龄、体重指数、术前体温、白细胞、血红蛋白,C反应蛋白(CRP)、手术时间、破膜时间、宫口扩张以及糖尿病、瘢痕子宫等指标均无显著性差异(均 P>0.05),见表2。
纳入标准:①患者剖宫产术前体温正常,无感染征象;②患者知情同意;③合并糖尿病者血糖控制正常。排除标准:①术前已出现感染征象,如体温>38.3℃及宫体压痛宫颈举痛或红细胞沉降率及血C反应蛋白升高等;②碘过敏者;③前置胎盘不宜阴道检查者或严重胎盘植入者;④需紧急手术以抢救孕妇或胎儿生命;⑤合并糖尿病者血糖控制不良。

表1 2组孕妇阴道细菌培养结果 n(%)
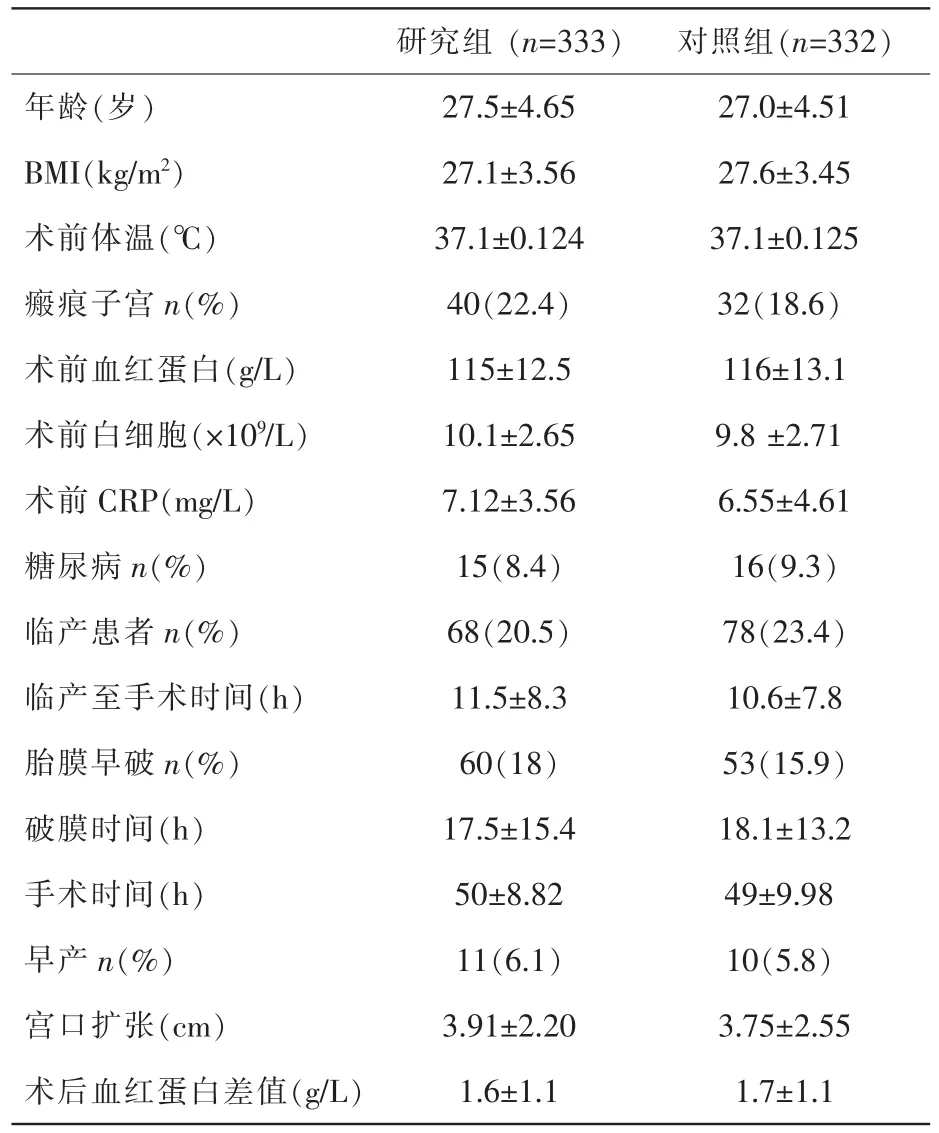
表2 2组产妇基本情况比较
1.2 细菌培养及术前阴道消毒方法
所有患者于35~37周产检时或早产入院时取膀胱截石位,擦去外阴分泌物后,无菌窥器暴露阴道,用无菌棉签在阴道下1/3取材。标本置于无菌试管中,立即送细菌培养。
研究组在术前腹部皮肤消毒同时以0.5%的碘伏消毒阴道,具体方法为:腹部皮肤消毒结束后,先以0.5%碘伏纱布消毒外阴,继而将一次性窥器置阴道,直视下以碘伏纱布消毒阴道四壁及穹隆宫颈部共3遍。对照组仅予常规腹部皮肤消毒处理。术前0.5h及术后24h共给予2次静脉抗生素输注。手术均由主治及以上医师主刀。比较2组产妇住院期间子宫内膜炎及腹部切口感染的发生率,并比较不同阴道菌群阳性患者子宫内膜炎及腹部切口感染的发生率。
1.3 诊断标准
产后子宫内膜炎[4]:分娩24h后患者出现宫颈举痛或宫体压痛,且合并至少一项附加标准。附加标准:①口表温度>38.3℃;②伴宫颈脓性分泌物;③红细胞沉降率升高;④血C反应蛋白升高。剖宫产切口感染[4]:手术切口出现血肿、脓肿、液化,且需开放引流或抗生素治疗后才愈合。
1.4 统计学方法
应用SPSS 20.0软件进行统计学分析。计量资料组间比较采用配对样本t检验;计数资料组间比较采用字2检验或Fisher精确概率法。
2 结果
2.1 术后子宫内膜炎的发生情况
术后发热共70例,排除9例因其他原因导致的感染(4例乳房肿胀、3例上呼吸道感染、2例绒毛膜羊膜炎),最终61例诊断为子宫内膜炎,其中研究组 22例(6.6%),对照组 39例(11.7%),2组间有显著性差异(P<0.05),见表3。
表4示,胎膜早破患者共113例,其中研究组60例,术后发生子宫内膜炎5例(8.3%),对照组53例,术后发生子宫内膜炎12例(22.6%),2组存在显著性差异(P<0.05)。

表3 剖宫产术后感染情况

表4 特定组群的术后子宫内膜炎发生率 n(%)
2.2 阴道细菌培养阳性者情况
术前B组链球菌阳性共30例,其中研究组16例,术后发生子宫内膜炎1例(6.3%);对照组14例,术后发生子宫内膜炎2例(14.2%),其中1例发生严重术后感染,组间无显著性差异(P=0.586)。大肠埃希菌阳性者共8例,研究组4例,无一例术后发生子宫内膜炎;对照组4例,其中有2例术后发展为子宫内膜炎.组间无显著性差异(P=0.429)。其余各细菌阳性产妇均未发生子宫内膜炎。
2.3 切口感染情况
切口愈合不良13例,其中研究组5例(1.5%),对照组 8 例(2.4%),组间无显著性差异(P=0.404)。
3 讨论
3.1 术前阴道消毒与术后子宫内膜炎关系
产后子宫内膜炎是宫腔内膜的一种继发性感染性疾病。约94%的产后患者具有内膜炎形成条件,但极少数真正发展成为内膜炎[5]。经典感染途径是细菌自阴道上行性感染至子宫内膜[5]。目前临床上常规预防性使用静脉抗生素以及腹部皮肤消毒以降低剖宫产术后感染率。有些研究者则提出通过术前消毒阴道阻断上行性感染途径来预防剖宫产术后感染,尤其是预防子宫内膜炎的发生。有些研究者认为术前阴道准备有利于预防术后子宫内膜炎发生[1],而有些研究者认为并无益处[6]。
正常女性阴道分泌物中可培养分离出5~15种主要细菌,常见的有乳杆菌、棒状杆菌、肠球菌等,其中乳酸杆菌是阴道优势菌群。妊娠时由于激素水平的变化,导致阴道上皮细胞增生,阴道内糖原含量增加,表皮葡萄球菌、假丝酵母菌、粪肠球菌的分离率增加,可致阴道感染发生率增高[7]。Osborne等[8]认为术前阴道消毒可清除98%的阴道细菌。Amstrey等[9]则认为术前使用碘伏消毒阴道可杀灭阴道厌氧革兰氏阳性杆菌,并使革兰氏阴性杆菌及球菌数量显著减少,尤其是肠球菌感染。
本研究认为术前使用碘伏进行阴道消毒有益于降低术后子宫内膜炎发生率,尤其有益于胎膜早破患者。Baldwin等[10]认为胎膜早破患者的阴道内环境与健康孕产妇不同,乳酸杆菌的缺失致阴道致病菌繁殖增加,形成亚临床感染,最终诱发胎膜早破。他认为即使使用抗生素仍无法杀灭阴道特定菌群,如普雷沃菌及Peptoniphilus,特定菌群可在阴道中存活至临产后。Hass等[1]于2014年对碘伏消毒阴道的7个临床对照研究共2816例患者进行荟萃分析,结果显示,术前阴道消毒可以显著降低子宫内膜炎的发病率,对胎膜早破的患者意义更大。这与本文研究结论一致。
3.2 术前阴道消毒与术后腹部伤口感染及发热关系
Yildirim等[11]研究认为对临产患者剖宫产术前予阴道消毒能够显著降低术后子宫内膜炎发生机率,但对于伤口感染及术后发热无明显影响。Hass等[12]2018年更新的cochrane系统分析纳入4例临床研究(960例患者),认为术前阴道消毒可降低临产患者术后感染发生机率。本研究中,临产患者中,研究组子宫内膜炎发生率低于对照组,但差异无统计学意义。考虑与本研究样本量不足相关,如能进一步扩大样本量,进行多中心双盲对照研究,或将能判断阴道消毒是否能预防临产患者术后感染的发生。
本研究中,术前碘伏阴道消毒不能降低术后伤口感染发生几率,而Haas等[1]回顾分析认为术前阴道消毒可降低术后子宫内膜炎及腹部伤口感染复合感染发生率,单独腹部伤口感染发生率虽略有下降,但两组差异尚无统计学意义。考虑单独腹部伤口感染可能主要与腹壁皮肤细菌感染相关,与生殖道细菌上行性感染关系不大。
3.3 术前阴道消毒与特定阴道菌群阳性孕产妇术后感染关系
本研究还对所有入组的孕产妇进行了阴道细菌培养,以讨论产后子宫内膜炎发生是否与阴道特定菌群有关。本研究中阴道菌群培养阳性率包括 B 组链球菌(Group B Streptococcus,GBS)阳性率低于国内研究水平[12],这可能与细菌培养法本身存在菌群相互抑制导致培养成功率低,菌群过小易出现假阴性,且未采用实时PCR方法有关。
GBS是一种寄生于阴道及直肠的革兰氏阳性菌,是最重要的围产期感染致病菌。GBS可致围产儿感染及死亡,还与早产、绒毛膜羊膜炎及子宫内膜炎发生密切相关[13]。GBS的定植率与地域、年龄、社会经济状况有关。国内报道孕妇的GBS定植率为3.5%~32.4%[13],时春燕等[14]报道B族链球菌阴道培养阳性率为3.4%,而实时PCR检测阳性率为9.2%。本研究中孕产妇阴道培养GBS阳性检出率为4.5%,与国内报道基本一致。Simon等[15]回顾分析认为GBS是引起母体败血症的重要病原体,在妊娠期和产后菌血症中占15%~25%,5%的剖宫产手术部位感染中存在GBS。使用阴道碘伏消毒后GBS阳性孕产妇较对照组子宫内膜炎发生率有所下降,但差异无统计学意义,这可能与本研究样本量较小有关。GBS阳性者对照组中有1例患者术后发生高热达39℃,迅速发展为感染性休克,积极治疗后结局良好。
本研究中白色念珠菌阳性率达6.0%,但术后无一例未发生子宫内膜炎,考虑与孕期筛查后使用阴道药物积极治疗有关,也可能与存在念珠菌与阴道正常菌群相互抑制、仅为寄居状态有关[7]。
大肠埃希菌阳性组仅8例患者,研究组与对照组各有4例患者,研究组未发生子宫内膜炎,而对照组中2例术后发展为子宫内膜炎。其中1例因孕足月胎膜早破入院,因活跃期停滞行剖宫产术,术后24h出现高热达38.7℃,伴子宫压痛明显,诊断子宫内膜炎。同时新生儿因血象明显增高考虑感染可能转儿科治疗。母子经治疗后均结局良好。Cape等[16]对1295例产后发热女性进行血培养,172例菌血症患者血样中细菌以大肠埃希菌最为多见(35.9%),其次为粪肠球菌(23.6%)及厌氧菌(9.2%)。这些感染患者56%诊断为子宫内膜炎,21%为绒毛膜羊膜炎,8%发展为败血症。故认为大肠埃希菌可能是产后子宫内膜炎形成过程中极为重要的病原体。本研究由于样本数较少,大肠埃希菌阳性患者中在研究组及对照组子宫内膜炎发生率差异无统计学意义,但对照组患者子宫内膜炎病情进展迅速,需要临床干预的比例明显增高。因此对于孕期阴道特定菌群阳性的孕产妇应高度警惕术后感染的发生,临产后或剖宫产术前采用阴道消毒或可降低术后感染发生几率,并可进一步扩大样本量以确定阴道消毒是否对特定菌群阳性的孕产妇发生术后感染具有预防作用。

