超声辅助制备草鱼鱼油微胶囊及其贮藏稳定性和降血脂作用研究
刘晓丽 - 魏长庆 - 詹晓北 - 夏文水 -
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122;3. 江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122;4. 石河子大学新疆植物药资源利用教育部重点实验室,新疆 石河子 832003;5. 石河子大学食品学院,新疆 石河子 832003;6. 江南大学生物工程学院,江苏 无锡 214122)
中国渔业资源十分丰富,其中草鱼的养殖产量最大[1]。近年来,水产加工技术在得到快速发展的同时,有很多副产物在加工过程中得不到有效利用,造成资源的严重浪费[2]。鱼腹中含有较高的脂肪,其中富含人体所必需的多不饱和脂肪酸如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),它们具有降低血清胆固醇含量[3]、提高免疫力[4]、提高视力[5]、预防心脑动脉粥样硬化[6]和抗肿瘤等诸多生理作用[7]。但由于鱼油自身鱼腥味的存在,同时在加工、贮藏和运输过程中一些鱼油多不饱和脂肪酸极易发生氧化酸败,产生异味,降低了产品的营养价值[8]。而采用微胶囊化技术能够从根本上解决上述问题,进一步拓宽鱼油在生产和加工中的应用。
研究[9]表明,采用微胶囊化技术包埋后的鱼油表面,会形成一层由有效壁材组成的保护层,该保护层的存在,不仅能掩盖其腥味、改变其物理状态、延长产品货架期,还能有效地控制鱼油的释放速率,提高其消化吸收率。但是液态鱼油在经微胶囊化后,其各种生物效应是否得到了保留,有关这方面的报道甚少。壳聚糖(Chitosan,CTS)和大豆分离蛋白(Soybean protein isolate,SPI)是微胶囊化常用的壁材,其中壳聚糖是从甲壳动物的外壳中提取的一种天然生物多糖,具有良好的生物相容性[10]、抗氧化活性[11]、生物可降解性[12]和抗菌活性等[13],特别适合作为微胶囊壁材[14]。目前,以壳聚糖和大豆分离蛋白为复合壁材对淡水鱼油进行微胶囊化的研究较少,而且未对其贮藏稳定性进行研究。同时,在制备过程中,通常使用高压均质制备微胶囊,但存在乳化过程中体系不均匀、形成的微胶囊大小和形态不均一的情况,而用超声代替高压均质,可以避免上述现象的发生,但目前未见将此方法应用在制备淡水鱼微胶囊中的报道。
试验以草鱼鱼油为芯材,以壳聚糖/大豆分离蛋白(CTS/SPI)为复合壁材,拟采用超声辅助均质和喷雾干燥法制备鱼油微胶囊,并对微胶囊贮藏稳定性及降血脂功效进行研究,以期为开发新的鱼油微胶囊产品和其在食品行业中的应用提供试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
草鱼鱼油:实验室精制;
壳聚糖(CTS):Mw= 40 kDa,脱乙酰度为80%~90%,BR级,实验室自制;
大豆分离蛋白(SPI):BR级,源叶生物科技股份有限公司;
脂肪酸甲酯标准品:AR级,美国Supelco公司;
雌性昆明系小鼠:体重(20±2) g,上海斯莱克实验动物有限公司;
基础饲料和高脂饲料:实验室自制;
总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C):南京建成生物工程研究所。
1.1.2 仪器与设备
紫外—可见分光光度计:UV-1800型,上海天美科学仪器有限公司;
纳米粒度电位仪:Zetasizernano ZS型,英国Malvin公司;
高速剪切机:Ultraturrax T-10b型,德国IKA公司;
电子精密天平:JB5374-91型,瑞士Mettler Toledo公司;
pH计:FE20K型,瑞士Mettler Toledo公司;
数控超声波清洗器:KQ-500 DE型,昆山舒美超声仪器有限公司;
粒度仪:NanoBrook Omni型,美国布鲁克海文有限公司;
喷雾干燥机:GZ-5型,无锡市阳光干燥设备厂;
酶标仪:Multiskan Mk3型,美国Thermo 公司;
气相色谱仪:17A型,日本岛津公司;
热重—差热综合分析仪:TG/DTA7300型,日本NSK公司。
1.2 方法
1.2.1 鱼油微胶囊的制备 一定量的CTS溶于1%的醋酸溶液中,按一定比例将添加了鱼油的SPI溶液逐滴加入到不断搅拌的CTS-醋酸溶液中,在转速为6 000 r/min下乳化5 min,使其形成均一的乳状液,用1 mol/L 盐酸和1 mol/L 氢氧化钠调pH至6.5,40 ℃下超声均质10 min (功率 200 W),在转速为60 r/min下,边加入一定量的谷氨酰胺转氨酶(18 U/g SPI)边低速搅拌,固化1 h后,静置分层、过滤、水洗收集湿囊,再经喷雾干燥后,得到干态鱼油微胶囊[14]。整个体系鱼油与复合壁材的质量比为1∶2,制备获得鱼油微胶囊,包埋率为77%,得率为80%。
1.2.2 鱼油微胶囊包埋率的测定
(1) 表面鱼油含量测定:参照文献[15],准确称取一定量的鱼油微胶囊,将其置于50 mL石油醚中振荡浸提5 min 后过滤获得滤渣,再用10 mL的石油醚反复洗涤滤渣两次,快速过滤,将滤液转移至已恒重的圆底烧瓶中,于40 ℃下旋转蒸发掉过量石油醚,于105 ℃下烘干至恒重称量。按式(1)计算微胶囊表面鱼油含量。
(1)
式中:
M——微胶囊表面油含量,%;
m1——鱼油微胶囊的质量,g;
m2——干燥圆底烧瓶的质量,g;
m3——恒重后圆底烧瓶与鱼油微胶囊表面油的总质量,g。
(2) 总鱼油含量的测定:将准确称取的一定量的微胶囊样品充分溶解在30 mL的去离子水中,再加50 mL石油醚—无水乙醇混合液(1∶1)重复萃取2次后,将萃取液合并转至已恒重质量的圆底烧瓶中,旋转蒸发,去掉多余的溶剂,置于105 ℃烘箱中烘至质量恒定。按式(2)计算微胶囊总鱼油含量。
(2)
式中:
M——微胶囊总鱼油含量,%;
m1——鱼油微胶囊的质量,g;
m2——干燥圆底烧瓶的质量,g;
m3——恒重后圆底烧瓶与鱼油微胶囊总油的总质量,g。
(3) 鱼油微胶囊包埋率的测定:鱼油微胶囊包埋率是指包入微胶囊中的鱼油量与鱼油使用总量的百分比,计算公式如式(3)所示。
(3)
式中:
E——包埋率,%;
m1——表面油质量,g;
m2——总油质量,g。
1.2.3 鱼油微胶囊粒径测定 取一定量的鱼油微胶囊,以蒸馏水为分散剂,将微胶囊置于水中分散均匀,用NanoBrook Omni粒度仪对微胶囊的粒径分布进行测定。
1.2.4 鱼油微胶囊的热重(TG/DTG)和差示量热扫描(DSC)分析 采用热重—差热综合分析仪,控制氮气流量20 mL/min,从30 ℃开始,以速率10 ℃/min的速度升温至800 ℃后结束,绘制鱼油微胶囊TG/DTG曲线,并对CTS、SPI和鱼油微胶囊的DSC进行分析。
1.2.5 鱼油微胶囊的贮藏稳定性 按照GB 5009.227—2016,将鱼油和鱼油微胶囊分别置于4,37 ℃下贮存60 d进行周期试验,定期取样分别测定鱼油和鱼油微胶囊产品在不同贮藏条件下的过氧化值(POV),分析POV值的变化情况。
1.2.6 鱼油微胶囊脂肪酸含量测定 参照文献[16],用气相色谱法对原料鱼油、微胶囊化后鱼油贮藏前,及在60 ℃ 下贮藏15 d后的脂肪酸含量变化情况进行测定。
1.2.7 鱼油微胶囊降血脂试验 试验小鼠经基础饲料喂养1周后,按照每组10只,分为5组,即分别为对照组(喂食基础饲料)、高脂模型组(喂食高脂饲料)、喂食2 g/kg 的壁材复凝聚物+高脂饲料的CTS/SPI壁材组、喂食2 g/kg 的鱼油微胶囊+高脂饲料的鱼油微胶囊组和喂食1 g/kg的鱼油+高脂饲料的鱼油组。其中,高脂模型组和对照组小鼠每天灌胃0.2 mL的蒸馏水,其他两组每次灌胃0.2 mL的鱼油和鱼油微胶囊溶液。28 d后,用乙醚麻醉小鼠后,摘眼球取血,将全血静置于4 ℃冰箱中1.5 h后,用冷冻离心机于4 ℃下以4 000 r/min离心15 min,分离血清,用于血脂检测[17]。
1.2.8 鱼油微胶囊降血脂作用测定
(1) 小鼠体重:每7 d称量并记录小鼠体重数据。
(2) 血脂含量检测:按照南京建成生物工程研究所试剂盒所述方法,对上述1.2.7中获得的血清中的TC、TG、HDL-C和LDL-C的含量进行测定。
1.2.9 数据处理与统计方法 对试验数据进行多重比较、差异显著性检验分析(SPSS 18.0,one-way ANOVA 方法)。
2 结果与分析
2.1 鱼油微胶囊粒径测定
从图1可以看出,以CTS/SPI为壁材制备的鱼油微胶囊粒径基本符合正态分布,分布比较均匀,有73%的微胶囊粒径集中在10~25 μm,其中15~20 μm的占37%,平均粒径为15.8 μm。存在少量粒径较大的颗粒,可能是部分较小粒径的微胶囊在水中发生了团聚。
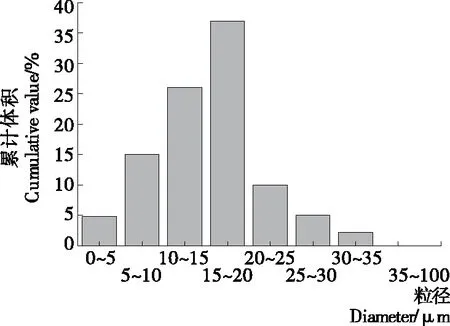
图1 鱼油微胶囊粒径分布
2.2 鱼油微胶囊的热重分析
热失重的过程可以反映出产品的分解过程,同时也可体现鱼油微胶囊的热稳定性。由图2可以看出,在程序升温情况下,鱼油微胶囊的质量有较大变化,主要可以分为以下几个阶段。在30~110 ℃内曲线出现了小幅度下降,大约有9.8%的质量损失,此阶段损失的质量主要为微胶囊中的自由水及表面油脂氧化分解;在110~490 ℃ 区间,曲线下降迅速,此过程中的质量损失达到49%左右,说明在此阶段鱼油微胶囊暴露并氧化分解,49~800 ℃区间内的质量损失为26%左右,该阶段的质量变化主要来自于微胶囊壁材的进一步热分解。因此,根据微胶囊中鱼油的热分解温度范围可知,鱼油微胶囊表现出了较好的热稳定性。

图2 鱼油微胶囊热重分析图
2.3 差示量热扫描(DSC)分析
经DSC分析,CTS、SPI和鱼油微胶囊的玻璃化转变温度(Tg)分别为107,62,71 ℃,鱼油微胶囊的Tg介于CTS和SPI之间,高出常温贮藏条件。这是因为在CTS的分子链的C6和C3位中含有活性羟基,在C2位中含有活性氨基,这些活性基团可以与SPI中的极性基团发生化学反应,并产生交联作用,可使整个微胶囊产品具有比较稳定的壁材结构[18],因此将鱼油微胶囊产品置于玻璃化转变温度以下贮藏时,体系中分子扩散和化学反应速率较低,能够长时间稳定存在[19]。说明微胶囊化技术可以有效地减缓油脂氧化,提高微胶囊产品的贮藏稳定性,从而延长货架期[20]。
2.4 鱼油微胶囊的贮藏稳定性
由图3可知,鱼油和鱼油微胶囊在4 ℃下贮藏较37 ℃ 贮藏具有较好的稳定性。同时发现,在相同的贮藏温度下,经微胶囊化后的鱼油,其氧化速度明显降低。在4,37 ℃ 的贮藏温度下,微胶囊化后的鱼油的氧化程度比未微胶囊化鱼油分别降低了24%,27%。而微胶囊化鱼油的过氧化值在贮藏初期也有所增加,是因为在微胶囊的表面仍存在一部分未被包埋的鱼油被氧化酸败[21]。另一方面,在喷雾干燥过程中,高温使未经微胶囊壁材包埋的游离的鱼油发生了氧化,因此,在贮藏初期微胶囊化鱼油的POV值比未包埋鱼油的高[22]。贮藏后期未微胶囊化鱼油的氧化程度明显高于微胶囊化鱼油,是因为微胶囊壁材(CTS/SPI)可以有效地减少鱼油与环境的接触,从而减缓氧化速率,延长货架期[23]。
2.5 鱼油微胶囊脂肪酸含量测定
表1为鱼油和鱼油微胶囊在60 ℃下,贮藏前和贮藏15 d后功能性脂肪酸含量的变化情况。通过对比发现,微胶囊化前后鱼油中主要功能性成分及其中饱和脂肪酸、不饱和脂肪酸的相对含量变化不大。这可能是在形成微胶囊后,CTS/SPI微胶囊壁材有效地保护了鱼油中的不饱和脂肪酸,从而阻止了其氧化[24]。鱼油在60 ℃贮藏15 d前后对比发现,其中的主要功能性脂肪酸含量发生了明显的变化,单不饱和脂肪酸减小了1.08%,饱和脂肪酸增加了16.4%,多不饱和脂肪酸减小了19.87%,说明鱼油经15 d后,已严重酸败。而以CTS/SPI为壁材制备的鱼油微胶囊经60 ℃贮藏15 d后发现,其中的脂肪酸含量变化较小,各个成分都比较稳定,其中单不饱和脂肪酸减少了0.54%,饱和脂肪酸增加了1.47%,多不饱和脂肪酸减少了0.86%。其中的油酸、亚油酸、棕榈油酸、α-亚油酸、花生四稀酸和γ-亚油酸等含量减小不明显。说明以CTS/SPI为壁材制备的鱼油微胶囊产品具有致密稳定的结构组成,可以有效地防止鱼油的氧化酸败。

图3 不同贮藏温度下鱼油和鱼油微胶囊
2.6 鱼油微胶囊降血脂作用
2.6.1 小鼠体重指标 各组别小鼠体重的变化情况如表2 所示,随着试验的进行,在喂养不同组别饲料情况下,各组小鼠均生长良好,其体重均随着喂养时间的延长而逐渐增加。在喂养到28 d时,5组中高脂模型组的小鼠体重显著高于正常对照组。而鱼油微胶囊、CTS/SPI壁材组和鱼油组各阶段小鼠的体重均略低于高脂模型组,说明鱼油微胶囊和CTS/SPI壁材对小鼠体重无显著影响。
2.6.2 鱼油微胶囊对小鼠血清中TC、TG、HDL-C和LDL-C含量的影响 由图4可知,高脂模型组小鼠血清在TG含量、LDL-C含量和TC含量方面,和正常对照组相比,前者的TG和LDL-C含量均显著高于后者(P<0.05),TC含量极显著高于后者(P<0.01)。高血脂模型组与CTS/SPI壁材组血清中TG含量相当,但比鱼油组和鱼油微胶囊组中TG含量要高,且都无显著差异,说明鱼油微胶囊和鱼油对高血脂症小鼠TG水平无显著影响。在TC含量方面,CTS/SPI壁材组的含量与高脂模型组相比,同样相差不大,无显著差异;而鱼油组和微胶囊组中TC的含量和高脂模型组相比,分别下降了25%和21%,说明鱼油和鱼油微胶囊对高血脂症小鼠血清中TC的降低有显著作用;对于小鼠血清中HDL-C的含量而言,与高血脂模型组相比,正常对照组、鱼油组和鱼油微胶囊组小鼠血清中HDL-C含量均极显著高于高血脂模型组,CTS/SPI壁材组与高脂模型组相差不大。在LDL-C 含量方面,与高脂模型组相比,CTS/SPI壁材组与其无显著差异,但鱼油组和鱼油微胶囊组均极显著低于高脂模型组(P<0.01)。说明鱼油和鱼油微胶囊能够显著地降低小鼠血脂胆固醇含量。
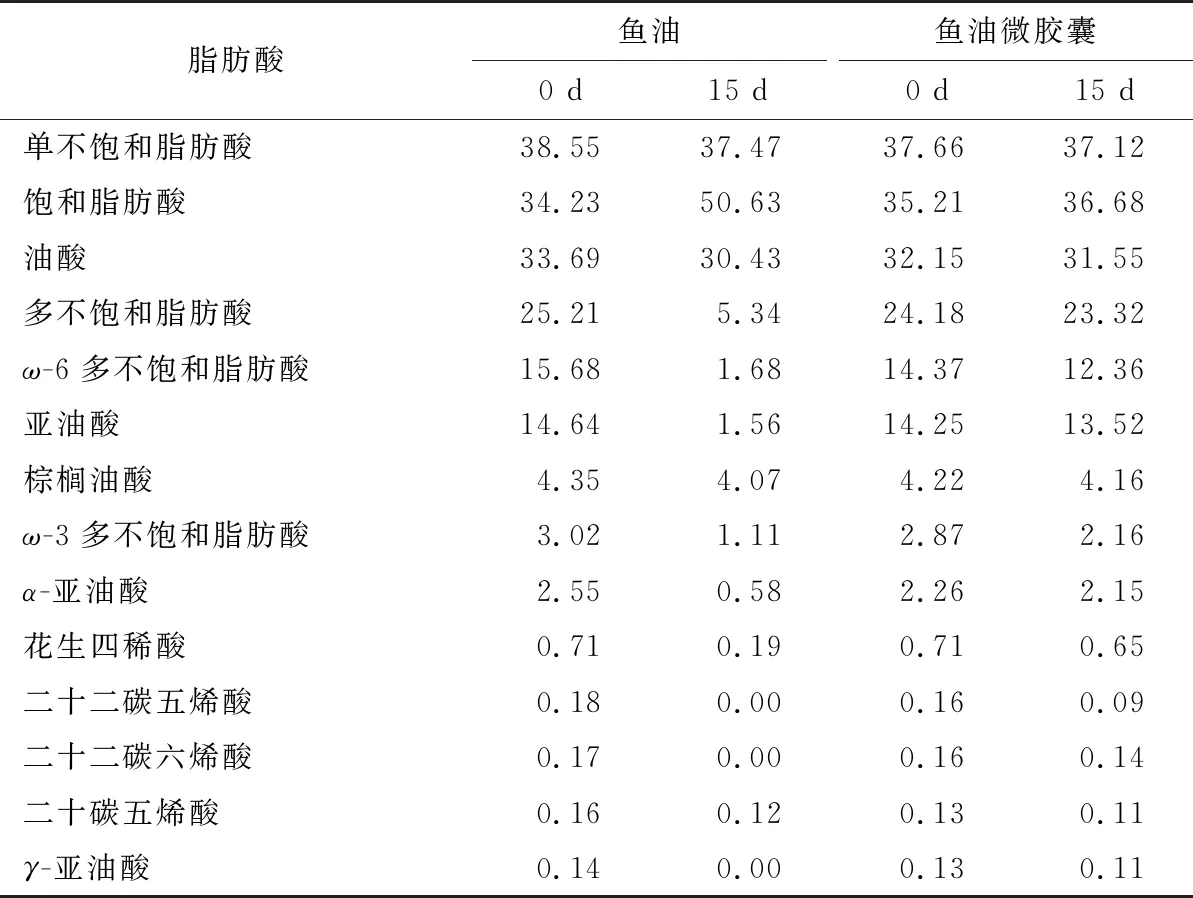
表1 鱼油与鱼油微胶囊贮藏前后功能性脂肪酸含量变化

表2 各组小鼠体重变化

图4 各组小鼠血脂水平
3 结论
在超声辅助下以CTS/SPI为壁材,以草鱼鱼油为芯材制备的鱼油微胶囊的包埋率为77%,得率为80%,并具有均匀的粒径分布,平均粒径为15.8 μm;鱼油微胶囊表现出了较好的热稳定性,其玻璃化转变温度为71 ℃,高出常温贮藏条件。将微胶囊化前后的鱼油在60 ℃贮藏15 d后发现,鱼油中主要功能性成分及饱和脂肪酸、不饱和脂肪酸的相对含量变化不大,各个成分都比较稳定,说明以CTS/SPI为壁材制备的鱼油微胶囊结构致密稳定,可以有效防止鱼油的氧化变质;此外,微胶囊壁材可以有效减少鱼油与环境的接触,从而减缓氧化速率,延长货架期;通过降血脂试验,研究了鱼油微胶囊对小鼠血清中TC、TG、HDL-C和LDL-C含量的影响,发现CTS/SPI组对高血脂症小鼠的血脂水平无调节作用,而鱼油微胶囊和鱼油组具有显著降低血脂胆固醇的作用。

