土霉素完全抗原的制备及ELISA检测方法的建立
曹金博 - 胡骁飞 - 王 耀 李燕虹 - 曹夕丹 -邢云瑞 - 孙亚宁 - 邓瑞广 - 张改平,3 -,3
(1. 河南省农业科学院动物免疫学重点实验室,河南 郑州 450002;2. 河南科技大学食品与生物工程学院, 河南 洛阳 471003;3. 河南农业大学,河南 郑州 450000)
土霉素(Oxytetracycline,OTC)属于四环素类抗生素中的一种,其化学结构式如图1所示[1]。由于具有广谱抗菌性,且价格低廉,因此被广泛用于禽畜各种感染性疾病的治疗,适量添加在动物饲料或饮水中还可有助于禽畜生长和疾病预防[2-3]。但由于禽畜养殖过程中长期、大量违规添加四环素类抗生素,导致其在动物源性食品以及环境中过量残留,对人类健康造成极大威胁[4-5]。中国农业部235号公告明确规定:牛奶和肌肉中四环素类抗生素最高残留量不得超过100 μg/g,肾脏、肝脏、蛋中分别不得超过600,300,200 μg/g。

图1 OTC分子结构式
目前,高效液相色谱法、气相色谱—质谱法等检测方法存在仪器昂贵、操作繁琐、检测不及时等局限,因而不适合样品的现场筛查[6-8]。相比之下,酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)、免疫层析试纸(Immunochromatographic assay,ICA)等免疫学快速检测方法操作简单、迅速,同样具有良好的灵敏度和特异性,在大批量样品现场筛查方面具有显著优势[9-11]。该类方法依赖高效抗体对抗原进行灵敏特异识别,但土霉素分子量小,无免疫原性,必需与载体蛋白偶联制备完全抗原才能刺激机体免疫应答产生抗体。目前,关于OTC完全抗原的制备虽有报道[12],但所获得多抗血清的敏感性和特异性有待提高。试验拟采用重氮化法和碳二亚胺法合成OTC完全抗原,制备并鉴定OTC多抗血清,以期为后期制备OTC单克隆抗体及建立免疫学快速检测方法提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
土霉素(OTC)、金霉素(CTC)、四环素(TC)、沙拉沙星(SARA)、环丙氨嗪(CA)等标准品:纯度≥99%,美国Sigma公司;
1-(3-甲氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、对氨基苯甲酸:纯度98%,上海阿拉丁生化科技股份有限公司;
弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、牛血清蛋白(BSA)、鸡卵清蛋白(OVA):纯度≥99%,美国Sigma公司;
氯化钠、氯化钾、碳酸钠、碳酸氢钠等:分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
电子天平:ME204E型,梅特勒—托利多仪器有限公司;
紫外—可见分光光度计:UV-5100H型,美国Thermo Fisher公司;
电泳仪:DYY-6C型,大连捷迈科贸有限公司;
凝胶成像仪:ChemiDocTMXRS+型,美国Bio-Rad公司;
傅立叶变换红外光谱仪:NicoletTMiSTM5型,日本岛津公司。
1.1.3 试验动物
BALB/c小鼠:6周龄SPF级,济南朋悦实验动物繁育有限公司。
1.2 方法
1.2.1 OTC半抗原合成与鉴定 OTC半抗原合成路线图见图2。参照Fleeker等[13]的重氮化法,具体操作步骤为:称取4.3 mg对氨基苯甲酸溶于4 ℃预冷的2 mL 0.2 mol/L的稀盐酸溶液中,称取4.0 mg NaNO2溶于1 mL 4 ℃预冷的双蒸水后缓慢滴加到对氨基苯甲酸溶液中,4 ℃避光反应1 h。称取10 mg OTC溶于2 mL 4 ℃预冷的四硼酸钠缓冲液(pH 8.5),将上述反应液缓慢滴加到该溶液中,4 ℃避光搅拌2 h,反应液呈深红色,用6 mol/L 的浓盐酸调节其pH至1.5以下,室温静置10 min,产生沉淀,5 000 r/min离心3 min,去除上清,用4 ℃预冷的双蒸水洗4遍,真空冷冻干燥后取部分样品进行红外扫描鉴定。
1.2.2 OTC完全抗原合成 采用同样的方法合成免疫原OTC-BSA和包被原OTC-OVA,其合成路线(以OTC-BSA为例)见图3。具体操作步骤为:称取OTC半抗原5 mg溶于1 mL PBS中,加入1.8 mg NHS,4 ℃避光反应2 h。称取6.5 mg BSA溶于2 mL PBS后慢滴加到上述反应液中,同时加入3 mg EDC,4 ℃避光搅拌24 h。最后在4 ℃条件下用PBS搅拌透析3 d,离心去除沉淀得OTC完全抗原。
1.2.3 OTC完全抗原鉴定
(1) 紫外扫描鉴定:用PBS配制与完全抗原溶液浓度一致的BSA溶液和OTC标品溶液,用紫外—可见分光光度计分别扫描其在220~350 nm的吸收光谱,通过对比各溶液的特征吸收峰判断偶联效果[14]。
(2) 红外扫描鉴定:将OTC完全抗原溶液真空冷冻干燥,对OTC完全抗原、BSA和OTC进行红外扫描,以扫描波数为横坐标,透过率为纵坐标,得到红外扫描光谱并进行对比。
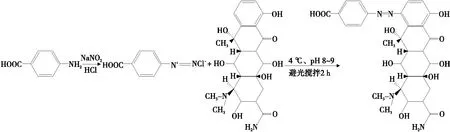
图2 OTC半抗原合成路线

图3 OTC-BSA合成路线图
(3) SDS-PAGE鉴定:参照文献[15]制得12%的分离胶和5%的浓缩胶,其电压分别为60,90 V,样品加入量为20 μL(含OTC-BSA 5 μg),用考马斯亮蓝染液染色6 h,乙酸脱色液脱色6 h,通过凝胶成像系统拍照,对比BSA与OTC-BSA电泳条带的位置差异判断偶联效果。
1.2.4 OTC多抗血清的制备与鉴定 选择4只6周龄的BALB/c小鼠,以30 μg/200 μL/只的剂量背部皮下多点注射免疫4次,每次间隔3周。首次免疫将OTC-BSA与等量FCA混合,后3次为加强免疫,将OTC-BSA与等量FIA混合。免疫完成后10 d断尾取血,获得OTC多抗血清。
(1) OTC多抗血清效价测定:采用间接ELISA法[16]。用CBS将OTC-OVA稀释并包被于96孔聚苯乙烯板,37 ℃孵育2 h,PBST洗板后加封闭液,37 ℃孵育1 h。向已包被抗原的聚苯乙烯板中加入倍比稀释的抗体,37 ℃孵育15 min,洗板后加入羊抗鼠酶标二抗,37 ℃孵育30 min,洗板后加入显色液,10 min后终止显色并读取OD450 nm值,当OD450 nm/空白孔OD450 nm≥2.1时,判定为阳性孔。
(2) OTC多抗血清敏感性鉴定:采用间接竞争ELISA法[17]。向已包被抗原的聚苯乙烯板中加入效价测定中OD450 nm值为1.0左右的血清稀释液和具有梯度浓度的OTC标品溶液,其他步骤同效价测定操作方法。通过计算抑制率,以B/B0为纵坐标(B为OTC不同浓度的OD450 nm值,B0为OTC零浓度的OD450 nm值),OTC浓度对数值为横坐标绘制抑制曲线,得到线性回归方程,并以半数抑制浓度(IC50)来评定多抗血清敏感性。
1.2.5 OTC ELISA检测方法的建立
(1) 确定最佳包被浓度和工作浓度:将OTC-OVA分别稀释500,1 000,2 000,4 000,8 000倍进行包被,间接ELISA测定各包被浓度下抗体效价,选取效价测定中OD450 nm值1.0左右对应的稀释度作为多抗血清工作浓度,采用间接竞争ELISA测定各包被浓度下IC50,选择IC50最低一组所对应的包被浓度为最佳包被浓度,对应的多抗血清稀释度为最佳工作浓度。
(2) 建立标准曲线:配置不同浓度的OTC标品溶液,并根据已确定的最佳工作浓度,建立间接竞争ELISA方法。以B/B0为纵坐标,以OTC浓度对数值为横坐标,绘制标准曲线。
(3) 检测限(LOD):取不含OTC标品的空白样品,通过建立的间接竞争ELISA方法重复测定10次,计算10次OD450 nm值的平均值(X)以及标准差(SD),然后计算X-2SD,将所得值代入标准曲线线性回归方程,计算出标准品浓度,即为检测限。
(4) 样品前处理:将新鲜牛奶样品,8 000 r/min离心10 min,除去上层脂肪,4 ℃保存备用。
(5) 回收率测定:将OTC标准品加入新鲜牛奶样品中,使其浓度分别为10,50,100 ng/mL,将加标样品进行前处理后,对每个浓度重复测定4次,根据所建立方法的标准曲线得到测定值,并计算其回收率。
(6) 特异性鉴定:选择CTC、TC、SARA、CA、BSA、OVA作为竞争物,利用所建立的间接竞争ELISA法测定各竞争物对多抗血清的IC50。以OTC的IC50与各竞争物的IC50的百分比作为交叉反应率,交叉反应率越低,则特异性越强[18]。
1.3 数据处理
对所得的数据利用Excel 2003进行处理(包括回归分析和显著性检验),对分子结构式及合成路线图用ChemDraw Pro 18.0进行绘制。
2 结果与分析
2.1 OTC半抗原鉴定
OTC分子结构上含有一个酰胺基和一个活泼酚羟基。有研究[19]从酰胺基考虑,采用戊二醛法和碳二亚胺法使其与载体蛋白偶联,前期试验同样采用过此方法,但合成的人工抗原免疫效果差,不能满足后续试验需求。采用戊二醛法若不严格控制反应物加入顺序和反应时间,极易发生分子之间的自联,从而影响小分子抗原决定簇充分暴露,进而影响免疫效果[20]。因此试验从OTC分子上活泼的酚羟基考虑偶联,首先采用重氮化法合成OTC的半抗原,然后采用红外扫描(IR)法对OTC半抗原进行鉴定。图4、5分别为OTC和改造后OTC红外光谱图,改造后OTC除了含有OTC中原有化学基团外,在1 682.36 cm-1处出现羧基特征吸收峰,在2 360.46 cm-1处出现偶氮键特征吸收峰,证明OTC半抗原成功引入羧基基团。
2.2 OTC完全抗原鉴定
2.2.1 紫外扫描 OTC半抗原改造完成后,采用改进碳二亚胺法使其与载体蛋白偶联,合成完全抗原,首先利用紫外扫描(UV)法对完全抗原进行鉴定。OTC-BSA、BSA、OTC的紫外扫描图如图6所示,BSA在278 nm处出现特征吸收峰,而OTC-BSA的吸收光谱相比BSA发生了变化,特征吸收峰稍向左偏移,并未与BSA最大吸收峰重叠,初步说明OTC和BSA发生偶联。

图4 OTC红外光谱图

图5 改造后OTC红外光谱图

图6 OTC-BSA、BSA、OTC紫外扫描图
2.2.2 红外扫描 采用红外扫描法对完全抗原进行进一步鉴定,图7、8分别为BSA和OTC-BSA红外光谱图,合成的完全抗原OTC-BSA在1 652.51 cm-1处出现蛋白质中氨基酸的特征峰,在858.05,950.04,1 073.54,1 162.24,1 392.30 cm-1处,出现明显的OTC特征峰。结果进一步表明完全抗原偶联效果良好。
2.2.3 SDS-PAGE鉴定 图9为完全抗原OTC-BSA的SDS-PAGE鉴定结果,OTC-BSA电泳条带出现明显拖尾现象,其迁移速率小于BSA,说明OTC-BSA分子量大于BSA,也能够表明OTC和BSA偶联产生了较好的效果。

图7 BSA红外光谱图

图8 OTC-BSA红外光谱图

图9 OTC-BSA的SDS-PAGE鉴定结果
2.3 多抗血清鉴定
2.3.1 效价测定 表1为OTC多抗血清效价测定结果,4只免疫小鼠多抗血清效价均达到1∶12 800,说明偶联的免疫原具有较好的免疫效果。
2.3.2 敏感性鉴定 表2为OTC多抗血清间接竞争ELISA测定结果,可以看出OTC对4只小鼠多抗血清均起到抑制作用,其中对2号小鼠血清抑制效果最好,其抑制曲线如图10所示,IC50为40.44 ng/mL,说明多抗血清敏感性良好。

表1 OTC多抗血清效价测定结果

表2 OTC多抗血清间接竞争ELISA测定结果

图10 2号小鼠多抗血清抑制曲线
2.4 OTC ELISA检测方法的建立
2.4.1 最佳包被浓度和工作浓度的确定 表3为OTC-OVA不同包被浓度下2号小鼠多抗血清效价结果,图11为OTC-OVA不同包被浓度下抗体的IC50,由表3测量结果选择不同包被浓度下抗体工作浓度分别为:1∶2 000,1∶2 000,1∶1 000,1∶1 000,1∶100,并利用间接竞争ELISA测定OTC-OVA不同包被浓度下抗体的IC50,如图11所示当包被原为1∶1 000倍稀释,抗体为1∶2 000倍稀释时,其IC50最低,敏感性最好。
2.4.2 标准曲线的建立 根据已确定的最佳包被浓度和抗体工作浓度,建立间接竞争ELISA检测方法并绘制标准曲线,如图12所示。根据线性回归方程计算IC50为32.92 ng/mL。
2.4.3 检测限 通过建立的间接竞争ELISA方法测定空白样品,平行测定10次,OD450 nm分别为0.968,1.003,0.986,1.015,1.101,0.987,0.993,1.031,0.976,1.003,平均值(X)为1.006,标准差(SD)为0.038,计算X-2SD值(0.93),再根据标准曲线求得LOD为1.3 ng/mL。

表3 不同包被浓度的效价测定结果
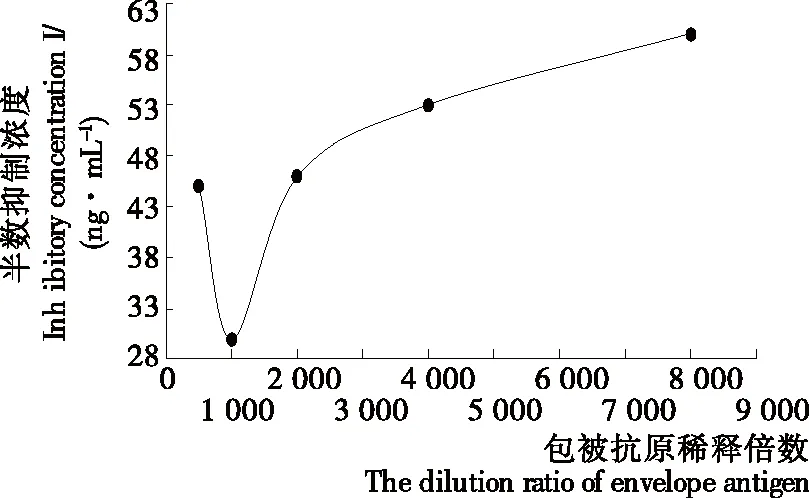
图11 不同包被浓度所对应的抗体IC50

图12 OTC间接竞争ELISA检测试剂盒标准曲线
2.4.4 回收率测定 间接竞争ELISA方法测定不同浓度OTC的牛奶样品结果如表4所示,回收率在84.70%~87.45%,变异系数在9.3%~11.5%,变异系数<15%,说明方法具有良好的准确度。
2.4.5 特异性鉴定 ELISA方法的特异性鉴定结果如表5所示,与CTC、TC的交叉反应率分别为5.27%,4.10%,与其他竞争物交叉反应率<0.4%,说明所建立的ELISA方法与CTC、TC存在微弱交叉反应,但与其他兽药及载体蛋白均无交叉反应,具有较强的特异性。

表4 回收率测定结果

表5 OTC多抗血清与竞争物的交叉反应
3 结论
试验采用重氮化法和碳二亚胺法成功合成OTC的完全抗原,所制备的小鼠多抗血清具有良好的敏感性,在此基础上初步建立OTC间接竞争ELISA检测方法,IC50为32.92 ng/mL,LOD为1.3 ng/mL,牛奶样品中添加回收率在84.70%~87.45%,与CTC、TC的交叉反应率分别为6.46%,5.01%,与其他竞争物交叉反应率<0.4%,具有良好的检测效果,可为监控OTC残留提供一定的技术支撑。

