短小芽孢杆菌碱性β-葡萄糖苷酶在毕赤酵母中的表达及酶学性质研究
阚劲松 - 张 敏 徐 涛
(合肥学院生物与环境工程系,安徽 合肥 230601)
β-葡萄糖苷酶(β-D-glucosidase,EC 3.2.1.21)具有β-糖苷键水解和合成(转糖苷)双重活性作用[1-2],微生物来源的β-葡萄糖苷酶在食品工业具有重要的应用价值[3]。β-葡萄糖苷酶的水解作用源于非还原端断裂β-糖苷键释放D-葡萄糖和糖基配体,一方面可将纤维低聚糖和纤维二糖水解成葡萄糖,对纤维素糖化获得单糖进行后续发酵具有关键性作用[4],另一方面可将难以被人体吸收的天然糖苷类物质如大豆苷等水解成易于吸收利用的苷元形式[5],也可以酶解多种不同糖苷键合态的香味前体物质,释放天然香气的风味物质[6],在β-葡萄糖苷酶的转糖苷作用下生成功能性低聚糖[7-8],碱性条件下更有利于形成聚合物[9]。功能性低聚糖如低聚龙胆糖、低聚纤维寡糖等可以作为益生元的功能性糖类,其中低聚龙胆糖比麦芽糖浆具有更高的吸水性和较低的黏度,可防止食品中的淀粉老化和保持食品中的水分,对双歧杆菌具有较强的增殖作用[10]。
多数生物倾向于利用64种密码子中的一部分,被频繁利用的称为最佳密码子,未被经常利用的称为稀有或利用率低的密码子,密码子的偏爱性是影响外源蛋白质异源表达的关键因素。巴斯德毕赤酵母(Pichiapastoris)表达系统是发展迅速的真核表达系统[11],相对原核表达来说,其外源基因稳定、分泌表达产物易于纯化及能进行蛋白翻译后加工修饰等特性使其得到广泛应用,已成功表达几种真核生物的β-葡萄糖苷酶基因[12-14]。由于毕赤酵母对密码子的偏爱性,对目的基因的来源特别是原核基因序列需进行优化才能提高表达产物量。
前期研究已实现短小芽孢杆菌β-葡萄糖苷酶基因在大肠杆菌中的克隆和表达,但大量表达产物易形成包涵体,导致酶活力较低,且需细胞破碎后才能分离产物。短小芽孢杆菌F1株β-葡萄糖苷酶基因中编码部分氨基酸(Arg、Pro、Cys和Ala等)的密码子在毕赤酵母中的使用频率较低。试验拟将细菌Bacilluspumilus的β-葡萄糖苷酶基因在毕赤酵母中进行优化表达,以期提高表达量和胞外酶活力,并测定其酶学性质,为β-葡萄糖苷酶在食品工业的应用及后续研究提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株及质粒
短小芽孢杆菌(Bacilluspumilus)F1株:本实验室筛选获得并保藏;
E.coliDH5α:生工生物工程(上海)股份有限公司;
毕赤酵母GS115、毕赤酵母表达载体pPICZαA:美国Invitrogen公司。
1.1.2 主要试剂
LB培养基、质粒提取试剂盒、博来霉素(Zeocin)、PCR 产物纯化试剂盒、T4DNA连接酶、DNA 相对分子质量标准、凝胶回收试剂盒、牛血清蛋白、考马斯亮蓝R-250、Bradford蛋白质试剂盒:生工生物工程(上海)股份有限公司;
EcoR I、NotI、SacI:美国Fermentas(MBI)公司;
对硝基苯基β-D-葡萄糖苷(pNPG):美国Sigma公司;
糖苷(七叶苷、苦杏仁苷、水杨苷、大豆苷、柚皮苷、D-海藻糖、熊果糖)、葡萄糖含量检测试剂盒:北京索莱宝科技有限公司。
1.1.3 仪器与设备
高速冷冻离心机:Allegra 64R Centrifuge型,美国BECKMAN COULTER公司;
紫外—可见分光光度计:Libra S22型,英国Biochrom 公司;
PCR仪:Applied Biosystems 2720 Therml Cycler型,美国ABI公司;
凝胶成像系统:BioSens 810型,上海山富科学仪器有限公司;
电穿孔仪:MicroPulser型,美国Bio-Rad公司;
高效液相色谱仪:Waters 1525/Alltech ELSD 2000ES型,美国Waters公司。
1.2 试验方法
1.2.1β-葡萄糖苷酶基因遗传密码的优化设计 在保持氨基酸序列不变的前提下,以毕赤酵母密码子使用频率为基准,利用密码子优化软件(http://www.jcat.de)对β-葡萄糖苷酶基因进行密码子优化设计,获得β-葡萄糖苷酶基因序列(bglK)。为方便基因重组和重组酶的纯化,基因编码序列5’端引入EcoR I限制酶位点,3’端增加6×His标签序列后再加上NotI限制酶位点。优化后的全基因序列进行人工合成后连接到pUC57载体,合成的全基因片段经测序分析完全正确后,用于酵母表达质粒的构建。
1.2.2 毕赤酵母表达载体的构建和转化 含有人工全合成基因的pUC57载体经EcoR I和NotI双酶切后,凝胶电泳分离基因bglK,T4连接酶16 ℃连接与经相同双酶切的pPICZαA载体片段,CaCl2法转入E.coliDH5α中,氨苄抗性(100 μg/mL)平板筛选重组菌,获得阳性转化子,提取质粒进行酶切和测序分析验证。重组质粒pPICZαA-bglK经SacI线性化后,加入200 μL毕赤酵母GS115感受态细胞并轻轻混匀,转入2 mm预冷电转化杯中,冰上放置5 min,放入电转化仪电击后涂板,30 ℃培养2 d至转化子出现,通过含不同Zeocin浓度(100,200,500,1 000 μg/mL)的YPD平板筛选多拷贝高表达转化子。使用载体通用引物进行PCR鉴定转化子,5’AOX引物序列:GACTGGTTCCAATTGACAAGC,3’AOX引物序列:GGATGTCAGAATGCCATTTGC,阳性对照以pPICZαA-bglK质粒为模板,pPICZαA-bglK转化子记为GS115/pPICZαA-bglK。
1.2.3 毕赤酵母工程菌株的分泌表达与鉴定 将多拷贝阳性转化子、GS115及GS115/pPICZαA空载毕赤酵母单克隆分别接种5.0 mL YPD液体培养基,30 ℃、220 r/min培养12 h,按10%的接种量转种含25 mL BMGY培养基的摇瓶中,30 ℃、250 r/min摇床培养至OD600 nm为2~6,室温离心收集菌体,轻轻倒出上清液,用BMMY液体培养基将细胞重悬至OD600 nm为1.0以诱导表达。30 ℃、250 r/min 继续培养,每24 h补加适量100%甲醇至终浓度为1.5%。每24 h取样,12 000 r/min离心10 min收集上清液即为粗酶液,分别进行酶活力检测、SDS-PAGE和Western Blotting鉴定。
(1) SDS-PAGE分析表达产物:600 μL样品菌悬液离心,取200 μL上清,采用生工TCA沉淀试剂盒沉淀蛋白,最终蛋白重悬液体积为20 μL,上样量20 μL,浓缩胶80 V,20 min,分离胶120 V,60 min,凝胶电泳结束后进行考马斯亮蓝染色20 min,脱色。
(2) Western Blotting鉴定:检测重组β-葡萄糖苷酶的表达情况[15],制备聚丙烯酰胺凝胶为浓缩胶5%,分离胶12%,样品20 μL上样。电泳参数为浓缩胶80 V,30 min;分离胶120 V,60 min。转膜为湿转,250 mA,52 min。5%脱脂奶粉封闭,37 ℃缓慢振荡1 h。一抗为兔抗His标签,1∶500稀释,37 ℃缓慢振荡60 min孵育一抗。二抗为羊抗兔,1∶8 000稀释,37 ℃缓慢振荡60 min 孵育二抗,四甲基联苯胺(Tetramethylbenzidine,TMB)显色。
1.2.4 重组β-葡萄糖苷酶活力测定 800 μL的0.05 mol/L 甘氨酸—氢氧化钠缓冲液(pH 9.0)和100 μL的 45 mmol/L pNPG在45 ℃条件下预热5 min,加入适当稀释倍数的酶液100 μL,反应10 min,加入2 mol/L Na2CO3溶液2 mL终止酶反应,再加入10 mL蒸馏水混匀,取适量反应液加入比色皿中,测定OD405 nm。β-葡萄糖苷酶酶活力单位(U)定义为在最适反应条件下,每分钟催化1 μmol底物pNPG 转化为产物pNP所需的酶量。
1.2.5 温度对重组酶活性的影响 在25~60 ℃(间隔5 ℃)的不同温度下测定酶活,确定重组酶的最适反应温度。将酶液分别在45,50,55 ℃水浴中保温处理3 h,间隔30 min取样,测定样品剩余酶活力,以保温前(0 h)样品的酶活力为100%,计算相对酶活力,研究重组酶在不同温度下残留酶活随时间变化情况,探究酶的温度稳定性。
1.2.6 pH对重组酶活性的影响 在最适温度45 ℃条件下,测定重组β-葡萄糖苷酶在pH 4.0~8.0(磷酸氢二钠—柠檬酸缓冲液)、pH 9.0~10.0(甘氨酸—氢氧化钠缓冲液)条件下的酶活,确定最适反应pH。将酶液于25 ℃分别在pH 4.0~10.0的缓冲液中保温2 h后测定剩余酶活力,以未处理酶活力为100%,计算不同pH条件下的酶活变化情况。
1.2.7 金属离子对重组酶活性的影响 在最适酶反应条件下,加入不同离子的溶液(终浓度为1,5 mmol/L),以未加入金属离子的酶活力为100%,测定重组β-葡萄糖苷酶在不同离子环境中的酶活力。
1.2.8 重组β-葡萄糖苷酶的动力学常数 以pNPG为底物,在45 ℃、pH 9.0条件下,测定不同底物浓度(0.25~40.00 mmol/L)下的反应速度,利用底物浓度和对应酶促反应速度,通过Lineweaver-Burk双倒数作图法,分析重组酶的动力学常数Km和Vmax值[16]。
1.2.9 底物特异性 在最适酶反应条件下,取终浓度为0.01 g/mL的糖苷类物质作为底物,反应时间10 min,再放入100 ℃水浴中煮沸5 min终止酶反应,通过葡萄糖试剂盒测定OD505 nm值。
1.2.10 转苷活性检测 取1 mL粗酶液,加pH 7.0的磷酸氢二钠—柠檬酸缓冲液配制50%葡萄糖浓度的反应体系,45 ℃反应48 h,煮沸10 min灭酶,0.45 μm滤膜过滤后进行HPLC检测分析。
HPLC条件:色谱柱为Hypersil APS-2,流动相为乙腈—水(体积比70∶30);蒸发光散射检测器;漂移管温度90 ℃;柱温30 ℃;流速1.0 mL/min;进样量5 μL。
1.3 数据处理
取3次平行试验的平均值,采用Excel 2010进行统计处理与作图。
2 结果与分析
2.1 毕赤酵母重组表达载体的构建
根据毕赤酵母密码子偏好性,优化设计源自短小芽孢杆菌F1株β-葡萄糖苷酶基因序列,将原始基因序列优化为适宜酵母表达的密码子,以提高表达效率,优化后的基因长1 485 bp,编码495个氨基酸。全基因序列由上海生工合成,合成基因被克隆到pUC57载体上,测序结果表明合成基因与设计的基因序列完全一致。
pUC57载体经EcoR I和NotI双酶切后,插入经相同双酶切的pPICZαA载体,转化大肠杆菌DH5α,经Amp抗性筛选,提取阳性克隆质粒,电泳结果如图1所示,重组质粒与计算值相符,合成基因成功克隆至表达载体,重组的表达载体命名为pPICZαA-bglK。SacI酶切重组表达载体,酶切后线性化片段约5 078 bp(载体3 593 bp +目的基因1 485 bp),电泳结果与理论值相符,纯化回收线性化片段进行转化。
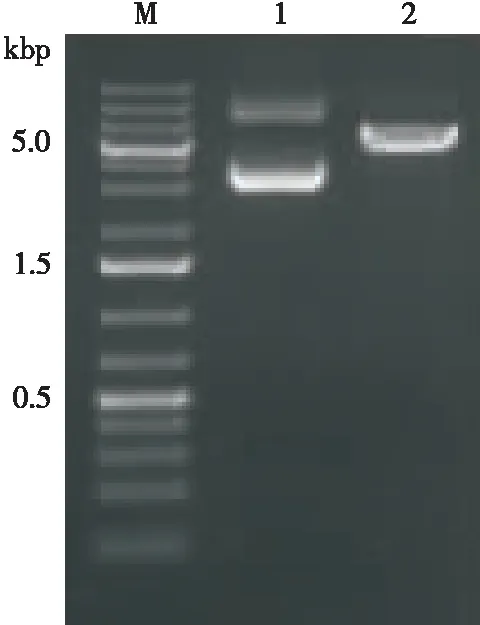
M. DNA marker 1. 重组质粒pPICZαA-bglK 2.SacI线性化pPICZαA-bglK
图1SacI线性化重组质粒pPICZαA-bglK
Figure 1 Linearization of recombinant pPICZαA-bglK bySacI
2.2 重组菌株的筛选和鉴定
线性化重组质粒片段电转化毕赤酵母GS115感受态细胞,在YPD抗性平板上共筛选获得56个转化子,挑选7个单克隆接种YPD液体培养基,提取酵母基因组DNA进行PCR鉴定,结果见图2。转化子基因组扩增箭头所指为目的基因条带,目的基因条带1 485 bp和载体上序列488 bp的总和约1 973 bp,PCR鉴定结果表明bglK基因已插入毕赤酵母基因组中,泳道2~8均为阳性转化子,转化子分别记为GS115/pPICZα-H1~H7。

M. DNA Marker 1. 阳性对照 2~8. H1~H7转化子PCR扩增
图2 PCR鉴定转化子
Figure 2 PCR amplification of transformants
2.3 重组菌株的分泌表达
摇瓶发酵诱导表达72 h后取样进行SDS-PAGE分析,由图3可知,目标蛋白理论大小约为57.5 kD,与泳道1 相比,泳道2~8明显出现条带。

M. 蛋白质分子量对照 1. 阴性对照GS115/pPICZα 2~8. H1~H7转化子发酵上清
图3 毕赤酵母重组表达蛋白的SDS-PAGE分析
Figure 3 SDS-PAGE analysis of the expressed protein produced fromP.pastoris
2.4 Western Blotting分析
由图4可知,在57.5 kD附近,2号泳道的一号菌株(GS115/pPICZα-H1)可见明显的条带信号,条带大小与预期相符,表明短小芽孢杆菌F1株β-葡萄糖苷酶基因在

M. 蛋白质分子量Marker 1. 阴性对照 2~8. 阳性转化子H1~H7发酵液上清
图4 重组β-葡萄糖苷酶的Western Blotting鉴定
Figure 4 Western Blotting analysis of the recombinantβ-glucosidase
毕赤酵母中克隆并分泌表达成功。其他泳道未见显色条带可能是转化子因整合酵母基因组位置不同导致蛋白表达上的差异,也可能是表达蛋白中His标签包埋程度不同导致显色信号差异。
2.5 重组酶的酶学性质
2.5.1 最适温度和温度稳定性 由图5(a)可知,当温度为25~45 ℃时,相对酶活呈逐渐上升趋势;当温度为45~60 ℃时,相对酶活逐渐下降,说明重组酶最适反应温度为45 ℃。由图5(b)可知,重组酶在45 ℃时非常稳定,50 ℃条件下酶的温度半衰期为3 h,55 ℃下保温1 h后酶活几乎为零。不同来源的β-葡萄糖苷酶,其最适温度分布在30~90 ℃[17]。
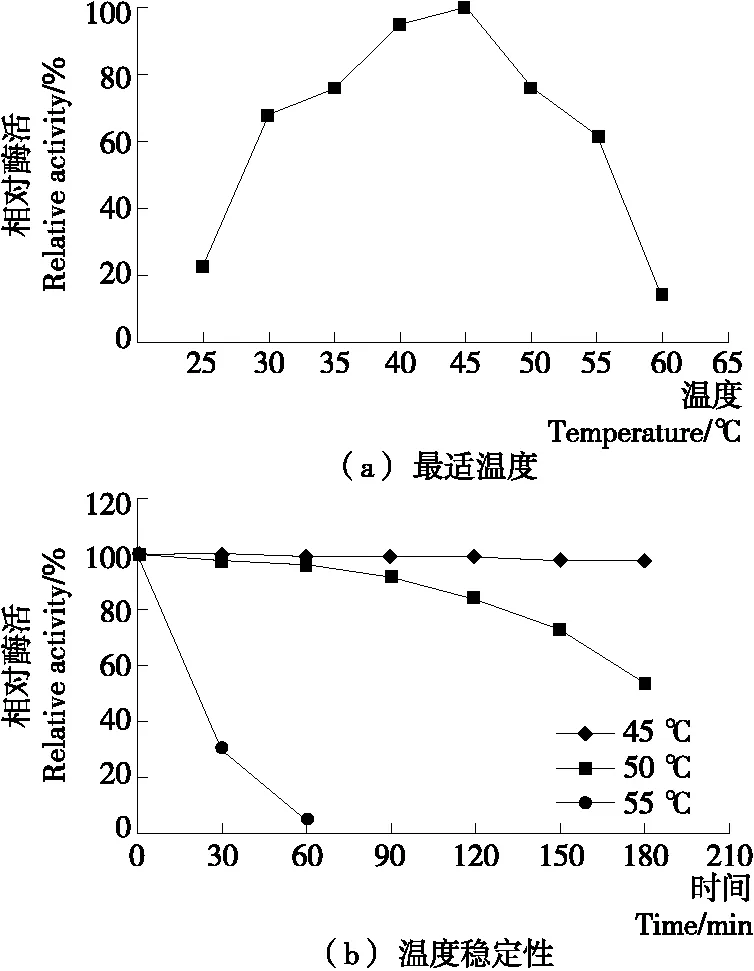
图5 重组β-葡萄糖苷酶的最适温度和温度稳定性
2.5.2 最适pH及pH稳定性 由图6(a)可知,伴随pH值的改变,重组酶酶活出现明显变化,pH处于5.0~6.0时,酶活较低;pH处于7.0~9.0时,相对酶活快速上升;pH处于9.0~10.0时,相对酶活快速降低;说明重组酶最适pH值为9.0,与文献[17]报道的多数β-葡萄糖苷酶的最适pH(3.5~6.5)一致。由图6(b)可知,pH在7.0~9.0时,重组酶25 ℃条件下放置3 h,依然保持80%以上的酶活力,说明重组酶在中性偏碱性条件下酶活力较高且比较稳定。
2.5.3 金属离子对重组酶活性的影响 由图7可知,测试的金属离子未表现出对重组β-葡萄糖苷酶活力的促进作用;在1,5 mmol/L的处理条件下,Na+、K+、Fe2+和Mg2+对重组β-葡萄糖苷酶活力的影响不大;Ca2+在5 mmol/L 时抑制了49%的酶活;Cu2+在1,5 mmol/L时分别抑制了77%,90%的酶活。不同来源的β-葡萄糖苷酶,金属离子对酶活力的影响差异较大,但Cu2+对多数β-葡萄糖苷酶具有抑制作用[17]。
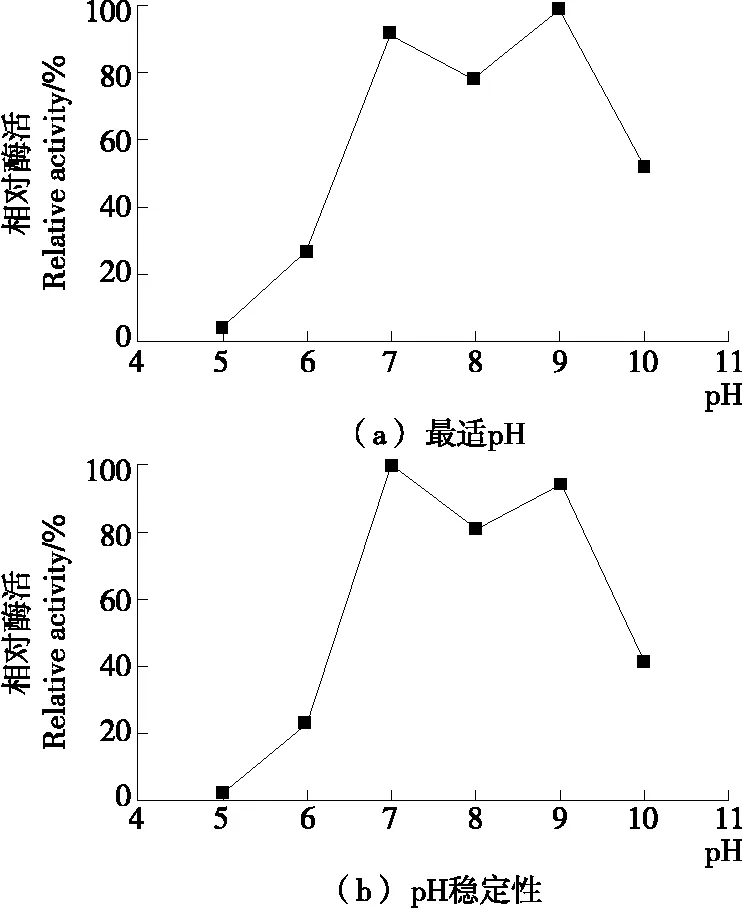
图6 重组β-葡萄糖苷酶的最适pH和pH稳定性

图7 金属离子对重组β-葡萄糖苷酶活性的影响
2.5.4 酶促反应动力学常数 诱导培养72 h,发酵液上清酶活力为25.39 U/mL。将重组β-葡萄糖苷酶与不同浓度的pNPG进行反应,测定不同底物浓度的酶促反应速度,通过双倒数作图法分析可知,酶促反应具有典型米氏动力学特性(图8),计算获得重组酶的Km值为1.26 mmol/L,Vmax为32.15 μmol/(min·mg)。
2.5.5 底物特异性 由表1可知,重组β-葡萄糖苷酶对海藻糖、苦杏仁苷、七叶苷、水杨苷、柚皮苷等糖苷类物质有一定的水解作用,对熊果糖、麦芽糖和蔗糖等无作用,对大豆苷其相对活力为pNPG的248%。大豆异黄酮在大豆中以糖苷和苷元两种形式存在,其中以糖苷为主要存在形式,酶水解糖苷释放出游离的大豆异黄酮苷元易被人体吸收[18-19]。此酶对大豆苷的水解反应表现出高效催化作用,有望用于制备功能和保健食品。
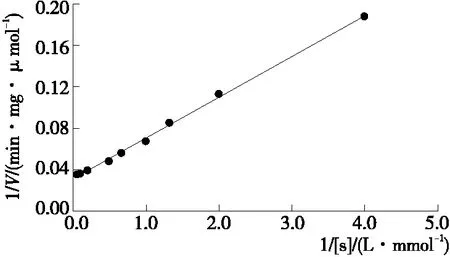
图8 重组β-葡萄糖苷酶的动力学方程
Table 1 Hydrolysis of the recombinantβ-glucosidase on some natural glycosidic substrates
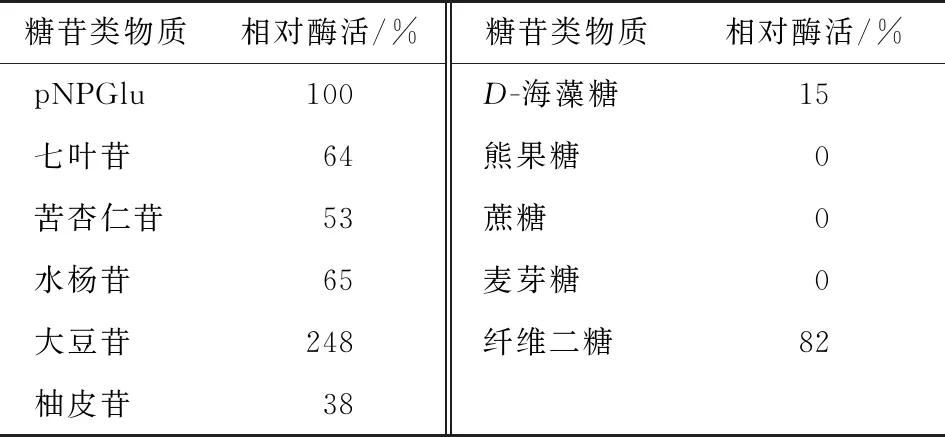
糖苷类物质相对酶活/%糖苷类物质相对酶活/%pNPGlu100D-海藻糖15七叶苷64熊果糖0苦杏仁苷53蔗糖0水杨苷65麦芽糖0大豆苷248纤维二糖82柚皮苷38
2.5.6 转苷活性 由图9可知,HPLC图谱显示酶催化反应产物中,出现与龙胆二糖标样保留时间一致的峰,表明重组酶有转苷活性,根据峰面积计算可知,龙胆二糖含量达34.25 g/L。
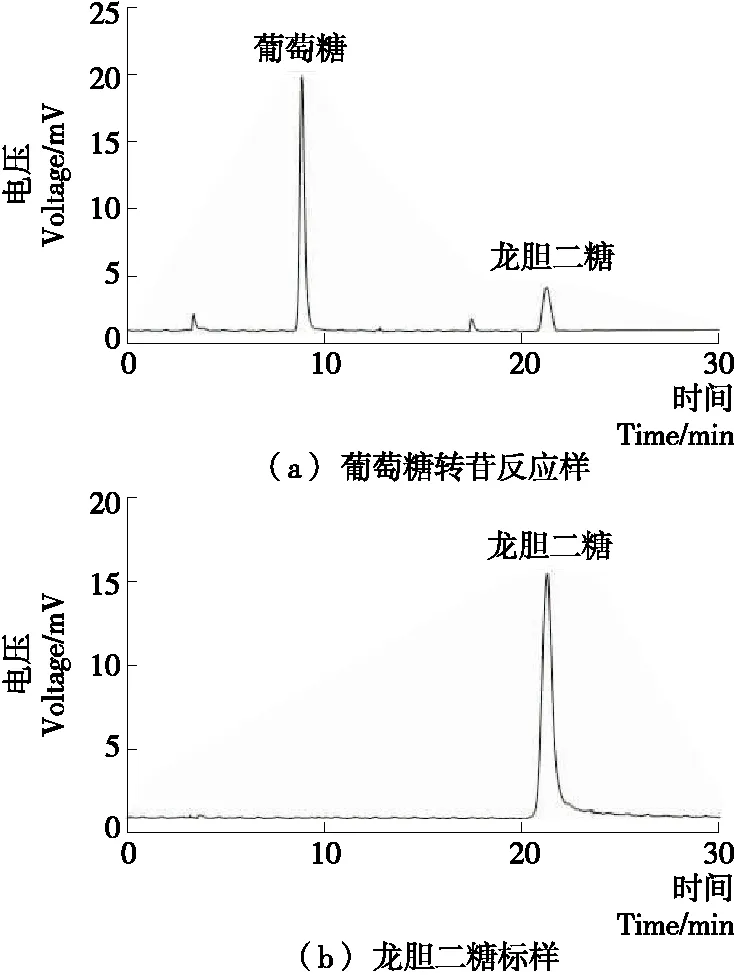
图9 转苷反应产物HPLC分析图谱
3 结论
试验将细菌Bacilluspumilus来源的β-葡萄糖苷酶基因在毕赤酵母中进行表达,结果表明,短小芽孢杆菌β-葡萄糖苷酶基因成功在毕赤酵母中克隆与分泌表达,方便蛋白质纯化,可进行高密度发酵培养,便于工业化生产。发酵上清中重组β-葡萄糖苷酶酶活力达25.39 U/mL,重组β-葡萄糖苷酶最适反应温度45 ℃,最适pH 9.0,在中性偏碱性条件下酶活力高且比较稳定,1,5 mmol/L的Cu2+分别抑制77%,90%的酶活。重组β-葡萄糖苷酶对大豆苷的高效水解和能够酶促合成龙胆二糖,表明其具有较高的应用开发价值,但仍需对大豆苷的水解条件及利用转苷活性生产龙胆低聚糖的性质和条件进行优化研究,为β-葡萄糖苷酶在食品工业的应用及后续研究提供依据。

