β-谷甾醇乙酸酯对脂质膜结构稳定性的影响
侯丽芬 - 宗珊盈 - 张海臣 -潘 丽 王宏雁 - 谷克仁, -,
(1. 河南工业大学化学化工与环境学院,河南 郑州 450001;2. 郑州旅游职业学院烹饪食品系,河南 郑州 450009;3. 中检集团中原农食产品检测〔河南〕有限公司,河南 郑州 450003;4. 吉林工程职业学院粮油食品学院,吉林 四平 136001;5. 河南工业大学化学粮油食品学院,河南 郑州 450001)
近年来,纳米脂质体用于食品中生物活性物质的包封和控释已成为一种有效的手段。脂质体已成功应用于包覆抗菌肽[1]、儿茶素[2]、乳铁蛋白[3]、抗坏血酸[4]、VE[5]和ω-3脂肪酸[6]等生物活性物质。脂质体通常是由一个或多个磷脂双分子层包裹一定体积的水相构成的囊泡[1, 7],主要由两亲性物质(如磷脂和甾醇等)制备[8]。胆固醇影响天然或合成膜的结构和性质,可以调节脂质膜的刚性、厚度、稳定性和流动性[9-11]。尽管胆固醇可以改善脂质体膜的特性,但患有高胆固醇血症患者应避免食用含胆固醇的食物。
植物甾醇有降低胆固醇作用,其结构与胆固醇类似,也含有环戊烷全氢菲骨架,仅在支链甲基和双键上存在差别。目前已有很多研究[12-14]发现植物甾醇能够代替胆固醇来构建稳定的脂质体。与植物甾醇相比,植物甾醇酯具有较高的脂溶性,同等或更优的生物活性[15-16],而对于植物甾醇酯掺入脂质体中的研究较少。Alexander等[17]采用植物甾醇酯制备大豆磷脂脂质体提高了水溶性制剂抗坏血酸的包封率。Wang等[18]采用高压均质法制备植物甾醇和植物甾醇酯大豆磷脂脂质体,为传递生物活性成分提供了一种实用的方法。然而,关于植物甾醇酯作为辅助膜材对脂质体膜结构稳定性的研究尚未见报道。试验拟通过薄膜—超声法制备β-谷甾醇乙酸酯(β-Sitosterol Acetate Ester,SAE)脂质体,考察其不同掺入浓度对脂质体粒径、PDI、电位及储藏稳定性的影响,并探究SAE与磷脂在膜中的相互作用,以期为相关研究提供一定的理论依据。
1 材料与方法
1.1 试剂
大豆磷脂(SPC):纯度98%,沈阳天峰生物制药有限公司;
β-谷甾醇(β-Sitosterol,Sito):纯度98%,上海依赫生物科技有限公司;
β-谷甾醇乙酸酯(SAE):纯度97%,实验室自制;
磷酸氢二钠、磷酸二氢钠、氯化钠、氯仿、甲醇等:分析纯。
1.2 仪器
超声波信号发生器:HN-500型,上海超声汉诺仪器有限公司;
旋转蒸发器:RE52-AA型,上海亚荣生化仪器厂;
真空冷冻干燥机:VFD-2000型,上海比朗仪器制造有限公司;
傅立叶变换红外光谱仪:PerkinElmer Spectrum TWO型,美国铂金埃尔默股份有限公司;
激光纳米粒度仪:Zetasizer Nano ZS90型,英国马尔文仪器有限公司;
热重仪:TGA Q50型,美国TA仪器公司。
1.3 试验方法
1.3.1 脂质体的制备 分别精密称取一定量的SPC(80 mg)、tween-80(60 mg)和SAE(Sito)(2,4,6,8 mg),置于圆底烧瓶中,加入10 mL有机溶剂(体积比为2∶1的三氯甲烷—甲醇溶液,)常温溶解,旋转蒸发除去有机溶剂(控制真空度0.06 MPa,水浴温度50 ℃),使壁材在圆底烧瓶壁形成一层均匀透明的薄膜,在真空度0.1 MPa下继续旋蒸30 min,注入0.02 mol/L磷酸缓冲溶液(PBS,pH 7.4,0.15 mol/L NaCl)10 mL水化脂质薄膜10 min。所得乳液在冰浴条件下,探头超声(200 W,8 min,脉冲1 s/1 s),得到呈现淡蓝色乳光的脂质体,4 ℃冷藏保存待分析。按相同方法制备不含SAE(Sito)的空白脂质体。
1.3.2 脂质体的粒径、多分散指数(PDI)和电位的测定
用高纯水稀释脂质体100倍,采用 Zetasizer Nano ZS90(DLS)测定其平均粒径、PDI和电位。PDI反映的是脂质体粒径分布情况,范围为0~1。PDI<0.3,说明脂质体呈现较好的单一性分散[19]。样品测量前,25 ℃下平衡20 s,每个样品测量3次,每次至少运行10次,数据表示为(均值±标准差)。
1.3.3 脂质体乳液的储藏稳定性 将制备好的脂质体放置于冰箱4 ℃左右,分别选取贮藏0,7,15,21,30 d的样品,按照1.3.2方法采用DLS测定其粒径、PDI和电位。
1.3.4 脂质体的冷冻干燥 取1.3.1制备的脂质体10 mL 于50 mL烧杯中,移入冷冻干燥机,首先在-20 ℃ 预冷冻4 h,然后在真空度1.0 MPa下,程序控温保持38 h,得到脂质体冷冻产品。
1.3.5 红外光谱分析 取少量1.3.4制备的冷冻干燥样品,采用PerkinElmer UATR TWO傅立叶红外光谱仪,全反射光谱测定法进行测定。光谱测定范围4 000~400 cm-1,仪器分辨率4 cm-1,扫描次数16。
1.3.6 热重(TGA)分析 TGA分析脂质体的热稳定性。冷冻干燥样品加热温度范围40~600 ℃,升温速率10 ℃/min,氮气流速60 mL/min。
1.4 数据处理与分析
采用Origin 8.0对试验数据进行处理,以(平均值±标准偏差)表示。采用SPSS 21.0对数据进行相关统计学分析,P<0.05有统计学意义。
2 结果与讨论
2.1 粒径与PDI
采用薄膜—超声法制备小单室脂质体,SAE的不同掺入量对脂质体粒径和PDI的影响如图1所示。由图1可知,随着SAE掺入量的增加,保持其他成分不变,加入0~6 mg SAE的脂质体粒径无显著差别(P<0.05),增加至8 mg时,粒径显著增大。PDI随着SAE掺入量的增加而逐渐增大,其中2 mg和4 mg的PDI无明显差异,分别为0.22和0.23。试验中SAE最大添加量8 mg,但是此时得到的脂质体粒径和PDI与对照样品相比均明显增大,可能是因为超出了其溶解度而破坏了脂质体结构。甾醇酯在磷脂膜中的溶解度很低,Zajicek等[20]报道胆固醇酯在完全水化的磷脂双层膜中溶解度非常有限,远远低于胆固醇。同时,Salmon等[21]研究表明胆固醇酯的最大掺入量随链长的增加而降低,例如蛋黄卵磷脂构成的多层膜中胆固醇酯的掺入量从胆固醇辛酸酯摩尔分数的5%到硬脂酸酯摩尔分数的1.4%,但是小单室脂质体的最大掺入量比多层膜高1.2~2.0倍。
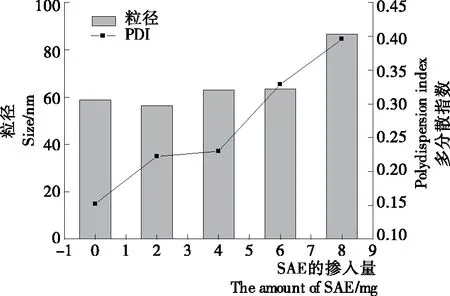
图1 SAE掺入量对脂质体粒径和PDI的影响
Figure 1 The effects of SAE incorporation on particle size and polydispersity index of liposome
Sito的不同掺入量对脂质体粒径和PDI的影响如图2 所示。由图2可知,随着Sito掺入量的增加对粒径无明显影响,而对PDI值有缓慢增加的趋势。已有研究[22]表明少量加入Sito对粒径影响不大,可能是少量Sito的加入填补了磷脂分子间的空隙,而对粒径无显著影响。同时Samar等[23]研究得出胆固醇在低浓度下(摩尔分数<5%)未显现出增强DPPC膜有序性的作用。Sito与胆固醇结构相似,在脂质体膜中有相似的作用。
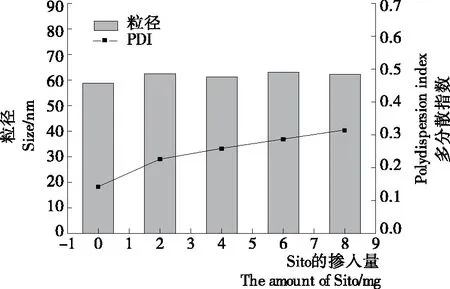
图2 Sito掺入量对脂质体粒径和PDI的影响
通过对比得出,在添加量为2,4 mg时,SAE和Sito有相似的粒径和PDI。
试验中掺入SAE的脂质体电位与对照样品无显著差异,为-19.1~-20.5 mV。Monica等[24]同样采用薄膜—超声法制备了含有胆固醇硬脂酸酯的脂质体,发现脂质体电位有稍微的降低。这一点在试验中不明显。
2.2 储藏稳定性
SAE和Sito不同掺入量脂质体在4 ℃下放置不同时间的粒径变化如图3所示。由图3(a)看出,在4 ℃下0~15 d,2~4 mg SAE脂质体粒径先增加后减小;15 d后粒径缓慢增大。而对于6~8 mg SAE脂质体来说,放置不同时间后,粒径均比0 d小,而且无明显规律性;这主要是由于此浓度下的脂质体在放置过程中出现不同程度的絮状沉淀(试验过程中肉眼观察),导致样品取样不均匀,同时也反映出其储藏稳定性较差。由图3(b)可知,2~4 mg Sito脂质体与相同掺入量的SAE脂质体变化一致。而6~8 mg Sito脂质体随着放置时间的延长,粒径缓慢增大,但无沉淀出现,与杨斌等[25]的研究结果相一致。
SAE和Sito不同掺入量脂质体在4 ℃下放置不同时间的PDI变化如图4所示。SAE掺入量为2,4 mg的脂质体PDI变化与Sito掺入量为2~8 mg的脂质体PDI变化一致,呈现先降低然后增加的趋势;且放置21 d后,均低于未掺入SAE和Sito的脂质体。而6~8 mg SAE脂质体的PDI由于放置过程中出现沉淀导致检测样品不均匀,因此无参考价值。
在4 ℃下储藏,与Sito脂质体相比较,SAE脂质体掺入量为2,4 mg的粒径变化较小,在30 d内可以保持较好的粒度分布性,说明其具有较好的储藏稳定性。
2.3 红外光谱分析
经过冷冻干燥的SAE和Sito脂质体红外光谱见图5。波数2 925 cm-1和2 850 cm-1分别与CH2不对称伸缩振动和对称伸缩振动有关,表明脂质膜双层酰基链的变化[26]。由表1可知,少量SAE和Sito的掺入并未与酰基链发生明显作用,同时与膜的界面羰基水化状态有关的C═O对称伸缩振动峰(V C═O)也未发生明显变化。但是,空白脂质体的P═O反对称伸缩振动峰(Vas P═O)为1 246 cm-1,而SAE脂质体迁移至1 241(2 mg),1 245(4 mg) cm-1,Sito脂质体迁移至1 243(2 mg),1 245(4 mg)cm-1。同时,可以看到P═O对称伸缩振动峰(Vs P═O),从空白脂质体的1 096 cm-1移至SAE脂质体的1 088,1 094 cm-1,Sito脂质体移至1 089,1 092 cm-1,且相应的峰强度也发生了变化。Vas P═O和Vs P═O降低说明脂质体与外来物质间的氢键增强了[27]。与Sito脂质体不同的是 (CH3)3N对称伸缩峰[V(CH3)3N],SAE脂质体由968 cm-1变为970 cm-1(2 mg)和965 cm-1(4 mg);而Sito脂质体无明显变化,丁武孝等[28]也研究发现胆固醇的羟基与季铵基团无静电作用。
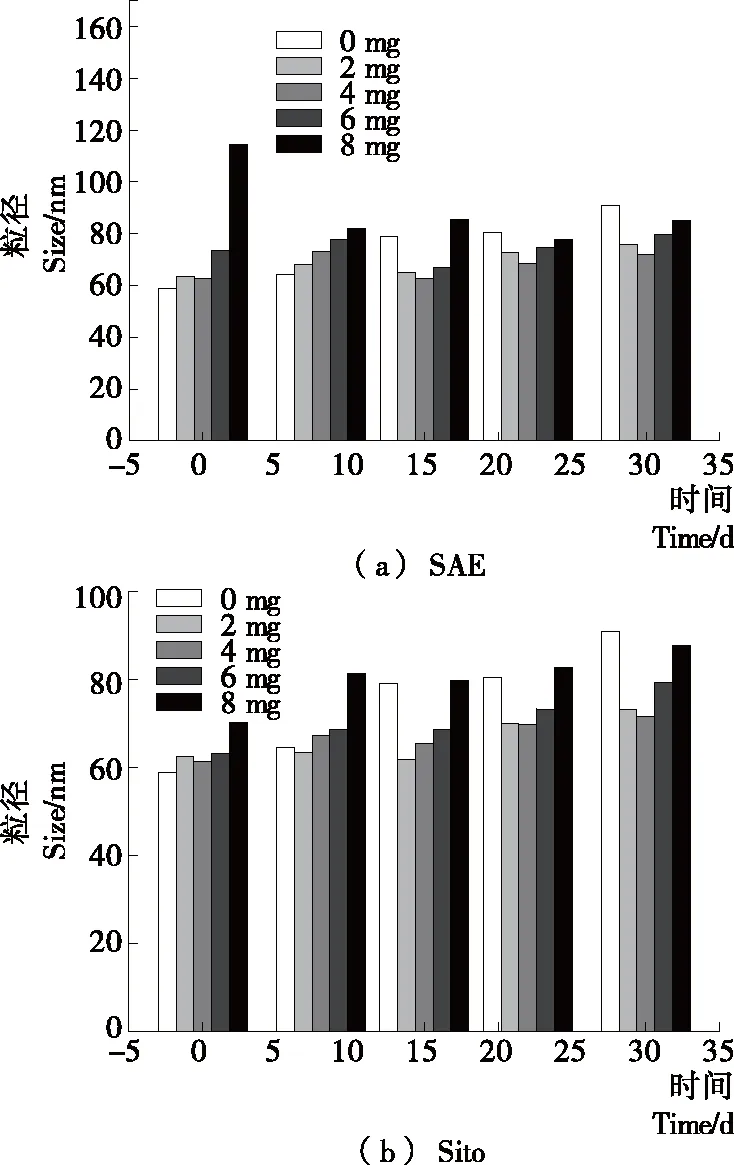
图3 SAE和Sito掺入脂质体在4 ℃下放置
Figure 3 The effects of incorporation of SAE and Sito on particle size of liposomes at 4 ℃ at different times
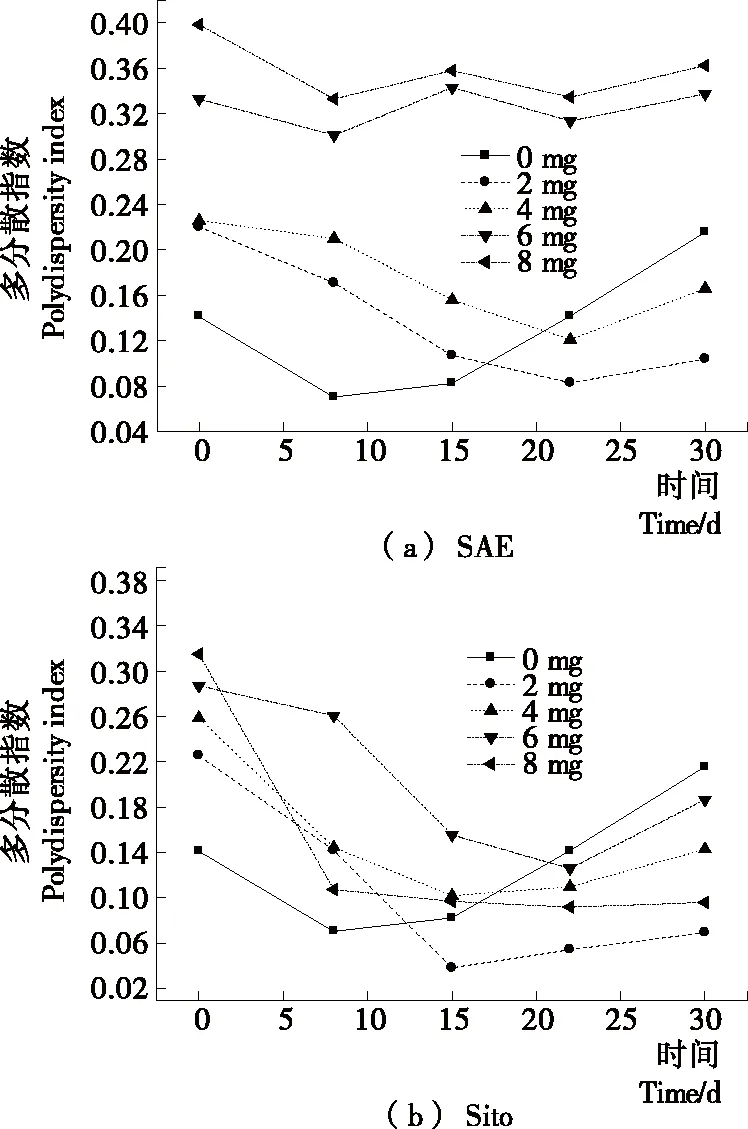
图4 SAE和Sito掺入脂质体在4 ℃下放置
Figure 4 The effects of SAE and Sito incorporation on polydispersity index of liposomes placed at 4 ℃ at different times
由上可知,SAE掺入脂质体中与磷脂的P═O和(CH3)3N之间有明显相互作用,而Sito仅与磷脂的P═O产生氢键。氢键的形成说明掺入物质与磷脂在脂质膜中结合紧密,有利于膜结构的稳定[29]。
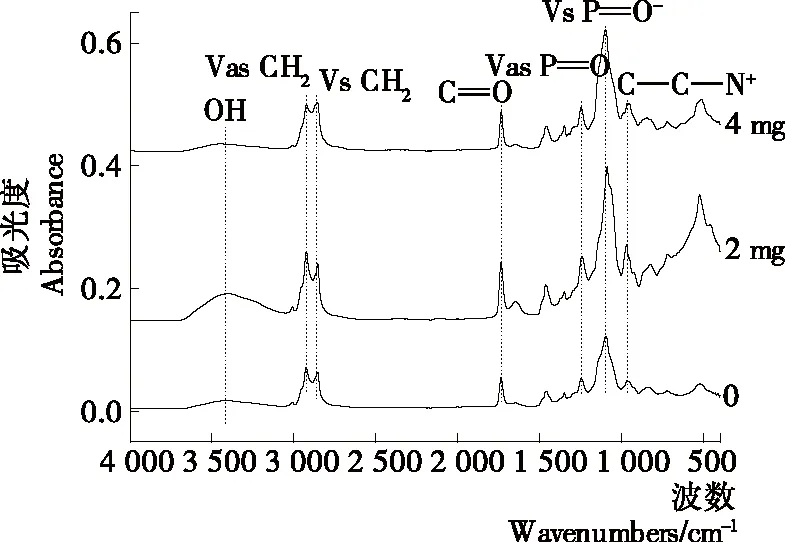
图5 SAE掺入脂质体的红外图谱
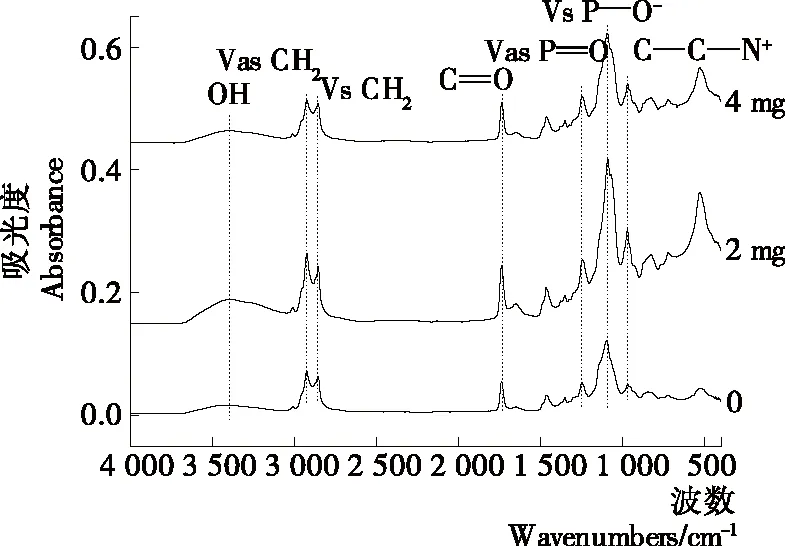
图6 Sito掺入脂质体的红外图谱
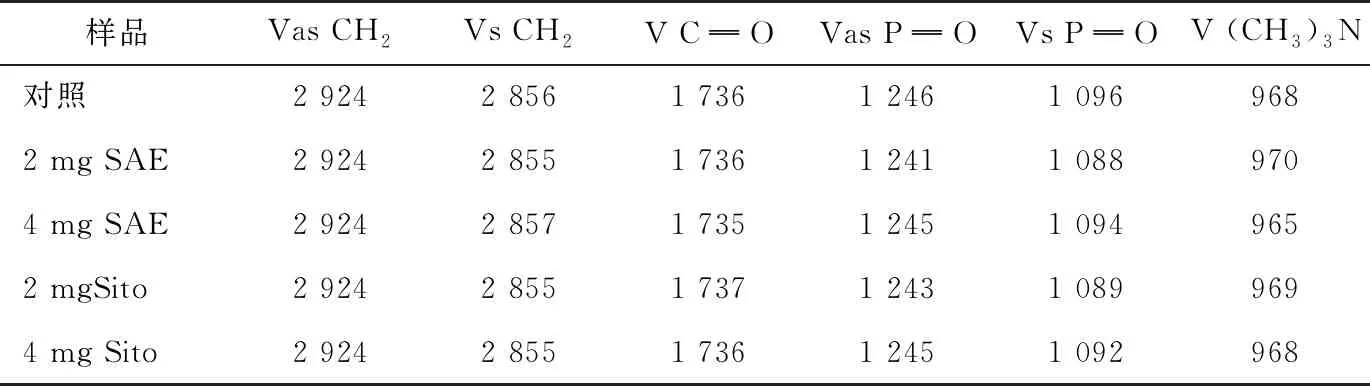
表1 不同脂质体对应的红外特征峰的波数
2.4 热重分析
采用热重法(TGA)测定冷冻干燥后SAE、Sito和未掺入脂质体经历高温的物理化学变化,如图7所示。热重分析结果显示,未掺入脂质体最后剩余质量的48.0%;2,4 mg SAE脂质体分别为46.4%和46.7%;Sito脂质体为47.1%,无显著差异(P<0.05)。图7中显示了不同脂质体的降解曲线,第一阶段重量的减少主要与样品中含有水分和挥发性物质有关[30-31],未掺入脂质体减少2.5%、2 mg SAE和4 mg SAE脂质体分别减少为3.4%和3.7%、4 mg Sito脂质体减少1.8%。在较高速率降解阶段,2,4 mg SAE脂质体分别在187~358,218~337 ℃时,稳定性高于未掺入脂质体;4 mg Sito脂质体在183~314 ℃时,稳定性高于未掺入脂质体。这是由于掺入SAE和Sito能使脂质体极性基团的氢键增强。张继芬等[29]也发现外来物质与磷脂形成氢键后会一定程度提高脂质体的热稳定性。
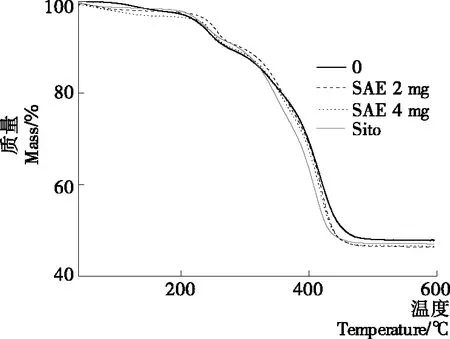
图7 SAE、Sito和未掺入脂质体的TGA分析
3 结论
试验将SAE掺入大豆磷脂脂质体中,考察其对所构建的脂质膜结构稳定性的影响。研究证明低掺入量的SAE脂质体粒度分布均匀,微观形貌较好,且具有较好的储藏稳定性。少量添加SAE与膜中磷脂分子极性头基形成氢键,提高了脂质体的热稳定性,起到了与Sito相似的稳定膜结构的作用。SAE保留了Sito大部分的官能团,掺入脂质体中还可能会引起脂质体的抗氧化性、包埋和释放性能的改变,因此,需要进一步开展相关的研究。

