鱼类III型Myosin基因家族成员的表达和功能研究*
赵呈天, 陈 哲, 冯 东
(中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003)
肌球蛋白(Myosin)是一个由多成员组成的超家族,对其最早的研究来源于骨骼肌细胞中II型肌球蛋白分子。人类细胞中存在超过40种肌球蛋白,分属于12个不同的家族[1]。肌球蛋白家族成员之间差异较大,但都可以分成头部、颈部和尾部三部分。肌球蛋白的头部是与运动相关的马达结构域,该结构在不同肌球蛋白成员间高度保守,是肌球蛋白分类的依据。肌球蛋白的颈部是连接头部和尾部的一段α螺旋,可以结合肌球蛋白轻链和钙调蛋白,来发挥其杠杆的作用。而肌球蛋白的尾部差异性较大,主要与其选择性结合的“货物(Cargo)”有关[1]。根据各种肌球蛋白的分子结构差异,一般将II型肌球蛋白称为经典肌球蛋白,其它的称为非经典肌球蛋白。其中,经典的肌球蛋白主要存在于肌细胞中,参与肌肉收缩等活动。非经典的肌球蛋白则在膜泡运输、细胞极性建立、细胞膜突起形成等过程中发挥功能[2-3]。
研究表明,一些非经典肌球蛋白基因的突变,会导致毛细胞的功能异常以致听力的丧失[4-8]。例如,肌球蛋白MyoXVa与包含PDZ结构域的蛋白whirlin以及肌动蛋白调节蛋白Eps8形成一个定位于听纤毛(Stereocilia)顶端的复合体,其功能异常会导致小鼠内耳听纤毛变短以及听觉的异常[4-5]。而肌球蛋白MyoⅦa作为Usher I型综合征(Usher syndrome type I, USH1)的致病基因,与USH1家族的其它成员形成复合体,共同参与内耳纤毛束的形态发生[6-8]。
脊椎动物的III型Myosin蛋白也属于非经典的肌球蛋白,包含Myo3a和Myo3b两个成员。研究表明,这两个成员均在内耳耳蜗处表达[9-10],其中Myo3a基因的突变,会导致人常染色体隐形非综合征性耳聋的发生[11-13]。小鼠中的研究表明,Myo3b基因的缺失并不会导致明显异常,而Myo3a基因缺失会导致听力丧失,且双突变小鼠的耳聋表型更加严重[10]。进一步研究表明,上述表型的产生可能与Myo3a,Myo3b以及其所运输的蛋白Espin-1的相互作用有关[14-16]。III型Myosin蛋白除了在耳蜗处定位以外,在眼睛的感光细胞中也有表达[17-18]。小鼠中的免疫染色结果表明,Myo3a和Myo3b在所有感光细胞的内节段均有定位[19]。同时,鱼类中的研究表明,III型Myosin蛋白在视网膜中有表达,且在感光细胞中有定位[20]。这些结果均暗示III型Myosin蛋白可能在感光细胞中也发挥一定功能。
目前,对III型Myosin蛋白的研究主要集中在细胞以及小鼠中,其在鱼类胚胎发育过程中的功能仍未见报导。与小鼠等哺乳动物相比,鱼类虽然在进化地位上较低等,但仍然具有一定的优势。首先,眼睛和内耳的发育在不同物种间相对保守,鱼类视网膜及感光细胞的结构组成与人类有很高的相似性;其次,虽然鱼类不具有哺乳动物的外耳和耳蜗等结构,但是具有类似的毛细胞和纤毛等结构,且与哺乳动物十分相似[21]。因此研究Myosin蛋白在鱼类胚胎发育中的功能对研究毛细胞及感光细胞的发育及进化机制具有一定的帮助。
斑马鱼(Daniorerio)是一种典型硬骨鱼类,具有饲养周期短、繁殖力强、胚胎透明等优点,同时其遗传操作较为方便,在研究基因进化功能方面具有显著优势[22]。本研究中,以模式鱼种斑马鱼为例,报导了III型Myosin基因家族成员在鱼类胚胎早期发育过程中的表达模式及功能。首先利用整胚原位杂交技术确定斑马鱼myo3a和myo3b基因的时空表达图谱,发现myo3a和myo3b在10体节之前均无表达。在受精后24 h的胚胎中,myo3a在脑部中表达,myo3b在神经管腹部脑脊液接触的神经元中表达,此外二者共同在内耳中表达。其次利用CRISPR/Cas9技术对myo3a和myo3b基因进行敲除并对突变体进行分析,发现myo3a和myo3b的单独缺失对斑马鱼胚胎发育并没有影响。进一步,通过对双突变进行分析,发现双突变存在眼睛变小,鱼鳔不能形成等现象,同时内耳毛细胞听觉纤毛显著变短,表明III型Myosin蛋白在斑马鱼发育过程中发挥功能。
1. 材料与方法
1.1 斑马鱼饲养
本研究中所使用的斑马鱼均为Tübingen品系。0~5 dpf (Days post fertilization, 受精后天数)的斑马鱼胚胎置于培养皿中培养,每天更换E3培养液(5 mmol/L NaCl, 0.17 mmol/L KCl, 0.33 mmol/L CaCl2, 0.33 mmol/L MgSO4)。5~30 dpf的幼鱼放置在鱼苗培养器中培养,每天喂养适量的草履虫,并且根据幼鱼的大小适量加入新鲜的丰年虾。30 dpf以上的斑马鱼养殖在28.5 ℃恒温水循环系统中,每天喂养适量的新鲜丰年虾两次,鱼房保持14 h光照/10 h黑暗周期。
1.2 整胚原位杂交实验
从斑马鱼的cDNA中扩增myo3a和myo3b基因特异的片段,基因信息获取自NCBI网站(myo3a: AF384863.1;myo3b:XM_001920252.7),并通过Oligo 7软件进行引物设计,序列如下:myo3a-F: 5’-TCCACCCCTGAAGAAATGAC-3’,myo3a-R: 5’-GCTTTGCCCTCCTCCTGTTG-3’;myo3b-F: 5’-TCAACATCGCTAACGAACAG-3’,myo3b-R: 5’-CGACCACCATCTTGGACAG-3’。扩增的片段连接至pEASY-T3载体(全式金,货号:CT301),测序后根据片段插入方向选择相应的RNA聚合酶,合成地高辛标记的反义RNA探针待用。实验中urp1和pkd2l1探针信息参考之前的工作[23]。
整胚原位杂交采用标准流程,简略如下:第一天,将保存在甲醇中的胚胎梯度水化至PBST,经多聚甲醛固定及蛋白酶K(Boehringer,货号:1000144)处理后,加入HYB-杂交液(50%甲酰胺,5×SSC,0.1% Tween-20),64 ℃孵育5 min,之后用HYB+杂交液(HYB-,0.5 mg/mL酵母 tRNA, 0.05 mg/mL肝素)进行预杂交,最后加入探针64 ℃孵育过夜;第二天吸去探针,分别用50%甲酰胺/2×SSCT、2×SSCT、0.2×SSCT于64 ℃梯度洗脱,然后加入封闭液(10%山羊血清,2% Block reagent,MABT)室温封闭1 h,最后加入偶联碱性磷酸酶的地高辛抗体(Roche,货号:11093274910),4 ℃孵育过夜;第三天吸去抗体,经MABT多次洗脱后,用BM purple显色液显色(Roche,货号:11442074001)。
双荧光原位杂交中,第二天抗体孵育时,加入偶联过氧化物酶的地高辛抗体(Roche,货号:11207733910)。第三天显色时使用TSA放大显色液(PerkinElmer, 货号:NEL744E001KT)室温显色2 h,PBST清洗后梯度替换至甲醇中,使用1%过氧化氢/甲醇处理胚胎30 min后梯度替换至PBST中。并用PBST、MABT清洗胚胎,然后加入封闭液室温封闭1 h后,加入偶联过氧化物酶的荧光素抗体(Roche,货号:11426346910)4 ℃孵育过夜。第四天吸去抗体,按照第三天的步骤洗去多余抗体后进行显色。显色后的胚胎保存于PBST中,使用徕卡SP8共聚焦显微镜拍照记录。
1.3 基因敲除及突变体筛选
本实验中使用CRISPR/Cas9技术对myo3a和myo3b基因进行了敲除,靶位点如下:myo3a-target: 5’-ACAGAGGTGCGGGACGCCAT-3’,myo3b-target: 5’-ATGTTTCTTCAGAAGCCCA-3’。突变体检测引物如下:myo3a-P5: 5’-TATGCAGCACCCGCTTATC-3’,myo3a-P3: 5’-CAATAGCCCCAGCAAATAAG-3’;myo3b-P5: 5’-CATCAGTTATTTGCTCAGGGAG-3’,myo3b-P3: 5’-GCTAATCAAAAGGAGAAGTCGG-3’。
1.4 免疫组化
整胚免疫组化步骤如下:选取发育至5 dpf的斑马鱼胚胎,用4%多聚甲醛4℃固定过夜后,PBST、双蒸水各洗2次,每次5 min。之后加入预冷的丙酮于-20 ℃通透10 min。然后用双蒸水洗2次、PBST洗2次。用封闭液(2%山羊血清,1%BSA, 1% DMSO,PBST)室温封闭1 h后,加入一抗,4 ℃孵育过夜。第二天吸去一抗,用PBD(1%BSA, 1%DMSO,PBST)洗4次,每次30 min,之后加入二抗,4 ℃避光孵育过夜。然后吸去二抗,用PBD洗4次,每次30 min,PBST洗2次,每次5 min。之后使用徕卡SP8共聚焦显微镜拍照记录。实验中使用的抗体比例:乙酰化微管蛋白抗体为小鼠单抗(Sigma, 货号:T6793,1∶500),鬼笔环肽(Invitrogen, 货号:A12379,1∶100),二抗为GAM546(ThermoFisher,货号:A11018, 1∶500)。
2 结果
2.1 整胚原位杂交揭示myo3a和myo3b的时空表达模式
为了研究斑马鱼中myo3a和myo3b基因的表达情况,选取胚盾期(Shield)、尾芽期(Bud)、5体节,10体节以及发育24 h时的胚胎进行整胚原位杂交。结果表明,myo3a和myo3b在10体节期之前均没有明显表达(见图1A、E, 部分数据未展示)。在24 hpf胚胎中,myo3a主要在脑部表达,并在端脑和间脑处高表达,同时在内耳部位可见明显染色,在72 hpf的胚胎中,其表达仍集中在脑部(见图1B~D)。myo3b的表达起始于14体节左右,在胚胎发育到24 hpf时,其表达主要集中在内耳以及腹部神经管区域,胚胎发育至72 hpf时内耳中仍有表达(图1F~H, 部分数据未展示)。
为进一步研究myo3b的表达模式,分别检测了该基因与腹部脑脊液接触神经元相关标记基因urp1,pkd2l1的表达共定位情况[23]。双荧光原位杂交染色结果表明,myo3b的表达与urp1有部分重合(见图1I~K),而与pkd2l1的表达基本重合(见图1L~N),表明myo3b可能在与脑脊液接触的神经元中发挥功能。
2.2 myo3b的基因敲除及突变体表型分析
对myo3a和myo3b基因的表达分析表明,与人、小鼠类似,二者均在斑马鱼内耳中有表达,暗示其在内耳发育中发挥一定的功能。同时,myo3b在脑脊液接触神经元中高表达,说明其可能参与调控了该神经元的生理活动。为进一步研究其功能,本研究利用CRISPR/Cas9技术构建了相关突变体。
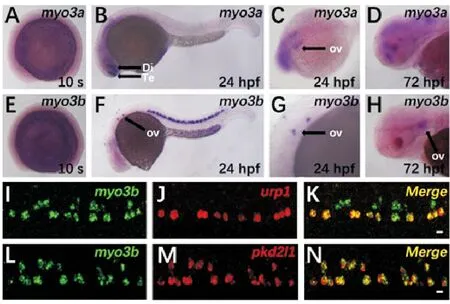
((A~H)myo3a和myo3b在10体节期(10 s)、24和72 hpf的原位杂交结果。Te: 端脑,Di:间脑,Ov: 耳泡。(I-N)24 hpf胚胎的urp1、pkd2l1和myo3b的双荧光原位杂交结果。比例尺=10 μm。(A~H) Whole mount in situ hybridization results ofmyo3aandmyo3bat 10-somite stage (10 s), 24 hpf and 72 hpf. Te: Telencephalon, Di: Diencephalon, Ov: Otic vesicle. (I~N) Double fluorescence in situ hybridization results ofurp1,pkd2l1andmyo3bat 24 hpf. Scale bar=10 μm.)
图1myo3a和myo3b在斑马鱼中的表达图谱
Fig.1 Expression pattern ofmyo3aandmyo3bin zebrafish
斑马鱼myo3b基因有2个转录本,其中最长的转录本包含35个外显子,开放阅读框全长为3 816 bp,编码1 272个氨基酸。myo3b基因的Cas9靶位点设计在第21个外显子上,为两个转录本共享外显子,该区域编码斑马鱼Myo3b蛋白的动力结构域。通过筛选,获得了缺失2 bp的突变体,该突变破坏了原基因组的NcoI酶切位点(见图2A~D),对两种转录本均造成阅读框移码以及翻译的提前终止。同时,qPCR和原位杂交结果显示,突变体中myo3b的表达量明显下调(见图2E、F),表明在突变体中发生了无义mRNA导致的降解现象[24-25]。
接着,对突变体胚胎早期的发育过程进行分析。首先,荧光原位杂交结果显示,myo3b突变体中脑脊液接触神经元的标记基因urp1和pkd2l1的表达无明显变化,表明myo3b的缺失不影响该神经元的形成(见图2F)。之后,利用抗乙酰化微管蛋白的抗体对内耳毛细胞的动纤毛(Kinocilia)进行染色。结果显示,myo3b突变体中内耳Crista和Macula的动纤毛无明显异常(见图3A、B)。同时,利用鬼笔环肽对内耳Crista和Macula中肌动蛋白组成的听纤毛(Stereocilia)进行染色,也没有发现明显异常(见图3A、B)。此外,纯合突变体成鱼可以存活并正常传代,表明myo3b基因的单独缺失不影响斑马鱼胚胎的发育。
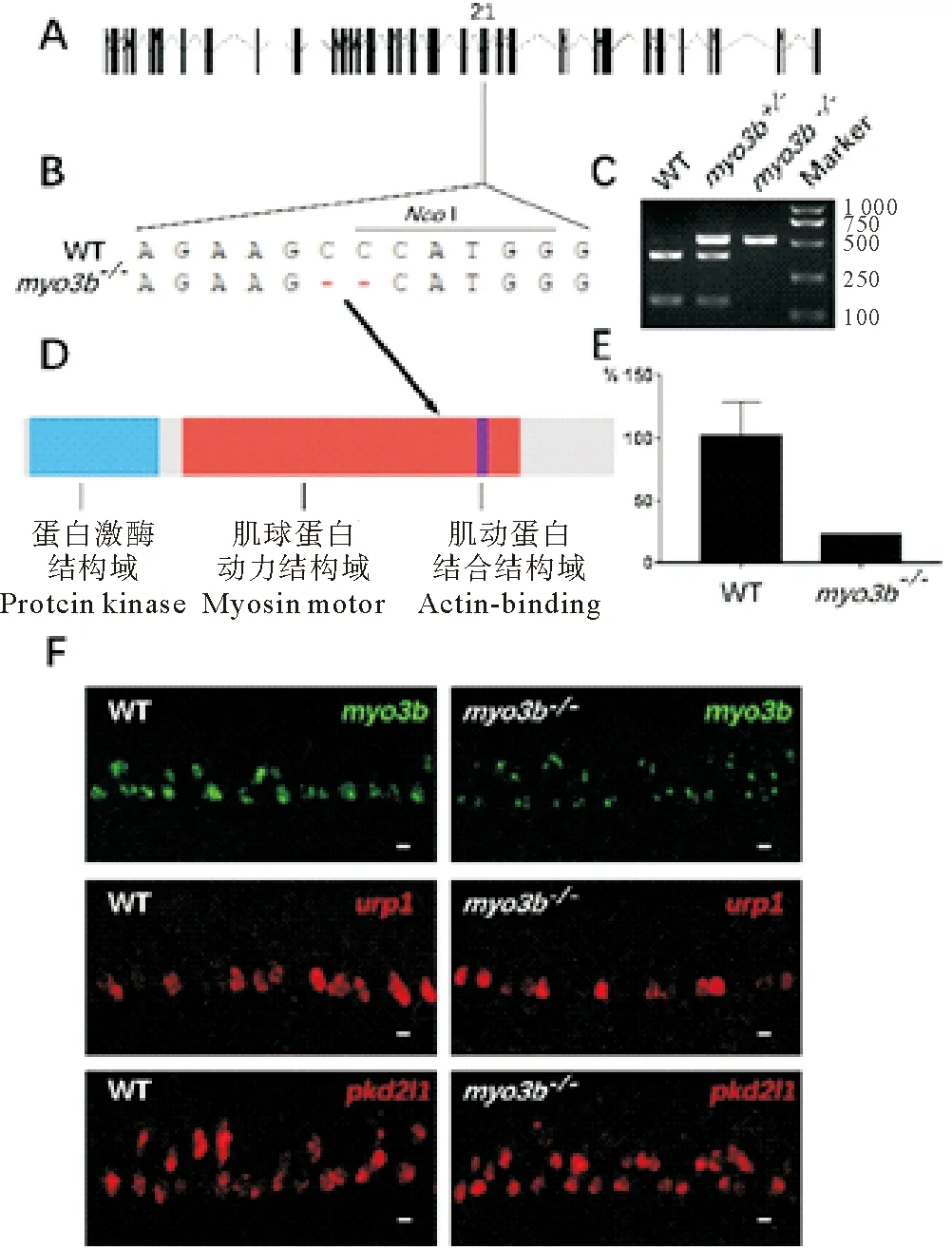
((A)myo3b的基因组结构。(B)野生型及突变体基因序列信息及突变位点导致的NcoI酶切位点变化。(C)野生型,杂合体以及纯合突变体NcoI酶切的电泳结果,野生型的PCR产物(525 bp)可以被切成385和140 bp两个片段,而纯合突变体无法切开。(D)Myo3b蛋白的结构示意图,箭头指示突变位点在蛋白上对应的位置。(E)qPCR结果显示24 hpf野生型及myo3b突变体胚胎中myo3b基因的相对表达量。(F)24 h野生型和myo3b突变体中myo3b、urp1和pkd2l1荧光原位杂交结果。比例尺=10 μm。WT:野生型。(A) Genomic structure ofmyo3b. (B) Sequences of wild type (WT) and mutant alleles. TheNcoI restriction site of the wild type allele is also labeled. (C) Genotype results of wild type, heterozygote and homozygote embryos. In wild type allele, the 525 bp PCR products can be digested into 385 bp and 140 bp fragments. (D) Diagram showing the structure domains of Myo3bprotein. Arrow indicates the position of the mutation site. (E) qPCR results showing relative expression ofmyo3bin 24 hpf wild type andmyo3bmutants. (F) Fluorescence in situ hybridization results ofmyo3b,urp1 andpkd2l1 in wild type ormyo3bmutant embryos. Scale bar=10 μm.WT:Wild type.)
图2myo3b突变体的构建及表型分析
Fig.2 Generation and phenotypic analysis ofmyo3bmutant
2.3 myo3a的基因敲除及突变体表型分析
myo3b突变体发育无显著异常,本研究推测可能是由于Myo3a功能冗余所造成。为此,进一步对myo3a基因进行了敲除。斑马鱼myo3a基因有3个转录本,其中最长的转录本包含38个外显子,开放阅读框全长为5 325 bp,编码1 775个氨基酸。在3个转录本共享的第19外显子上设计了Cas9靶位点(见图4A、B)。通过筛选,获得了缺失5 bp的突变体,该突变破坏了此处的NcoI酶切位点,造成移码突变,导致编码的Myo3a蛋白的动力结构域出现异常(见图4A~D)
与myo3b突变体类似,myo3a的突变体也可正常发育,对其内耳处纤毛的染色结果表明该突变体中Crista和Macula的纤毛基本正常(见图4E、F),同时鬼笔环肽的染色也没有发现差异(见图4E、F),这一结果与小鼠突变体并不完全相同[10]。
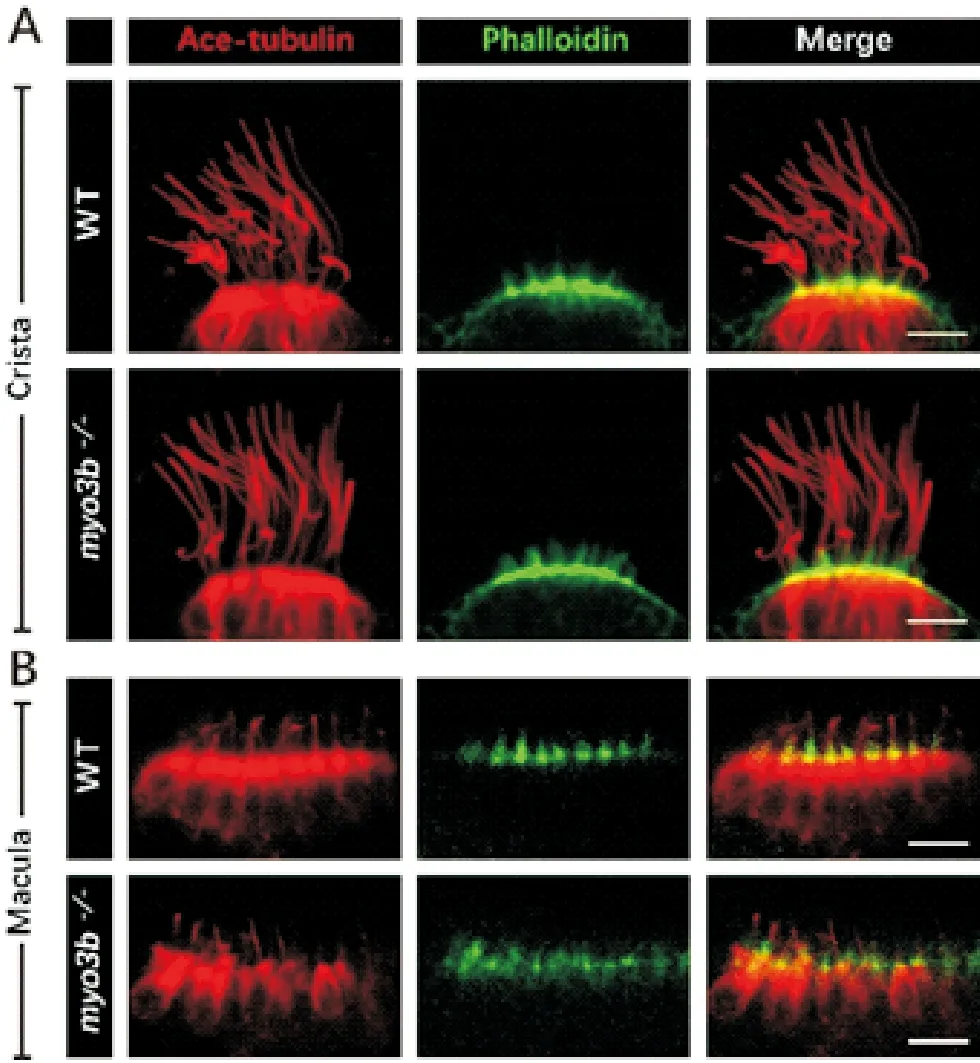
((A)内耳Crista毛细胞染色结果。(B)内耳Macula毛细胞染色结果。红色为抗乙酰化微管蛋白抗体所标记的动纤毛,绿色代表鬼笔环肽标记的听纤毛。比例尺=10 μm。(A) Immunostaining results of inner ear crista hair cells. (B) Immunostaining results of inner ear macula hair cells. Red channel shows kinocilia visualized by anti-acetylated α-tubulin antibody, green channel shows stereocilia visualized with phalloidin. Scale bar=10 μm.)
图3 受精后5天的野生型及myo3b突 变体内耳毛细胞表型分析
Fig.3 Phenotypes of inner ear hair cells of 5 dpf wild type andmyo3bmutants
2.4 myo3a和myo3b双突变的表型分析
由于myo3a和myo3b突变体均无明显的发育异常,进一步将两个突变体进行杂交并筛选得到了双突变体。与野生型胚胎相比,双突变体胚胎的眼睛显著变小(p<0.001),同时鱼鳔不能充气(见图5A、B)。进一步免疫组化结果表明,双突变体视网膜分层并无明显异常,感光细胞形态也基本正常,表明双突变仅延缓了视网膜整体的发育进程(见图5 C)。最后,对双突变胚胎的内耳毛细胞进行了研究,染色结果表明内耳Crista的动纤毛变短,同时鬼笔环肽所标记的听纤毛也变短(见图5D、E)。以上结果表明,Myo3a和Myo3b在斑马鱼早期胚胎发育过程中发挥功能,同时其在调控内耳毛细胞听纤毛发育方面也具有一定的进化保守性。
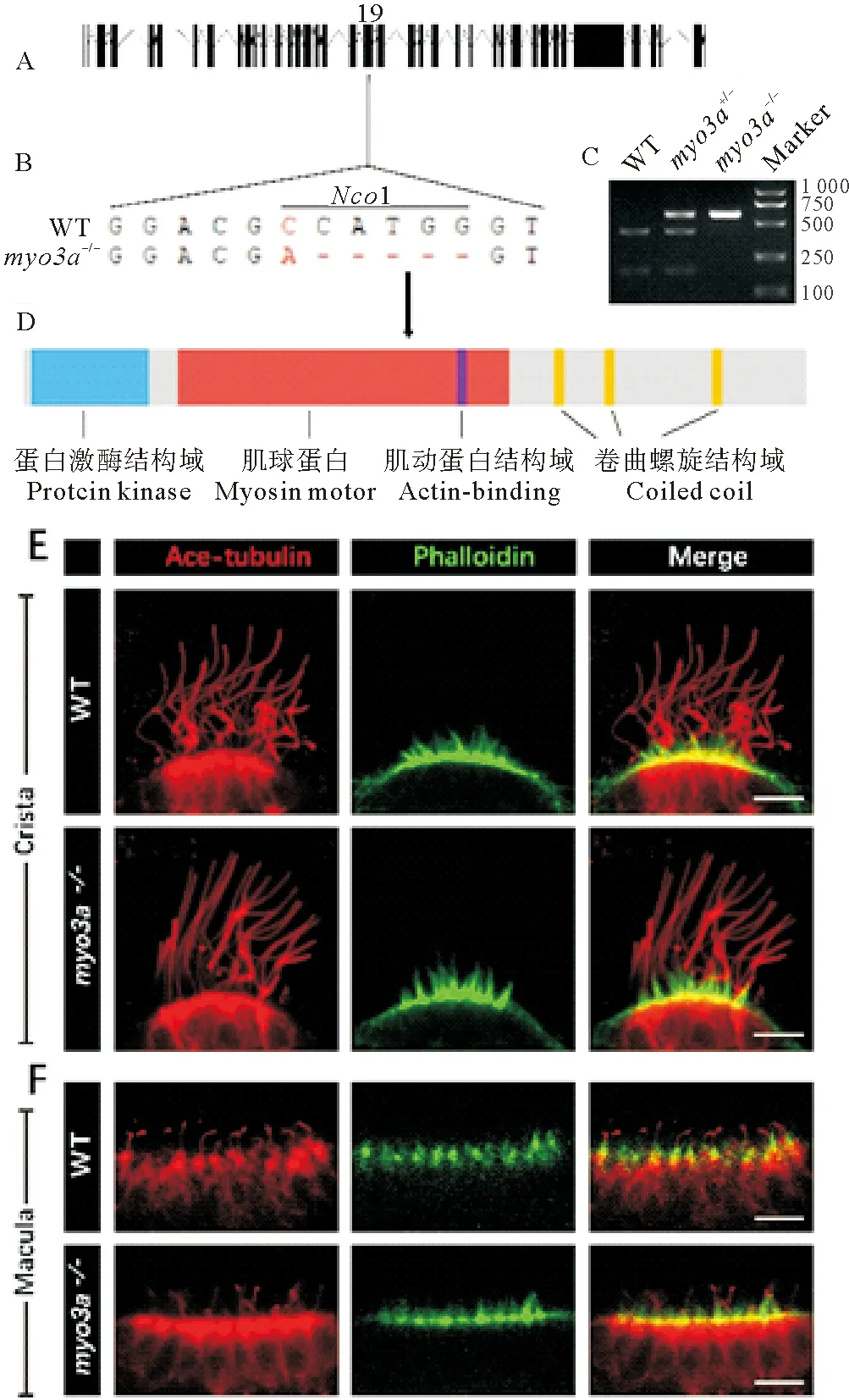
((A)myo3a的基因组结构。(B)野生型及突变体基因序列信息及相应的NcoI酶切位点。(C)野生型,杂合体以及纯合突变体NcoI酶切的电泳结果,野生型PCR产物(596 bp)可以被切成422和174 bp片段,而纯合突变体无法切开。(D)Myo3a蛋白的结构示意图,箭头指示突变位点在蛋白上对应的位置。(E)内耳Crista纤毛染色。(F)内耳Macula纤毛染色。红色为抗乙酰化微管蛋白抗体染色,绿色代表鬼笔环肽染色。比例尺=10 μm。(A) Genomic structure ofmyo3a. (B) Sequences of wild type and mutant alleles. TheNcoI restriction site of the wild type allele is also labeled. (C) Genotype results of wild type, heterozygote and homozygote embryos. In wild type allele, the 596 bp PCR product can be digested into 422 bp and 174 bp fragments. (D) Diagram showing the structure domains of Myo3aprotein. Arrow indicates the position of mutation site. (E) Immunostaining results of crista hair cells; (F) Immunostaining results of macula hair cells. The red and green channels are the same as
Fig. 3 Scale bar=10 μm.)
图4myo3a突变体构建及内耳纤毛染色
Fig.4 Phenotype ofmyo3amutants

((A)野生型及myo3a/myo3b双突变体外观图,箭头指示鱼鳔。(B)野生型和myo3a/myo3b双突变胚胎眼睛面积统计。(C)野生型和myo3a/myo3b双突变眼睛免疫染色结果。红色由zpr-1抗体标记双锥细胞,绿色由鬼笔环肽标记,蓝色由DAPI标记细胞核。(D)内耳Crista纤毛染色。红色由乙酰化微管蛋白抗体标记,绿色由鬼笔环肽标记。(E)野生型及突变体内耳Crista听纤毛长度统计。比例尺=10 μm,***,p<0.001。(A) External phenotype of wild type andmyo3a/myo3bdouble mutants. Arrows indicate the swim bladder of wild type larva. (B) Statistical results of the eye size in wild type ormyo3a/myo3bdouble mutants. (C) Immunostaining results of sections through the central retinae of wild type andmyo3a/myo3bdouble mutants. Staining with zpr-1 antibody is showed in red, phalloidin is showed in green, nucleus is labeled with DAPI in blue. (D) Immunostaining results of the inner ear crista. Staining with anti-acetylated α-tubulin antibody is showed in red, and stereocilia is labeled with phalloidin in green. (E) Dotted plots of the length of stereocilia in the inner ear crista of wild type and double mutants. Scale bar=10 μm.***,p<0.001.)
图5myo3a/myo3b双突变表型分析
Fig.5 Phenotypes ofmyo3a/myo3bdouble mutants
3 讨论
本文中首次对斑马鱼III型Myosin基因家族成员myo3a和myo3b进行了研究。整胚原位杂交结果显示myo3a及myo3b均在斑马鱼的内耳中表达,暗示二者在调控内耳毛细胞发育过程中有一定的功能。在对这两个基因进行敲除后,发现myo3a或myo3b的单独缺失对内耳发育无显著影响,但在双突变胚胎中,内耳Crista听纤毛的发育存在明显异常,表明二者功能存在冗余。这一点在小鼠中也有类似结论,例如小鼠Myo3b突变体听纤毛无明显异常,Myo3a的突变体仅有轻微听觉障碍,而双突变小鼠听力显著下降,主要原因是因为内耳听纤毛排列异常所导致[10]。
但目前仅发现在内耳Crista毛细胞中存在发育异常现象,Macula纤毛并未发现明显异常。推测斑马鱼等硬骨鱼类存在基因扩增现象导致的基因功能冗余,可能是对这种现象的一种解释。虽然仅仅鉴定出该家族的Myo3a及Myo3b两个成员,不排除该家族中有未知成员的存在,同时其它Myosin家族也在内耳中高表达[26],可能在鱼类内耳中发挥更重要的功能。
有趣的是,myo3b基因除了在斑马鱼内耳中有表达之外,在24 hpf胚胎的神经管中也有十分特异的表达,且该表达模式与pkd2l1基因基本一致。pkd2l1主要在脑脊液接触的神经元中表达,在调控胚胎运动方面发挥重要功能[27],这些结果暗示Myo3b可能在调控该神经元的发育以及胚胎运动方面发挥作用。近期的一篇研究结果也指出Myo3b可能定位在该神经元接触脑脊液一侧的“花环”状结构中[28],这一点也与本研究的结果一致。虽然urp1以及pkd2l1在myo3b突变体中表达无明显异常,但该脑脊液神经元的生理功能可能受到了影响,未来利用膜片钳等方法研究双突变体中该神经元的生理功能以及其所调控的胚胎运动缺陷机制是一个重要研究方向。

