水环境中微塑料的污染现状、生物毒性及控制对策*
李爱峰,李方晓,邱江兵,闫 晨,柳 超, 孟范平, 李正炎, 李 瑾,郎印海,胡 泓
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100; 2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100; 3.中国海洋大学水产学院,山东 青岛 266003)
2004年,英国普利茅斯大学汤普森教授首次提出关注水环境中塑料垃圾碎片问题,并开展了早期的调查研究工作[1]。2008年,美国国家海洋和大气管理局(NOAA)针对微塑料问题组织了国际研讨会,正式将尺寸小于5 mm的塑料碎片、纤维或颗粒等定义为“微塑料”(Microplastics, MPs)[2]。根据形状不同,微塑料可分为球形、卵形、纤维状等;根据颜色不同,常见的微塑料有透明、白色、灰白色等;根据化学成分分类,包括聚氯乙烯(PVC)、聚苯乙烯(PS)、聚丙烯(PP)、高密度聚乙烯(HDPE)、低密度聚乙烯(LDPE)、聚对苯二甲酸乙二醇酯(PET)等[3]。随着人们对环境中微塑料分布的调查研究和生物毒性的暴露实验,水环境中微塑料污染已成为人们高度关注的热点环境问题之一。本文通过查阅近年发表的研究论文,就国内外水环境中微塑料的污染现状和生物毒性效应方面的研究进展综述如下。
1 水环境中微塑料的污染现状
1.1 微塑料的来源与迁移
自20世纪50年代,各式各样的塑料制品不断问世,塑料产量呈指数增长的趋势,2015年全球产量达3.22亿t,预计到2025年总产量将达6亿t左右[4]。其中部分塑料制品经使用后被废弃,除一部分回收和集中填埋处置外,大量的塑料垃圾随地表径流迁移至海洋,并在河口、海湾等近岸海域漂浮、沉积或聚集。据统计,全世界每年生产的塑料制品,其中10%最终进入海洋,占所有海洋废弃物的60%~80%[5]。这些极难降解的塑料垃圾通过风化、海水侵蚀、生物分解等物理、化学、生物作用形成微塑料,能够在环境中长期存在,且通过潮汐、洋流作用不断迁移扩散。另一部分微塑料是化工生产制造的塑料颗粒材料或洗化用品添加的塑料微球,在生产过程中直接排入水环境。据统计,全球海水中总计约有35 000 t微塑料碎片[6],它们在潮间带、近海沉积物中积累,或在水体中悬浮,可被浮游生物、鱼类、鸟类和海洋哺乳动物摄食[7]。根据模型预测,中国2011年入海的塑料垃圾是54.73~75.15万t,至2017年以每年4.55%的比率增加,直至2020年降至25.71~35.31万t[8]。微塑料来源及其在水环境中的迁移途径如图1所示。因此,海洋微塑料对海洋食物网中不同营养级生物的毒性效应,受到人们的高度关注。
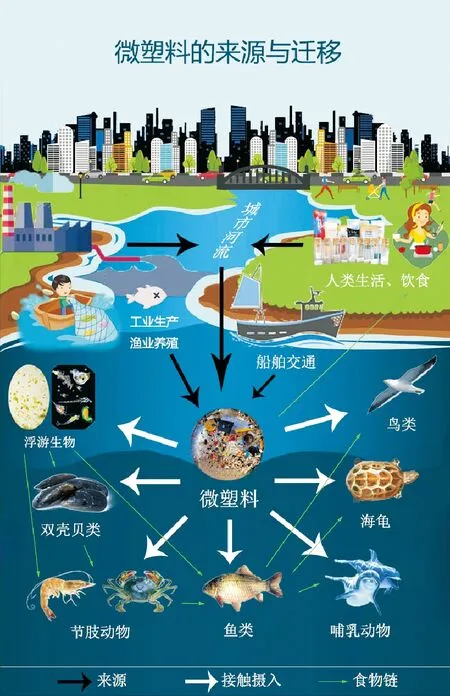
图1 微塑料来源及其在环境中的迁移途径
1.2 微塑料在海水与沉积物中的分布
人们对微塑料污染问题的关注起源于海洋污染和水生生物健康,针对海水和沉积物介质中微塑料的分布先后开展了大量调查工作,并发现微塑料在全球范围内广泛分布。如地中海东部地区黎巴嫩海岸(Levantine盆地)的调查结果显示,西顿地区水样中微塑料含量高达6.7 n/m3(即个/m3,本文均使用字母n表示微塑料个数)[9]。在伊朗哈尔克岛(Khark Island)海区,微塑料主要以粒径≤100 μm的纤维与碎片为主,丰度范围为(295±100)~(1 085±100) n/kg干重,有多达近十种颜色,以黑色、透明、白色、棕色为主,表明其来源十分广泛[10]。在丹麦南菲英群岛(South Funen Archipelago)的水体中微塑料颗粒丰度平均为(0.07±0.02) n/m3,包括碎片(0.02±0.01) n/m3和纤维(0.05±0.02) n/m3,微塑料的丰度相对较低[11]。
由于海水样品中微塑料的采集工作相对困难,人们更多是在潮间带沙滩或沉积物中开展微塑料污染的调查研究。Alomar等发现,地中海西部马略卡岛(Mallorca Island)和卡夫雷拉岛(Cabrera Island)沿岸沉积物中微塑料的丰度为(100±60)~(900±100) n/kg干重,其中有些站位的丰度最高的微塑料粒级范围大于2 mm,而有些站位的丰度最高的微塑料粒级范围小于0.25 mm[12],而在地中海的黎波里的沉积物中发现微塑料含量高达4 680 n/kg干重[9]。波兰波罗的海沿岸海滩沉积物中微塑料颗粒丰度(25~53 n/kg干重)显著高于海底沉积物中微塑料颗粒丰度(0~27 n/kg干重),以透明纤维状聚酯纤维(PEST)的微塑料为主,尺寸范围为0.1~4 mm(以0.1~2 mm粒径范围为主)[13]。在波罗的海南部俄罗斯加里宁格勒沿岸海滩的调查显示,微塑料主要是0.5~5 mm的泡沫塑料,1.3~36.3 n/kg干重[14]。在意大利托斯卡纳(Tuscany)南部第勒尼安海域(Tyrrhenian Sea)的沉积物中微塑料形态以细丝为主(>88%),主要有黑色、蓝色和透明,42~1 069 n/kg干重,推测其丰度分布的差异可能与洪水有关[15]。在突尼斯北部的比塞大(Bizerte)泻湖-海峡水域的沉积物中检测到高丰度的微塑料(3 000~18 000 n/kg干重),主要为0.3~5 mm不等的微塑料纤维和碎片,包括透明、白色、蓝色、绿色、红色和黑色等颜色,是微塑料污染的一个重灾区域[16]。Eo等在韩国沿海沙滩开展了较系统的调查工作,发现微塑料碎片尺寸较小,以小于300 μm(81%)粒径为主,1~5 mm的大尺寸微塑料以发泡聚苯乙烯(EPS)为主(95%),0.02~1 mm的小尺寸微塑料主要是聚乙烯(PE 49%)和聚丙烯(PP 38%),大、小尺寸微塑料的丰度分别为0~2 088 n/m2和1 400~62 800 n/m2(约为0~55 n/kg干重和37~1 674 n/kg干重),且小尺寸微塑料主要源自沙滩风化过程[17]。比利时港口、沙滩和大陆架沉积物中微塑料丰度范围分别为66.9~390.7、48.7~156.2和71.5~269.5 n/kg干重,说明微塑料颗粒在海洋环境中被远距离迁移扩散,这可能与良好的水动力条件有关[18]。
人们对微塑料进入波罗的海的途径进行分析,发现处理前后的废水、处理前后的雨水径流以及综合下水道溢流都是微塑料的来源,人类活动强度与微塑料分布未呈现明显的相关性[19]。在法国布列塔尼(Brittany)布列斯特湾(the Bay of Brest),表层水和沉积物中微塑料碎片的种类组成依次是聚乙烯(PE 53%~67%)、聚丙烯(PP 16%~30%)和聚苯乙烯(PS 16%~17%),沉积物(表层5 cm)和表层水体中微塑料的含量分别为(0.97±2.08) n/kg干重和(0.24±0.35) n/m3,这可能是由于海湾的水动力条件导致微塑料碎片在水体中垂直迁移且在表层沉积物中发生非均匀性的沉积分布[20]。另外,在远离人类活动的南极区域,南极洲罗瑟拉研究站(Rothera Research Station)附近海洋沉积物中微塑料的检测结果显示,主要在靠近人为污染物排放处有微塑料检出(<500 n/L),以直径≤0.1 mm的纤维为主,颜色多样,主要来自衣物洗涤过程中的排放[21]。
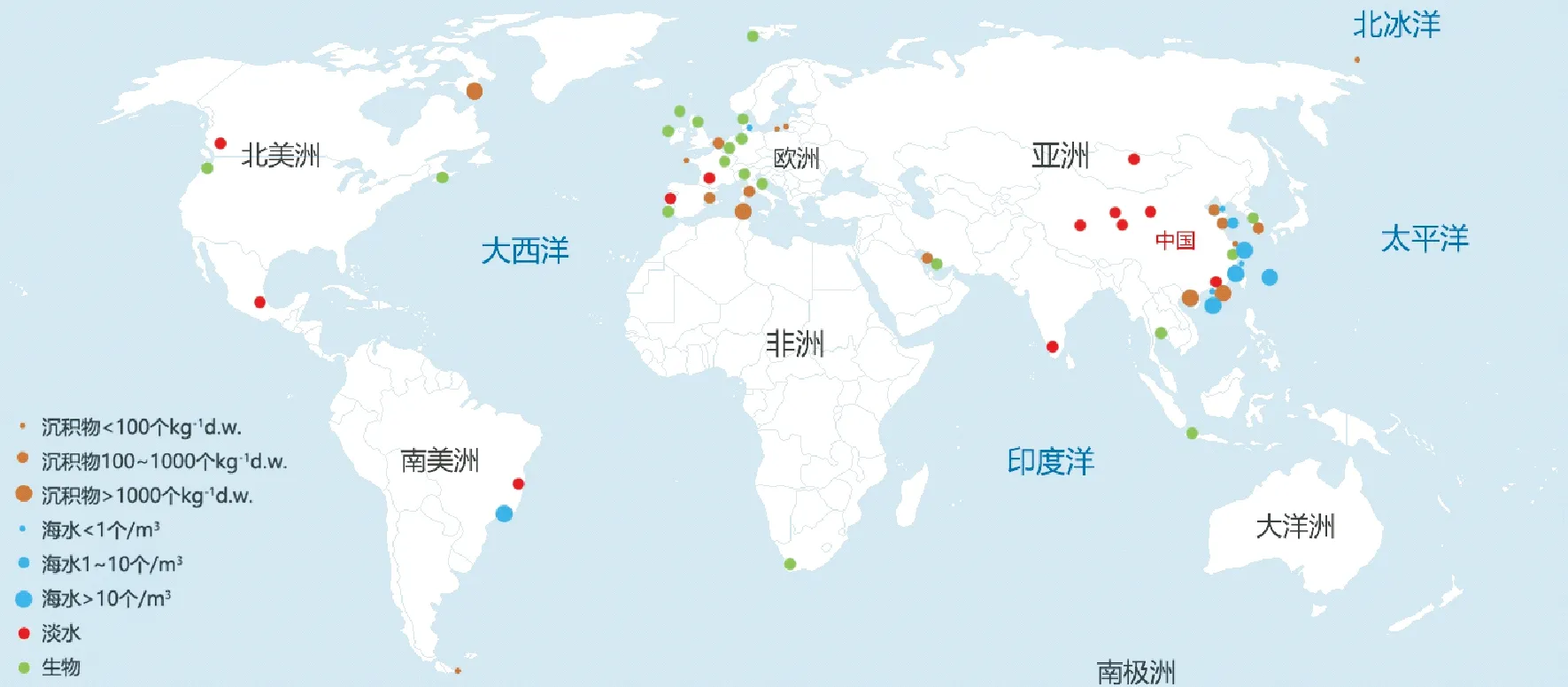
图2 微塑料在水环境中的分布情况
近年,我国科研人员对中国沿海水体和沉积物中的微塑料污染情况也进行了较全面的调查。研究发现,我国渤海表层水体中微塑料平均丰度为(0.33±0.34) n/m3,主要类型为聚乙烯(PE)、聚丙烯(PP)和聚苯乙烯(PS),塑料碎片、线条和薄膜占大部分[22]。科研人员采用Bongo网在我国南海海域采集的尺寸> 333 μm的微塑料碎片平均丰度为(0.045±0.093) n/m3,用水泵富集方式采集的尺寸<0.3 mm微塑料的平均丰度为(2 569±1 770) n/ m3,且发现南海分布的微塑料颗粒以小尺寸的醇酸和聚己内酯聚合物为主[23]。我国东海河口区微塑料丰度为(4 137.3±2 461.5) n/m3,而外海中微塑料丰度为(0.167±0.138) n/m3;形状以纤维为主,其次是颗粒和薄膜形态[24]。我国北黄海表层海水和沉积物中微塑料丰度分别为(545±282) n/m3和(37.1±42.7) n/kg 干重,以小尺寸(<1 mm)的微塑料为主(>70%),其中主要是薄膜和纤维形态,透明的微塑料更为常见;表层海水中的微塑料成分以聚乙烯(PE)为主,而沉积物样品中微塑料成分以聚丙烯(PP)为主[25]。长江口沉积物中微塑料的平均丰度为(121±9) n/kg干重(20~340 n/kg干重),其中纤维(93%)、透明(42%)和<1 mm小尺寸(58%)微塑料最多,人造丝、聚酯和丙烯酸是最丰富的微塑料类型[26]。在不同海区同期的调查中发现,渤海、北黄海和南黄海沉积物中微塑料丰度平均值分别为171.8、123.6和72.0 n/kg干重,其中纤维(93.88%)和小尺寸(<1 mm)微塑料(71.06%)最为常见,主要材质是人造丝(RY)、聚乙烯(PE)和聚对苯二甲酸乙二醇酯(PET)[27]。
综上,微塑料颗粒在海水、海滩和沉积物中广泛分布,且丰度波动较大,其来源具有多样性,在环境中的分布与水动力条件具有密切关系。
1.3 淡水与沉积物中微塑料的分布
虽然大部分微塑料最终汇入海洋,但其源头主要是由于人类在陆地上的生产和生活过程排放,通过水流汇集至河流而入海,因此淡水水体中微塑料含量也不容忽视,并可对预测海水微塑料污染的程度提供依据。
调查显示,美国西部蛇河(Snake River)表层水体中微塑料检出率为75%,丰度为0~5 405 n/m3,大多数碎片、薄膜和颗粒的尺寸在100~333 μm[28]。韩国纳克东河(Nakdong River)20 μm以下的微塑性物质的时空分布研究显示,平均丰度范围为(293±83)(上游,2017年2月)至(4 760±5 242)(下游,2017年8月)n/m3,沉积物中为(1 970±62) n/kg干重,水中聚丙烯和聚酯分别占41.8%和23.1%,而沉积物中约50%由聚丙烯和聚乙烯组成,粒径小于300 μm的在水中占74%,在沉积物中占81%,大多分布在50~150 μm[29]。印度文巴纳德湖(Vembanad Lake)沉积物中分布的微塑料以低密度聚乙烯(LDPE)为主,平均丰度为(252.80±25.76) n/m2(96~496 n/m2)[30];英国伯明翰中部埃德巴斯顿池(Edgbaston Pool)沉积物中微塑料最大丰度达到250~300 n/kg干重,纤维和薄膜是最常见的类型[31]。
我国淡水环境中微塑料分布的调查结果显示,在三峡水库湘西支流的回水区表层水和沉积物中均检测到微塑料,其丰度分别为0.55×105~ 342×105n/km2和80~864 n/m2;表层水中的微塑料成分主要是聚乙烯、聚丙烯和聚苯乙烯,沉积物中的微塑料成分包括聚乙烯、聚丙烯、聚对苯二甲酸乙二醇酯和颜料[32]。另一项有关三峡水库微塑料的研究结果显示,表层水中微塑料丰度为1 597~12 611 n/m3,沉积物中微塑料丰度为25~300 n/kg湿重;微塑料形状以纤维为主,颜色以透明为主,化学成分依次为聚苯乙烯(38.5%)、聚丙烯(29.4%)和聚乙烯(21%)[33]。在珠江干流及其支流以及珠江口进行MPs检测,结果在河水、河床沉积物和河口沉积物中广泛检测到MPs,其丰度分别为(570±710) n/m3、(685±342) n/kg干重和(258±133) n/kg干重,以片状、碎片状和纤维状聚乙烯、聚丙烯和乙烯-丙烯共聚物为主。这表明珠江流域的MPs主要来源于废弃塑料废物的破碎[34],进一步分析表明,MPs具有一定的持久性和潜在的向下分散性;MPs丰度与人口密度和国内生产总值呈正相关,表明人类活动和经济发展对MPs污染的影响;旱季MPs丰度高于雨季,说明降水具有稀释效应。北江是我国珠江水系的三大干流之一,其沿岸表层沉积物中微塑料丰度为(178±69)~(544±107) n/kg干重[35]。我国最大的内陆湖泊青海湖表层水中微塑料丰度为0.05×105~7.58×105n/km2、入水河流中丰度为0.03×105~0.31×105n/km2、湖滨沉积物中丰度为50~1 292 n/m2,湖泊表层水中微塑料以小尺寸(0.1 ~ 0.5 mm)为主,河流样品中大尺寸微塑料(1~5 mm)的比例较高,形状主要呈薄片和纤维状,聚合物类型主要是聚乙烯(PE)和聚丙烯(PP)[36]。
1.4 微塑料在生物体内的积累
水环境中分布的微塑料能够直接与水生生物接触,潜在威胁水生生态系统的健康。为此,研究人员对野外采集的水生生物样品开展了大量的调查研究,初步阐明了微塑料在水生生物体内的积累现状。
Courtene-Jones等在北大西洋罗科尔海槽(Rockall Trough)深海水体的调查结果显示,深海水体中微塑料的丰度为70.8 n/m3,与表层水体中微塑料的丰度相当;在深海水体采集的近半数(48%)无脊椎动物检出微塑料,其积累量与沿海动物相当[37],说明微塑料在海水中能够垂直迁移并被深海生物摄食。有关哺乳动物鲸类摄入微塑料的研究虽然个体样本较少,但在统计的搁浅或被捕获的528个生物个体中,45个(8.5%)鲸类个体含有塑料碎片,其中21个个体含有大的塑料碎片(>5 mm),21个个体含有微塑料碎片(<5 mm),另有3个个体既含有大的塑料碎片,又含有微塑料碎片;鲸类动物积累的微塑料形状主要是纤维(83.6%)和碎片(16.4%),说明微塑料也能够在大型海洋哺乳动物体内积累[38]。亚得里亚海北部和中部调查海区95%(n=533)的底栖比目鱼Soleasolea体内检出微塑料,其中约80%的比目鱼胃肠道含有一种以上的微塑料成分,2014和2015年每条鱼体内微塑料的平均含量分别为(1.73±0.05)和(1.64±0.1)个,最常见的聚合物类型是聚氯乙烯、聚丙烯、聚乙烯、聚酯和聚酰胺,其中72%为碎片,28%为纤维[39]。在北极海区采集的72条极地鳕鱼Boreogadussaida幼体的胃肠部检测到两例含有非纤维状的微塑料,其成分为环氧树脂和高岭土与聚甲基丙烯酸甲酯的混合物,说明随着人类活动范围的扩大,微塑料已经被分散至北冰洋海区[40]。在亚得里亚海和伊奥尼亚海(Ionian Sea东北部)采集的7种鱼类的230个样本中检出微塑料,在伊奥尼亚海东北部海区的检出率为40%,在亚得里亚海北部海区的检出率高达87%[41]。在中国地区采集的21种海水鱼和6种淡水鱼,100%的海鱼和95.7%的淡水鱼样品中发现了微塑料,丰度在0.2~17.2 n/g(每条鱼1.1~7.2个),底栖性海鱼体内的微塑料含量明显高于底栖性淡水鱼,且以透明、纤维状为主[42]。
此外,人们在4个洲13个国家生产的20个品牌的沙丁鱼罐头中发现,4个品牌的沙丁鱼罐头检出微塑料,最常见的成分是聚丙烯(PP)和聚对苯二甲酸乙二醇酯(PET)[43]。在英国超市供应的贻贝食品中检出微塑料的含量平均为1 400 n/kg,且50%的塑料碎片属于微塑料,其中37%是人造丝和棉纤维[44],说明人们日常食用水产品制品具有摄入微塑料的风险。南美洲半干旱地区人们常食用的滨岸护胸鲶(Hoplosternumlittorale)积累微塑料的调查结果显示,83%的个体肠道内含有塑料碎片且以微塑料(<5 mm)为主(88.6%),其中纤维状最为常见(46.6%)[45]。Hanachi等使用从波斯湾和里海收集的鲑鱼、沙丁鱼和基尔卡鱼制成的鱼食养殖鲤鱼,鱼食(67%)和鲤鱼胃肠道与鳃(65%)中MPs的主要形态是碎片。聚丙烯和聚苯乙烯是鱼食(分别为45%和24%)和鲤鱼(分别为37%和33%)中最常见的塑料聚合物,鲤鱼体内MPs含量与鱼食中MPs含量呈显著正相关,因此海洋来源的鱼食可使MPs转移到养殖鱼类中,需引起水产养殖行业的关注[46]。
在我国南海北部大陆斜坡深海鱼类中,所有样品都受到了MPs的污染,反映出该地区MPs污染程度很高,鱼的胃中MPs的平均丰度为(1.96±1.12) n/个体((1.53±1.08) n/g),鱼的肠道中的含量为(1.77±0.73) n/个体((4.82±4.74) n/g);从200~209和453~478 m的深度采集鱼类,在该范围内不同深度的鱼类摄取的MPs数量没有显著差异;鱼类摄入的微塑性物质主要是尺寸小于1 mm、膜状、颜色透明、由玻璃纸组成的塑料[47]。Feng等在我国海州湾海水养殖区,调查了6种主要野生鱼类(赤鼻棱鳀Thryssakammalensis、六丝矛尾鱼Amblychaeturichthyshexanema、红齿棘球蚴Odontamblyopusrubicundus、半滑舌鳎Cynoglossussemilaevis、矛尾鰕虎鱼Chaeturichthysstigmatias和棘头梅童鱼Collichthyslucidus)的消化组织和非消化组织中MPs的积累情况,发现所有的鱼都检出MPs;通常栖息于河口地区的赤鼻棱鳀体内的MPs含量最高,为(22.21±1.70) n/个体((11.19±1.28) n/g),而半滑舌鳎((13.54±2.09) n/个体)和矛尾鰕虎鱼((1.61±0.56) n/g)积累微塑料的含量最低;MPs形态以纤维为主,颜色以黑色或灰色为主,成分以玻璃纸为主[48]。
美国西部蛇河(Snake River)表层水体中分布的浮游生物样品大多含有微塑料,用浮游生物网(>100 μm)采集的样品中微塑料的检出率为92.8%,丰度0~14 n/m3,大多数碎片、薄膜和颗粒的尺寸在100~333 μm[28]。Reynolds等人对非洲南部湿地生活的7种鸭子的粪便和羽毛样品进行了分析,发现5%的粪便样品(n=283)和10%的羽毛样品(n=408)含有微塑料纤维,与当地污水处理厂的尾水排放有关[49]。在葡萄牙各地采集到288只搁浅水鸟,在12.9%的水鸟胃中检测到塑料,大多数为1~5 mm的白色或透明的生活用微塑料[50]。
综上研究,微塑料在水环境中的分布情况如图2所示,但未标注的海区不能说明不存在微塑料污染,而是缺少相关的调查研究。
2 微塑料的生物毒性效应
微塑料可通过食物链传递影响不同营养级生物的健康。近年来,科研工作者采用室内模拟实验探讨了不同材质、不同大小的微塑料颗粒对浮游植物、浮游动物、贝类、鱼类等生物的毒性效应,为科学评价微塑料对水生生物的健康风险提供了重要依据。
2.1 微塑料对浮游植物的毒性效应
Zhang等发现,聚氯乙烯微塑料颗粒(~1 μm)对海洋中肋骨条藻(Skeletonemacostatum)的生长具有显著抑制作用,在50 mg/L条件下可抑制微藻的生长,暴露96 h后的最大生长抑制率达39.7%,但较大尺寸(~1 mm)的塑料碎片对其生长没有抑制效应,说明遮光效应不是微塑料抑制微藻生长的原因,而主要是由于微塑料颗粒与藻细胞相互作用形成杂聚体,从而产生毒性效应[51]。微塑料对于浮游植物的光合作用影响很大,聚氯乙烯微塑料颗粒(111、157、216 μm)和聚丙烯微塑料颗粒(64、172、236 μm)可以降低蛋白核小球藻(Chlorellapyrenoidosa)的叶绿素a的含量,在250 mg/L条件下与对照组相比最大降低55.23%,另外随着微塑料浓度的增加其对光合作用的抑制效应越来越强,并且聚氯乙烯微塑料颗粒抑制作用大于聚丙烯微塑料颗粒[52]。有研究发现,微塑料可与淡水莱茵衣藻(Chlamydomasreinhardtii)细胞、胞外多糖等形成杂聚体,使聚丙烯塑料颗粒沉降至水底[53];中性和正电荷的聚苯乙烯纳米颗粒对淡水绿藻羊角月牙藻(Pseudokirchneriellasubcapitata)细胞的吸附能力更强,且吸附能力受介质硬度(Ca2+浓度)的影响[54]。Long等利用聚苯乙烯微塑料(2 μm)对硅藻(Chaetocerosneogracile)、定鞭金藻(Tisochrysislutea)和甲藻(Heterocapsatriquetra)进行暴露培养,发现微塑料颗粒与浮游植物的聚集情况和浮游植物种类有关,具有种间差异性[55]。Seoane等研究2.5 μg/mL不同粒径(0.5和2 μm)氨基改性聚苯乙烯微球对海洋硅藻新细鳞毛藻(Chaetocerosneogracile)的细胞毒性发现,MPs不会附着在藻细胞壁上,细胞生长、形态、光合作用、活性氧含量和膜电位保持不变,但是细胞酯酶活性和中性脂质含量显著降低,而微藻油体可作为维持健康细胞状态的能源,由此认为,暴露于微塑料的微藻可通过调节能量代谢以应对逆境条件[56]。
因此,有关微塑料对浮游植物的毒性效应机制目前主要聚焦于吸附/聚集作用,尤其是小尺寸的微塑料具有更大的比表面积和吸附能力,在自然环境中也可通过吸附重金属、有机污染物等对浮游植物产生联合毒性效应。此外,微塑料中化学添加剂的浸出及其对微藻生理的影响具有重要的环境意义,例如荧光添加剂在模拟(酸性水、盐水、碱性水)和天然水(河流、湖泊、湿地、海水)中的浸出行为的研究显示,随着溶液pH值和浸出时间的增加,添加剂的释放量增加,浸出浓度按照碱性水、盐水、海水、湖泊、河流、湿地的顺序依次降低;微塑料浸出液对小球藻生长和光合作用的影响表明,随着渗滤液浓度的增加,光系统II(Fv/Fm)的最大光化学量子效率降低[57],因此微塑料中添加剂的浸出过程主要取决于水环境,浸出后的化学物质可能对水生生物造成生态风险。
2.2 微塑料对浮游动物的毒性效应
浮游动物作为海洋生态系统中物质转换和能量传递的关键媒介,其对微塑料污染的响应至关重要。Botterell等统计了22项微塑料的调查研究,发现39种浮游动物可以摄取微塑料颗粒,其中10项研究证实了微塑料颗粒对浮游动物摄食行为、生长、发育、繁殖和生活史的负面效应,但3项研究说明微塑料颗粒对浮游动物未造成可见的负面影响[58]。如海洋浮游甲壳类布纹藤壶(Amphibalanusamphitrite)幼体和卤虫(Artemiafranciscana)能够积累0.1 μm的聚苯乙烯微塑料颗粒并产生亚致死效应,诱导氧化胁迫和神经毒性[59]。聚苯乙烯纳米颗粒还能影响卤虫(A.franciscana)幼体的摄食、运动能力和蜕皮过程[60]。聚苯乙烯塑料微球被桡足类动物海岛哲水蚤(Calanushelgolandicus)摄食后,粪球的密度显著降低,下沉速率减少2.25倍,更易破碎分散[61]。聚酯纤维和聚乙烯微球对淡水浮游动物模糊网纹蚤(Ceriodaphniadubia)的生长和繁殖具有剂量依赖效应,且纤维状微塑料具有更强的负面效应[62]。另外,微塑料颗粒对浮游动物的毒性效应也取决于其尺寸大小,如1 μm的聚乙烯颗粒对浮游动物大型溞(Daphniamagna)的96 h半数效应浓度(EC50)为57.43 mg/L,但100 μm的聚乙烯微塑料不能被其摄食,未见负面效应[63]。研究表明,13种浮游动物具有摄入小尺寸(1.7~30.6 μm)聚苯乙烯微塑料颗粒的能力,且7.3 μm微塑料(>4 000 n/mL)暴露条件下能够抑制桡足类背针胸刺水蚤(Centropagestypicus)对藻细胞的摄食率[64]。因此,浮游动物在摄食过程中对微塑料可能不具有识别能力,微塑料在其肠道内的长时间存在会产生假的饱腹感,影响其对营养物质的摄取,例如将微塑料与水母接触进行实验,结果显示成年水母相对于幼年的有选择能力,对摄食影响相对较低,而幼年水母的毒性响应较为明显,后续的存活、生长和繁殖均受到显著影响[65]。
通常来讲,浮游动物摄入微塑料后能够随粪便将其排出体外,一般不会在其酶分泌和营养吸收的主要器官——中肠腺腺管中积累,不会产生致死毒性。有关微塑料对浮游动物急性毒性作用机制的分析需重点考虑以下两点:不同材质、不同降解程度的微塑料的渗滤液是一类组分复杂的污染物质,会对浮游动物产生急性毒性作用[66];环境中存在的微塑料以纤维状为主,且不规则塑料碎片的排出速率相对降低,造成浮游动物营养不良[62,67]。
2.3 微塑料对贝类的毒性效应
随着贝类养殖业的快速发展,贝类产品在渔业养殖经济中的比重越来越大,成为人类获取蛋白质的重要来源之一。因此,微塑料对贝类的毒性效应直接关系到水产品安全和消费者健康。研究发现,野外采集的贝类样品大都含有微塑料,且以纤维状为主。Sussarellu等采用直径2和6 μm的聚苯乙烯微球在0.023 mg/L浓度条件下与太平洋牡蛎暴露喂食2个月,发现太平洋牡蛎(Crassostreagigas)更倾向摄入6 μm的微塑料,卵母细胞数(-38%)和直径(-5%)以及精子速度(-23%)均出现降低的现象,暴露组牡蛎后代的D型幼虫产量和幼虫发育率分别降低了41%和18%,说明微塑料对牡蛎的滤食行为和繁殖造成严重影响[68]。Gardon等发现不同浓度(0.25、2.5、25 μg/L)直径6和10 μm的聚苯乙烯微球暴露喂食2个月,随着微塑料丰度的增加,珍珠牡蛎(Pinctadamargaritifera)的同化效率显著降低,在生长、繁殖等多个方面影响动物体内的能量平衡[69]。Luan等发现氨基聚苯乙烯微塑料(PS-NH2)颗粒和羧基聚苯乙烯微塑料(PS-COOH)颗粒对文蛤(Meretrixmeretrix)孵化期、壳顶幼虫期和D型幼虫期的发育影响依次降低,毒性作用与其发育阶段有关[70]。
贻贝(Pernaviridis)与不同浓度的(0、21.6、216、2 160 mg/L)悬浮聚氯乙烯(PVC)微塑料颗粒(1~50 μm)每天暴露接触2 h,44 d后贻贝的滤食率、呼吸速率和足丝的产生与微塑料丰度呈负相关,在91 d内贻贝的存活率随着PVC含量的增加而降低[71]。因此,微塑料与贝类的暴露接触可能是因为产生假饱腹感,从而降低对食物的同化效率,并导致自身能量失衡。但有关微塑料对贝类繁殖能力产生的负面效应,有待于进一步研究揭示其致毒机制,目前关注较多的是与其他污染物的联合毒性,例如由于其疏水性和相对较大的表面积,可以作为海洋中疏水性污染物的载体,有助于它们向生物体的转移[72]。
2.4 微塑料对鱼类的毒性效应
野外调查结果显示,多种鱼类体内含有微塑料碎片或颗粒,含量的多少主要取决于采样的环境条件,总体含量不多。但微塑料同样会对鱼类生物产生一定的负面效应。研究发现,将成年雄性斑马鱼(Daniorerio)暴露接触暴露于直径0.5和50 μm的聚苯乙烯微球(1 000 μg/L)14天后,斑马鱼肠道微生物的菌群发生明显变化,并引起一定程度的炎症反应[73]。当用双酚A和纳米塑料颗粒同时作用于成年斑马鱼(D.rerio)时,其头部和内脏积累双酚A的浓度比双酚A单独存在时分别升高2.2和2.6倍,说明纳米塑料颗粒能够增强双酚A的生物可利用性并可能引发神经毒性[74]。添加微塑料颗粒(2 mg/L)明显增强水体中百草枯对鲤鱼的毒性作用,导致鲤鱼体内白蛋白水平的显著升高[75]。
另外,鱼类误食微塑料的过程还受塑料颜色的影响,倾向于捕获黑色塑料颗粒,其它颜色或浅色的微塑料颗粒只有与食物一起被摄食时,才会被咽入肠胃,且大多数的(93%)鱼类能够在一周左右将摄入的微塑料全部排出体外[76]。目前尚未发现微塑料对鱼类的急性毒性作用,重点关注亚致死慢性终点以及与其它毒物的联合毒性作用的研究。微塑料对水体中其它污染物的吸附作用可能是对鱼类致毒的重要途径,例如天然有机质和MPs的联合作用可促进斑马鱼(D.rerio)对Cu的积累,相应地加重肝脏和肠胃的铜毒性,且微塑料的粒径越小促进效应越明显[77]。
2.5 微塑料对珊瑚的毒性效应
珊瑚礁生态系统主要分布于热带和亚热带海区,分布有丰富的底栖型藻类和微生物,是珊瑚鱼的主要栖息地,也是海洋生物活性物质的重要宝库。近年,受全球气候变化、海洋酸化、海洋污染等多重因素的影响,珊瑚礁生态系统出现大面积的白化、退化或死亡现象,引起人们的高度关注。潘云凤等针对珊瑚礁生态系统中微塑料污染及其生态效应进行了较系统的归纳总结,前期的研究说明珊瑚虫能够摄取微塑料颗粒并在其肠道内停留一段时间,对可改变珊瑚共生的虫黄藻细胞内的叶绿素含量和生理状态,对珊瑚生长和健康间接地产生负面影响[78]。本文此处重点补充几项有关微塑料对珊瑚毒性效应的最新研究结果。
Syakti等通过室内暴露实验进一步证实了美丽鹿角珊瑚(Acroporaformosa)可以摄入和排出<100 μm的低密度聚乙烯颗粒,其生长受到明显抑制,且引起珊瑚坏疽或白化,但共生的虫黄藻密度明显增加[79]。Saliu等在造礁珊瑚体内检出了微塑料及塑料添加剂邻苯二甲酸酯,说明微塑料含有的添加剂成分可能会对珊瑚产生直接的毒性作用[80]。Martin等研究了五种不同尺寸的微塑料(53~63、125~150、215~250、300~355和425~500 μm)对红海(Red Sea)常见的三种珊瑚虫(烟黑鹿角珊瑚A.hemprichii、网状菊花珊瑚Goniastrearetiformis和疣鹿角珊瑚Pocilloporaverrucosa)的影响过程,发现珊瑚主要通过其表面与微塑料的黏附作用去除微塑料颗粒,而摄食途径清除微塑料颗粒的比例只占总量的2.2%,说明微塑料与珊瑚暴露接触的过程中肠道摄入微塑料的暴露途径贡献较低[81]。但不同种类的珊瑚对微塑料的暴露接触具有不同程度的响应。Reichert等使用较低丰度(200 n/L)的高密度聚乙烯颗粒(65~410 μm)模拟自然环境中微塑料的污染水平,监测美丽轴孔珊瑚A.muricata、疣鹿角珊瑚P.verrucosa、钟形滨珊瑚Poriteslutea和苍珊瑚Helioporacoerulea四种造礁珊瑚的生长状况长达6个月,发现微塑料对珊瑚造成的负面效应具有明显的种间差异,美丽轴孔珊瑚和疣鹿角珊瑚由于频繁与微塑料颗粒直接接触,其生长和光合作用受到显著抑制[82]。另外,两种深海冷水珊瑚Lopheliapertusa和Madreporaoculata对微塑料暴露接触也表现出种间差异性,低密度聚乙烯微塑料颗粒损害L.pertusa的捕食能力和生长速率,但M.oculata不受影响[83]。因此,随着微塑料污染程度的日趋加剧,珊瑚礁生态系统中珊瑚群落的组成会发生改变,甚至导致珊瑚多样性降低。
2.6 微塑料对动物胚胎或幼体的毒性效应
一般在短期内水环境中的微塑料不会对成年生物个体造成负面影响,但目前有关微塑料长期慢性毒性效应的研究十分欠缺。
现有的研究结果表明,微塑料对鱼类、贝类等海洋动物的胚胎和幼体发育具有显著的毒性效应。不同丰度的(0.1、1、10 mg/L)纳米塑料颗粒与受精6 h后的斑马鱼胚胎暴露接触至120 h,发现胚胎早期发育的24 h内纳米塑料在卵黄囊内积累,然后迁移至胃肠道、胆囊、肝脏、胰腺、心脏和大脑(48~120 h);斑马鱼早期胚胎发育过程中未发现死亡、畸形或线粒体生物能改变的负面效应,但会导致心率和幼虫游动能力的降低[84]。Lönnstedt等发现聚苯乙烯微塑料颗粒(90 μm)可抑制赤鲈(Percafluviatilis)幼体的孵化率和生长速率,改变其取食偏好和先天行为,并使其嗅觉丧失对危险信号的反应能力,显著增加了由捕食者导致的死亡率[85]。但Mazurais等发现聚乙烯微球(10~45 μm)对欧洲鲈鱼(Dicentrarchuslabrax)幼体的急性毒性作用有限,可能与鲈鱼的高排泄率有关[86]。胺基化的纳米塑料颗粒可导致普通海胆(Paracentrotuslividus)胚胎发育产生严重缺陷,但羧基化的纳米颗粒则不会对海胆胚胎表现出明显的毒性效应,说明塑料颗粒的表面电荷和聚集的差异显著影响了它们的胚胎毒性[87]。新的塑料微球比沙滩老化的塑料微球对绿海胆(Lytechinusvariegatus)胚胎发育具有更强的毒性作用,导致胚胎发育的畸形率显著升高[88]。但Martínez-Gómez等人发现,聚苯乙烯、高密度聚乙烯塑料浸出液比原始塑料颗粒和老化的塑料颗粒,对普通海胆(P.lividus)胚胎具有更强的毒性效应[89]。聚乙烯塑料微球可降低短刺海胆(Tripneustesgratilla)幼虫对饵料藻的摄食率,对海胆幼虫的生长有一定程度的抑制作用[90]。另外,可循环利用的7类塑料的浸出液对布纹藤壶(A.amphitrite)无节幼体产生致死毒性,显著抑制腺介幼体的着床能力[91]。Lo and Chan[92]向指甲履螺(Crepidulaonyx)幼体投喂2 μm粒径的微塑料球,在丰度10 n/mL条件下未见幼体生物受到负面影响,而在高丰度条件下微塑料球虽未降低履螺的摄食率,但导致其幼体生长缓慢和着床提前,说明履螺在摄入和排出微塑料过程中消耗了大量能量。Liu等以中华绒螯蟹(Eriocheirsinensis)幼体为研究对象,微塑料影响免疫系统相关酶活性和基因表达,改变了其肠道菌群的多样性和种类组成[93]。
由此来看,除浮游生物外,其它海洋生物的幼体发育和生长同样面临微塑料的严重毒害效应。
3 海洋环境微塑料污染的现状分析与控制对策
近年来人们对海洋微塑料污染问题的关注度与日俱增,从微塑料污染现状的野外调查,到微塑料急性或慢性毒性实验的室内分析,使得微塑料相关的研究论文的发表数量呈指数增长趋势。前两年我国学者也对微塑料污染、生态效应等进行了综述报道[94-96],本文重点补充了近年最新的研究结果,基于微塑料污染现状和毒性效应的分析,提出相应的控制对策。
3.1 微塑料在水环境中的迁移、分布规律
从图2汇总的调查结果来看,亚洲和欧洲沿海已开展较多的微塑料调查工作,且我国科研工作者对海水、沉积物和生物样品中微塑料的污染现状做了相应的调查研究,欧洲海区的调查结果多集中在沉积物和生物样品。但由于微塑料调查工作中使用的采样手段和定量方法均不太统一,且在相同站位同步开展的环境样品与生物样品的调查研究十分缺乏,本文使用现有的调查数据结果对水环境中微塑料的迁移、分布规律进行近似地分析。
从目前海洋或淡水环境中微塑料的调查结果来看,水体中微塑料丰度差异较大,海水和淡水环境中微塑料丰度的变化范围分别为0.045~2 569和570~12 611 n/m3。总体而言,水库(1 597~12 611 n/m3)[33]、河流(0~5 405[28]、293~4 760[29]、(570±710) n/m3[34])、河口区((4 137.3±2 461.5) n/m3)[24]和离岸海区((0.07±0.02) n/m3[11]、(0.24±0.35) n/m3[20]、(0.33±0.34) n/m3[22]、(0.167±0.138) n/m3[24])水环境中微塑料丰度依次降低,说明陆地人类活动是海洋环境中微塑料的重要来源,河流输入是微塑料从陆地向海洋迁移的重要途径,且在泥沙沉积速率较快的河口区发生明显的富集。
除突尼斯比塞大泻湖-海峡水域(3 000~18 000 n/kg干重)[16]和地中海半封闭海区(4 680 n/kg干重)[9]的沉积物中微塑料丰度较高之外,其他海滩和海洋沉积物中微塑料丰度在0~1 674 n/kg干重之间波动,多数调查结果为几十至数百n/kg干重。参考文献中报道的海水沉积物的平均含水率约为130%[97,98],据此估算海洋沉积物中微塑料丰度约为0~1 232 n/L海水(每公斤干重的沉积物中含有的海水),与海水中微塑料丰度0.045~2 569 n/m3相比,沉积物中微塑料的丰度升高约480倍。由此来看,尽管海水密度较高、水动力条件较好,微塑料颗粒经历长时间的运移仍然可以在海洋沉积物中积累。
据报道,我国分布的21种海水鱼和6种淡水鱼体内微塑料的含量为200~17 200 n/kg[42],远高于我国海洋和淡水环境中微塑料的丰度。为了近似计算鱼类对微塑料的生物富集系数,选择我国黄海和南海两个海区的调查数据进行分析。我国黄海海州湾分布的赤鼻棱鳀(Thryssakammalensis)鱼体内微塑料的含量最高((11 190±1 280) n/kg)[48],与北黄海海区的微塑料丰度((545±282) n/m3)[25]相比,赤鼻棱鳀体内微塑料含量约为20 000倍;我国南海捕获的深海鱼类肠道中微塑料的含量达(4 820±4 740) n/kg[47],与南海海区微塑料丰度((2 569±1 770) n/m3)[23]相比,南海深海鱼体内微塑料的含量约为1 900倍。虽然水体和鱼体内微塑料碎片或颗粒的形状、材质可能有差异,无法计算生物富集系数,但鱼类生物体内和水体中微塑料丰度的显著差异说明鱼类生物对微塑料具有很强的积累。由此来看,人们常食用的鱼类等海产品是摄入微塑料的重要途径,可能危害人类健康,应给予重视。建议今后开展微塑料环境行为、沿食物链传递、生物富集等方面的研究,为客观评价海洋环境中微塑料的生态风险提供科学依据。
3.2 微塑料对海洋生物的毒性效应分析
从现有的文献报道来看,微塑料对浮游生物藻类的危害效应主要是源于藻类胞外分泌物与微塑料颗粒的聚集效应,影响浮游植物细胞的悬浮和细胞膜的生理功能,从而影响藻类的代谢和生长。微塑料对浮游动物的毒性效应主要源于微塑料自身浸出的塑料添加剂等有害成分,并使得浮游动物肠道排空时间延长,造成营养不良效应。微塑料对贝类和鱼类的负面影响主要源于微塑料对有机污染物、金属离子等的携带作用,并改变动物肠道菌群的种类组成,影响生物的物质代谢和能量平衡。除幼体或成年的海洋动物外,斑马鱼胚胎的早期发育[84]、鲈鱼幼体的孵化率[85]和海胆胚胎发育[87-90]对微塑料表现出更灵敏的毒性响应,说明鱼虾、贝类、海胆等生物的体外受精和胚胎发育过程可能会受海洋微塑料的负面影响。因此,今后应针对海洋微塑料对海洋生物繁殖、幼体发育等生物过程的影响开展系统的研究。
目前有关微塑料暴露的毒性实验采用的微塑料丰度通常以质量浓度计算,一般为数mg/L或数百μg/L,但海洋调查过程中使用的计量单位通常为n/m3,由于塑料碎片或颗粒的密度、形状不同,难以将其转换为质量浓度。但在一例毒性实验中采用了相似环境丰度的微塑料球(10 n/mL,2 μm粒径),未见其对指甲履螺(Crepidulaonyx)幼体的负面影响[92]。常见的微塑料材质聚氯乙烯(PVC)、聚苯乙烯(PS)和聚乙烯(PE)的密度分别为1.4、1.05和0.915~0.97 g/cm3,取三者的平均密度1.13 g/cm3计算,粒径为1、50和100 μm的塑料球体积分别为0.52×10-12、6.54×10-8和5.23×10-7cm3。因此,100 μg/L的1、50和100 μm粒径的微塑料丰度约分别相当于1.7×1011、1.35×106和1.7×105n/m3,与本文所报道的海水中最高的微塑料丰度(2 569 n/m3)[23]相比,100 μg/L的三种粒径的微塑料丰度分别为6.6×107、525和66倍。由此来看,有关微塑料的毒性实验多数采用了远高出自然海水中所观察到的微塑料实际丰度。另外,室内染毒实验使用的塑料微球多数为工业生产过程中使用的微米级的原始塑料颗粒,缺少塑料制品加工过程中使用的增塑剂等添加剂成分,不能全面反映环境中废弃塑料降解产生的微塑料颗粒产生的生物效应。因此,建议今后多采用老化的塑料制品粉碎成不同粒径的颗粒,使用稍高出环境丰度的添加量进行模拟,开展慢性毒性实验,以探讨海洋环境中分布的微塑料对生物的潜在影响。
3.3 海洋环境中微塑料污染的控制对策
海洋微塑料数量持续增加造成的海洋生态风险日益受到全球关注。2015年第二届联合国环境大会将以塑料微珠为主的微塑料污染列为环境与生态科学研究领域的第二大科学问题,表明其与全球气候变化、臭氧层破坏等重大全球环境问题同等重要。笔者认为,为有效消除微塑料对海洋生态系统的不利影响,必需首先强化源头控制,其次是在微塑料污染严重的海域实施生物修复技术。为此提出以下四方面对策。
(1) 健全相关法律以限制微塑料在工业生产中的使用和排放。
限制微塑料的生产和使用是控制其入海量和生态危害最有效的手段。2015—2018年美国、英国和日本先后制订法案禁止在护肤品、牙膏及其他洗护产品中使用塑料微珠,以减少微塑料颗粒的使用和排放量。我国发布的《环境保护综合名录 (2017年) 》也将“添加塑料微珠的化妆品和清洁用品”、“塑料微珠添加剂”列入“高污染、高环境危险”产品名录,但对以个人护理品为代表的环境微塑料使用后的排放管理还处于空白[99]。因此,建议尽快健全微塑料污染源控制方面的法律法规,从国家层面实施微塑料颗粒使用和排放的管控。
(2) 提高全社会对微塑料污染危害的认识以自觉减少塑料材料和微塑料使用。
目前,我国对于海洋微塑料污染及其生态效应的关注尚局限于科学研究层面,公众很少或根本没有认识到微塑料可能带来的生态危害。因此,应在健全相关法律基础上,在学校、公共场所、企事业单位和政府部门广泛开展各种形式的环保科普和宣传教育活动,提高公众意识,进一步推动国民的绿色“低塑”生活,提高塑料垃圾的回收率,在全社会形成减少原生微塑料使用的氛围。
(3) 加强海上执法力度以控制海洋工程建设项目的塑料垃圾排海。
严格执行《防治海洋工程建设项目污染损害海洋环境管理条例(2017年修订》、《海洋石油勘探开发污染物排放浓度限值(GB 4914—2008)》等法律法规和环境标准,禁止海洋石油勘探开发等海洋工程建设项目以及渔业生产活动产生的塑料制品直接排放或弃置入海。
(4) 研发生物修复技术以快速降解海洋中的微塑料。
通过生物降解消除海洋中微塑料污染是一类环境友好而有应用前景的方法。据报道[100-102],土壤中分离出的葡萄球菌、假单胞菌和芽孢杆菌能够降解聚乙烯,而黑曲霉、铜绿假单胞菌、枯草芽孢杆菌、金黄色葡萄球菌能够降解聚对苯二甲酸乙二醇酯和聚苯乙烯。如何培养这些微生物适应高盐海水环境,并避免使用过程中外来物种入侵的潜在危害,是研发海洋微塑料生物降解技术的关键,有待进一步研究。

