CD133+和CD133-胶质母细胞瘤肿瘤干细胞的lncRNA表达谱
陈竹 周太光 薛丽 陈佳
(1西南医科大学临床医学院,四川 泸州 464000;绵阳市中心医院 2儿科;3检验科)
脑胶质瘤是最常见的颅内原发性肿瘤,约占颅内原发性肿瘤总数的70%,其中胶质母细胞瘤(GBM)是恶性程度最高的组织学类型,具有发病率高、复发率高、死亡率高和治愈率低的特点〔1〕。近年来,无论是显微手术、放化疗还是免疫治疗均取得了巨大进步,但GBM患者的预后仍不理想。2016年,世界卫生组织(WHO)整合了分子分型的胶质瘤分型系统,在原有组织学基础上加入了分子分型,优化了原有的基于组织病理学的分型系统,新分型将GBM患者分为异柠檬酸脱氢酶(IDH)野生型与IDH突变型,前者约占90%,表明在这一分型标准下患者之间仍存在较大的异质性,目前急需分子层面的更精准的分层诊断与治疗〔2〕。研究表明在人类GBM内存在GBM干细胞(GSC)亚群〔3~5〕,Lan等〔6〕发现肿瘤增殖异质性是由同种群的GSC及其GSC后代随机突变所决定,表明肿瘤干细胞不仅驱动着肿瘤的发生、发展及复发,还决定着肿瘤细胞之间的异质性。研究发现GBM经多次培养分离获得的具有自我更新能力的肿瘤干细胞,表现出两种不同的生物行为学表现,一类表现为高增殖指数,形成典型神经球状生长,免疫组化显示CD133+;另一类表现为相对较低的增殖,形成黏附生长球伴随有分化细胞,免疫组化显示CD133-〔7〕。
随着大规模的二代测序技术应用,越来越多的肿瘤驱动基因被发现,推动了胶质瘤的分子分型的发展〔8,9〕。此外,深度的测序技术还发现了一类新分子,即长链非编码(lnc)RNA,在胶质瘤的发生、发展中也起到重要作用〔10,11〕。LncRNA是一类长度超过200 bp,缺乏开放阅读框架的mRNA样转录本,多种lncRNA被报道与胶质瘤相关。如经典的同源框(HOX)转录反义RNA(HOTAIR),其高表达与GBM的不良预后相关,并可通过表观遗传学、miR-141等途径调控髓细胞增生原癌基因(C-myc)的激活,推进肿瘤的发展〔12~14〕。本研究旨在探索CD133+和CD133-两类肿瘤干细胞在转录水平上的差异,并分析了lncRNA 长链脂肪酸延伸酶2翻译RNA(ELOVL2-AS1)的临床意义。
1 材料和方法
1.1材料 32例GBM组织标本取自西南医科大学附属医院,临床标本均经病理检验证实,患者均签署知情同意书,本研究经本院伦理委员会审核通过,并持续定期随访。标本于手术后迅速转移至液氮保存。从肿瘤基因组图谱计划(TCGA)下载具有完整临床资料及二代RNA测序表达谱资料的GBM患者共149例。
1.2LncRNA的重注释 在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载GDS2728数据集下的GBM表达谱原始数据(cel格式文件),标准化和背景校正使用RobustMultichip Average法(RMA,Windows版),并使用GAT Explorer〔15〕对其进行重注释,提取其中的lncRNA,形成表达谱。
1.3实时荧光定量-聚合酶链反应(qRT-PCR) 取于液氮中保存的胶质瘤组织0.1~0.2 g,RNeasy mini kit(Qiagen公司,德国)提取总RNA,于-80℃保存,按照PrimeScript RT reagent (TaKaRa公司)使用说明,反转录合成cDNA,随后使用SYBR Premix Ex TaqⅡ (Tli RNaseH Plus;TaKaRa公司)进行PCR反应,ELOVL2-AS1引物:上游:5′-AGGACATAGTGAGAAGGT-3′,下游:5′-ATCAAGTTGCCAGAAGAG-3′,CD133引物:上游:5′-GTCCTCTTCTCTTCTCAA-3′,下游:5′-CTCTGTCCATATTCTCCAT-3′,由Invitrogen公司合成。
1.4共表达网络构建 构建基于加权基因共表达网络分析(WGCNA)方法的共表达网络,相较于一般的Pearson相关系数网络构建,该方法更符合一般生物基因表达模式〔16,17〕。将软阈值设定为0.99,并使用K中心值法鉴定共表达网络中的核心转录本,K值越大说明转录本越重要。
1.5统计学分析 差异lncRNA的分析采用R软件的limma包,采用SPSS24.0软件进行t检验、Pearson相关系数检验,Kaplan-Meier法绘制生存曲线,组间比较进行Log-Rank检验。
2 结 果
2.1来源于原发GBM的CD133+和CD133-肿瘤干细胞的差异基因表达谱 共计1 250个差异表达的转录本,其中差异表达的lncRNA为151个(差异倍数≥1,P<0.05,见图1A),CD133+组相对CD133-组上调的转录本为638个,下调612个。聚类热图显示,CD133+与CD133-GBM干细胞的mRNA和lncRNA表达谱存在显著差异(图1B、1C)。
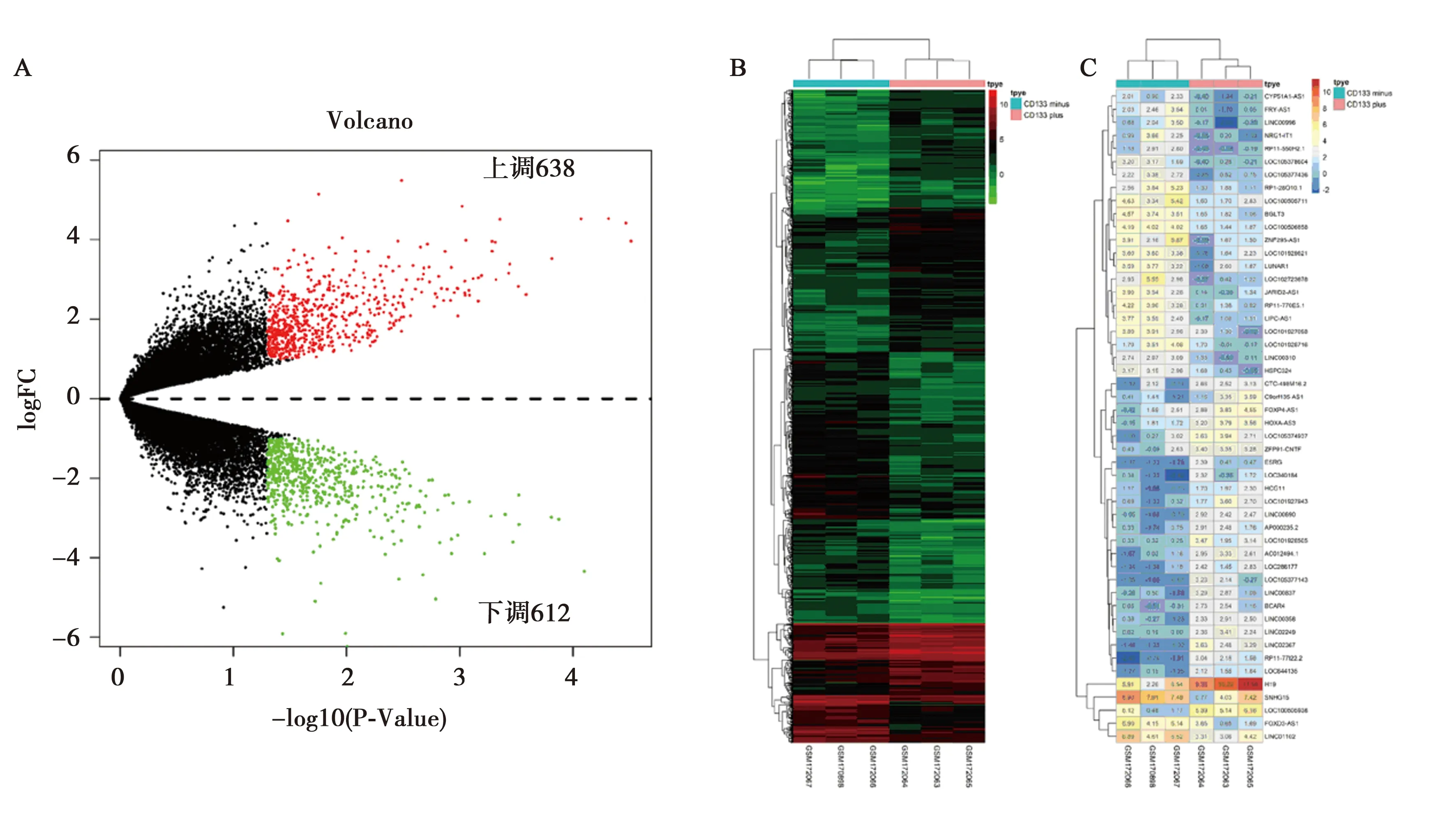
A:CD133+组表达图;B:所有差异表达的转录本的聚类热图;C:差异倍数在前50的lncRNA聚类热图图1 GBM CD133+与CD133-肿瘤干细胞差异基因表达谱
2.2差异表达基因的功能分析 Beier等〔7〕研究发现上述两类肿瘤干细胞之间存在显著的生物行为学上的差异,为初步探索差异基因所主导的功能差异,本研究使用基因本体论(GO)分析了差异基因的主要功能〔错误发现率(FDR)<0.05〕,见表1,发现CD133+组下调基因最富集的GO条目为主要组织相容性复合体(MHC)Ⅱ类蛋白复合体〔18,19〕。
2.3lncRNA/mRNA的共表达网络 转录调控网络中诸多转录本相互作用形成了复杂的互作网络,具有相近功能的基因具有类似的基因表达形式。基于该理论,共表达网络通过可视化的方法有效地易化了该转录调控网络,并有助于提取出关键转录本。通过WGCNA分析,本研究构建了共表达网络(图2A),该网络包含1 148个节点及3 237对关系构成,并形成了数个重要的子网络。最重要的子网络已被突出显示,该子网络内的节点均具有最高的K值,应为该调控网络的核心子网络,该子网络内包含凸素(PROM)1基因即CD133,进一步证实了CD133在两种不同生物学特性的肿瘤干细胞之间的调控网络中具有重要的调控作用。磷脂转运蛋白(PLTP)是具有最高K值的lncRNA,在该调控网络中处于重要地位(图2B)。
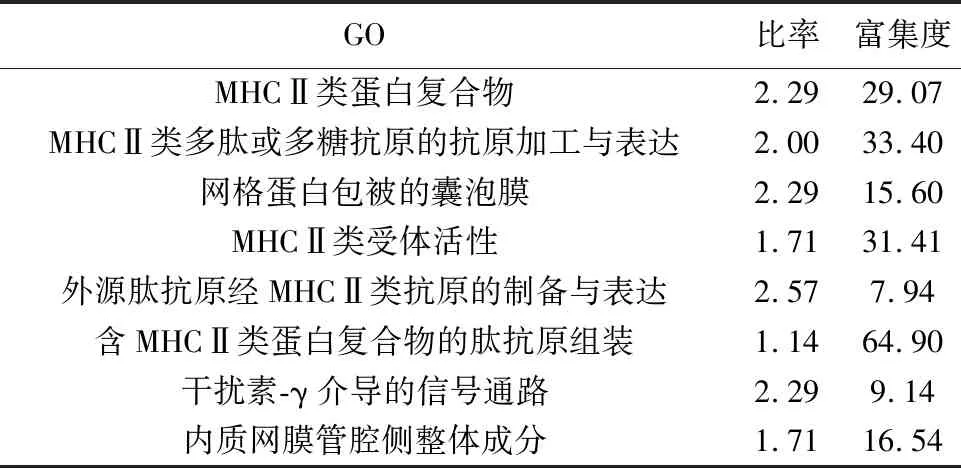
表1 差异表达基因富集的GO条目(%)
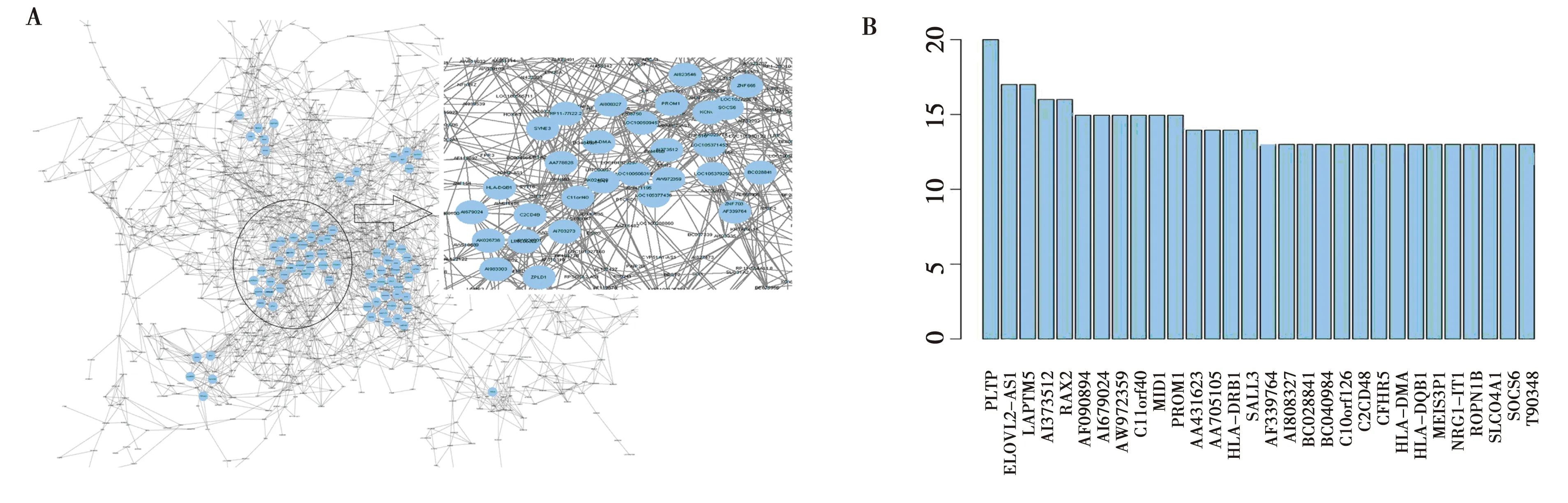
A:基于WGCNA的差异基因共表达网络,图中重点展示了K值大于14的核心子网络,该子网络包含CD133基因;B:共表达网络中K值排名前30的转录本图2 差异转录本的共表达网络及网络核心基因分析
2.4LncRNA ELOVL2-AS1在GBM中的临床意义探究 为进一步明确lncRNA ELOVL2-AS1在GBM中的临床意义,首先对随访时间<30 d的TCGA患者进行捡剔,在剩余142例患者中分析了该lncRNA的临床意义,平均(60.97±12.70)岁,男91例,女51例。IDH突变患者的ELOVL2-AS1表达水平较低(P<0.001),其他临床资料下的患者无显著统计学意义(P>0.05),见表2。ELOVL2-AS1高表达患者中位总生存时间显著低于低表达患者(10.87个月 vs 12.21个月,P=0.025),见图3A。纳入年龄、性别进行校正,并建立风险积分模型:风险得分=0.031×年龄(岁)+0.362×ELOVL2-AS1(0:低表达,1:高表达)。
随后,本研究使用qRT-PCR检测了2015~2018年本院收治的32例GBM患者的ELOVL2-AS1与CD133的表达水平,平均(57.2±8.70)岁,男20例,女12例。ELOVL2-AS1与CD133表达呈中度相关(Pearson相关系数=0.618,P=0.000),见图3B。风险积分高者中位生存时间显著低于低得分者(6.21个月vs 13.31个月,P=0.02),见图3C。
表2 142例TCGA来源GBM患者ELOVL2-AS1表达与临床资料分析
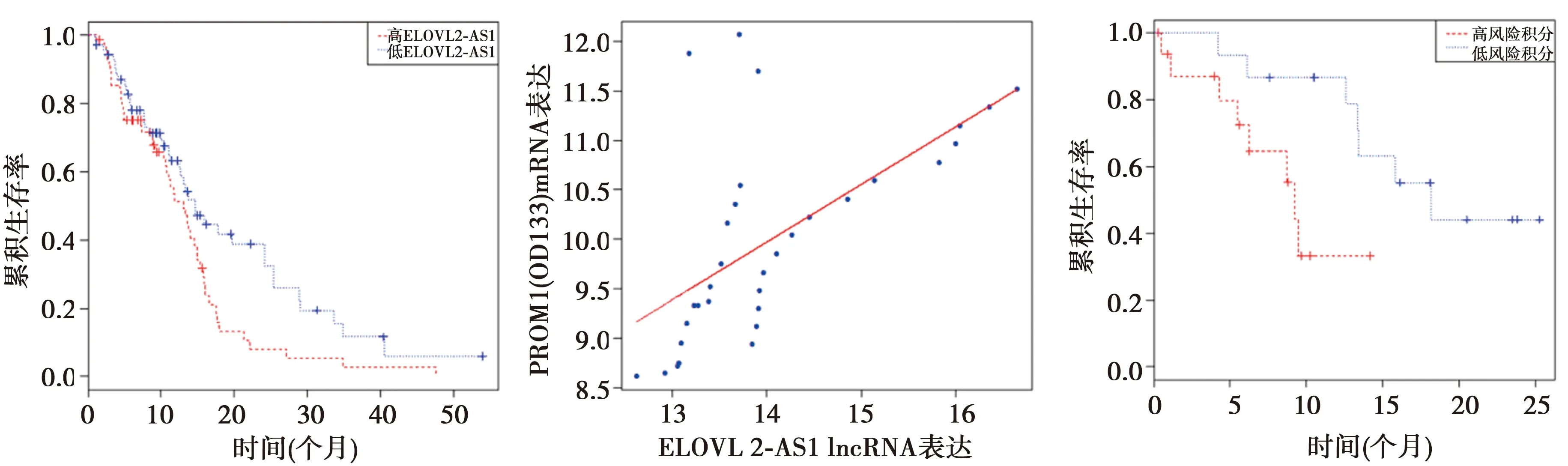
A:在142例TCGA的GBM患者中,高、低表达ELOVL2-AS1组的生存曲线;B:经PCR检测的32例GBM患者中ELOVL2-AS1与CD133的相关性;C:32例GBM患者基于前述风险积分公式的不同风险评分组的预后单因素分析图3 lncRNA ELOVL2-AS1的临床意义
3 讨 论
由于肿瘤细胞的异质性,肿瘤细胞逐渐获得的耐药性仍是目前肿瘤治疗领域的一大难题。研究认为,肿瘤干细胞是导致耐药的主要诱因,通过靶向肿瘤干细胞可有效地控制肿瘤〔20〕。CD133是一种包含5次跨膜区域的糖蛋白,被认为可作为多种癌症的肿瘤干细胞标记物〔21~23〕,但同时也有研究表明肿瘤干细胞全能性并不一定受限于CD133+,甚至CD133-细胞的集落生成能力要强于前者〔24〕。
早在2004年,Singh等〔25〕就使用CD133作为标志物,成功从成神经管细胞瘤和胶质瘤中获取了肿瘤干细胞。近年Beier等〔7〕研究发现,原发GBM经培养可获得CD133+和CD133-两种细胞集落,两种细胞集落均有肿瘤特性,所不同的是CD133+细胞呈现神经球样生长,与之相对应的CD133-集落包含多种分化细胞,呈现黏附生长特性,且前者的增殖及迁移能力显著强于后者。临床研究进一步证实了上述结论,CD133可作为脑肿瘤患者预后总生存及无病生存的预测指标〔26~29〕。
基因芯片分析揭示了CD133+和CD133-细胞之间调控基因的差异。通过对表达谱的初步分析,本研究发现了MHCⅡ类分子在CD133-细胞上高表达,可能与肿瘤细胞的免疫及细胞黏附相关,一定程度解释了其黏附生长的特点。在显著差异表达的lncRNA中,不乏近年来被证实在胶质瘤的发生、发展中起到重要作用的lncRNA,如lncRNA H19,被证实可通过调控miR-675的表达,进而负调控靶基因Cadherin 13的表达,影响胶质瘤细胞的侵袭和迁移能力〔30,31〕。
脂代谢异常与肿瘤的增殖、转移有着密切的联系。研究发现“转移起始细胞”对脂质代谢有着极强依懒性并表达高活性CD36受体,从而有效摄取脂肪酸〔32〕。ELOVL基因的诸多成员与肿瘤的发生、发展密切相关,如ELOVL7可促进前列腺肿瘤细胞的增殖〔33〕,ELOVL6的高表达可致乳腺癌、肝癌的不佳预后〔34,35〕。ELOVL2-AS1是通过构建共表达网络获取的在CD133+肿瘤干细胞中显著高表达的关键lncRNA,理论上可顺式调控其对应靶mRNA,ELOVL2是长链脂肪酸合成的限速酶之一,涉及多种多不饱和脂肪酸的合成〔36,37〕。该基因通过调节细胞内脂质代谢,在乳腺癌、结肠癌与前列腺癌中发挥重要调控作用〔38~40〕。
本研究提示了ELOVL2-AS1作为风险预测因子及CD133相关调控网络的可能。但ELOVL2-AS1调节ELOVL2基因进而调节脂质代谢,参与CD133+肿瘤干细胞的驱动,影响患者预后这一假设有待进一步研究证实。

