大亚湾大型海藻丛的大角玻璃钩虾种群分布特征
王卉, 李恒翔, 李路, 严岩
大亚湾大型海藻丛的大角玻璃钩虾种群分布特征
王卉1,2, 李恒翔1, 李路1, 严岩1
1. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广东省应用海洋生物学重点实验室, 广东广州 510301; 2. 中国科学院大学, 北京 100049
大角玻璃钩虾是我国沿海潮间带常见的藻栖甲壳动物, 但目前关于其与栖息海藻的作用关系极少报道。2016年2—5月在大亚湾岩礁潮间带采集了石莼和半叶马尾藻变种var.海藻, 结果显示大角玻璃钩虾在两种海藻丛中均有分布, 其中在石莼藻丛中分布的钩虾个体数量、平均体长和平均体重均大于在半叶马尾藻藻丛中。在半叶马尾藻藻丛中, 大角玻璃钩虾种群的性比、抱卵雌性比例和幼体比例相对较高, 而性成熟体长、抱卵雌性体长和卵粒体积则相对较小。研究表明, 大角玻璃钩虾在两种海藻中的种群分布与繁殖特征存在着差异, 可能受到栖息海藻形态结构及其生境等因素的影响。
大亚湾; 钩虾亚目; 大型海藻; 种群分布; 繁殖特征
钩虾亚目Amphipoda: Gammaridea隶属于节肢动物门、甲壳纲、端足目, 是甲壳动物中最大的类群之一, 广泛分布于世界各地的淡水和海水环境中, 已记录有1060属5700多种, 除1200多种淡水钩虾外, 其余均为海洋性种类(任先秋, 2006)。钩虾种类繁多, 地理分布广, 栖息密度大, 繁殖速度快, 在海洋生态系统底层食物网的营养流动中具有重要作用(Conlan, 1994)。钩虾属于初级消费者, 主要摄食有机碎屑和海藻等, 是初级生产向更高营养级传递的主要通道, 可为海洋动物和养殖生物提供优质的食物来源(Valentine et al, 2006)。同时, 钩虾生物对海洋环境污染具有高度的敏感性, 已成为理想的实验模式生物, 广泛应用于生态毒理学研究和环境污染评估工作(Dauvin et al, 2016; Löf et al, 2016)。因此, 关于海洋钩虾生物生态学的研究备受国内学者重视。
钩虾动物作为常见的中小型啃食者, 是潮间带大型底栖海藻群落中的重要生物类群(Conlan, 1994)。大型海藻可为藻栖钩虾提供稳定可靠的食物来源和良好的栖息繁衍场所, 使钩虾能长期适应复杂多变的潮间带生境 (Duffy, 1990; Gestoso et al, 2014)。另一方面, 钩虾对大型海藻生物具有选择性摄食的偏好, 从而影响着海藻的群落结构变动 (Valentine et al, 2006; Guidone et al, 2015)。啃食性钩虾喜欢摄食生长迅速、生活周期短的海藻种类, 有时其摄食量甚至超过海藻的生长量, 所以通过摄食作用控制着藻类初级生产者的生物量和生产力(Poore et al, 2013; Ba-Akdah et al, 2016)。在富营养化的海域, 生长快速的丝状海藻形成爆发性生长, 而钩虾对其高摄食率可有效地抑制丝状海藻的大量繁殖和藻华发生(Kraufvelin et al, 2006; Andersson et al, 2009)。由此可见, 探讨钩虾生物与大型海藻的相互作用关系具有重要生态学意义。然而, 有关该方面的相关研究在国内极少报道, 目前仅见郑新庆等(2011, 2013)报道了厦门筼筜湖大型海藻与藻栖钩虾的有关研究。
大角玻璃钩虾属世界性广布种和我国沿海常见种, 主要栖息于岩石潮间带的海藻丛中(Buschmann, 1990; 任先秋, 2006), 但关于其在栖息海藻丛中的种群分布特征未见相关报道。大亚湾位于广东省珠江口东侧, 属于亚热带海湾, 具有优越的自然环境和丰富的海洋生物资源(王友绍, 2014), 大角玻璃钩虾在该海域中有分布记录(任先秋, 2006)。因此, 本研究采集了大亚湾岩石潮间带的石莼和半叶马尾藻变种var.海藻, 研究了大角玻璃钩虾在两种不同海藻丛中的种群分布及繁殖特性, 以深入认识大角玻璃钩虾与栖息海藻之间的相互关系, 为将来钩虾的种质资源开发利用和生态学研究等提供理论参考。
1 方法和材料
1.1 样本采集
在大亚湾大鹏半岛海域岩石潮间带共布设2个采样点: S1 (114°33'7.49′′E, 22°34'28.64′′N)和S2 (114°36'56.19′′E, 22°32'49.64′′N), 于2016年2—5月, 每月1次对石莼和半叶马尾藻变种的海藻样品进行采集(图1)。石莼藻丛主要分布于岩石潮间带的中潮区和高潮区, 长时间暴露在空气中; 半叶马尾藻变种藻丛则主要分布在岩石潮间带的潮下带, 大部分时间浸没海水中。采集时将附着在岩石上的石莼或半叶马尾藻变种藻丛轻轻取下, 装入塑料密封袋内并作好记录, 冷藏条件下立即带回实验室分析。

图1 大亚湾潮间带大型海藻采样站位图
1.2 样品分析
在实验室里, 使用超纯水将附着在藻类上的所有动物冲洗下来, 再使用孔径为1.00mm的不锈钢网筛过滤冲洗液, 收集其中的钩虾生物样品。在体视镜下, 仔细观察、鉴定和挑选出大角玻璃钩虾至干净的玻璃培养皿中, 然后进行种类计数、拍照、大小测量和称重等。使用曲线绘制软件auto CAD测量所有拍照的大角玻璃钩虾个体, 体长为头胸部额角尖端沿身体外侧体壁曲线至尾节末端的距离(精确到0.001mm)。使用分析天平测量大角玻璃钩虾的湿重(精确到0.1mg)。测量前将钩虾样本放在吸水纸上, 确保样本身体两侧表面的水分完全吸干。
根据大角玻璃钩虾的性别、大小和外观特征, 将其分为以下4个类别: 1)成熟雄性: 第二腮足形态较大且腮足明显外延的个体; 2)未抱卵的成熟雌性: 第二腮足小、无明显外延、具有雌性特有抱卵板的个体, 但抱卵板上无胚胎; 3)抱卵的成熟雌性: 第二腮足小、抱卵囊内可见胚胎或幼体的个体; 4)幼体: 未出现以上两性分化特征的个体。
在体式显微镜下, 将钩虾抱卵囊内的卵粒或幼体小心移出, 统计卵粒数量、体积大小和待孵化幼体数量。卵粒体积的计算公式为:=(4/3)πmaxmin2, 式中:max为最大卵粒直径,min为最小卵粒直径, 统计时取抱卵囊内全部卵粒体积的平均值作为该抱卵个体的卵粒体积。大角玻璃钩虾的胚胎分为4个主要发育时期: 1)发育初期(F1期): 受精卵未进行分裂, 整体呈均匀状的深蓝色; 2)发育中期(F2期): 胚胎卵黄部分开始减少, 可见分裂的细胞, 但身体器官结构未进行分化, 整体为蓝黄色相间; 3)发育末期(F3期): 卵黄结构消失, 胚胎可看到明显分化的器官组织、整体呈蛋黄色, 出现明显的红色眼点; 4)幼体期(F4期): 胚胎清晰可见附肢等结构, 幼体已成型, 即将孵化, 浅黄色至白色透明。
1.3 统计分析
数据统计分析运用SPSS 22.0软件(IBM), 使用独立样本检验对两种海藻丛的大角玻璃钩虾的体长、湿重进行差异显著性分析。通过非参数检验 (Mann-Whitney) 分析两种海藻丛钩虾种群抱卵数、卵粒体积等差异。运用非参数相关分析(Spearman)检验钩虾抱卵数、卵粒体积和雌性体长或体重的相关性。当<0.05时, 认为是差异显著; 当<0.001时, 认为是差异极显著。
2 结果
2.1 数量和性比分布
在石莼藻丛中共获得大角玻璃钩虾566只, 其中性成熟个体546只, 幼体20只(表1)。性成熟个体中成熟雄性260只, 占样品总数的46.0%; 成熟雌性286只, 占50.5%; 幼体数量占3.5%。成熟雌/雄个体的性比为1.10。成熟雌性中抱卵个体共56只, 抱卵率为19.6%。
在半叶马尾藻变种藻丛中分布有大角玻璃钩虾117只, 其数量明显少于分布在石莼藻丛中。半叶马尾藻变种藻丛的大角玻璃钩虾幼体16只, 占13.7%; 性成熟个体101只, 占86.3%, 其中雄性41只, 雌性60只, 雌性抱卵个体15只, 抱卵率占25.0%。成熟雌/雄个体的性比为1.46。

表1 两种大型海藻丛的大角玻璃钩虾种群分布特征
2.2 体长和体重分布
在石莼藻丛中大角玻璃钩虾成熟雄性最小体长为7.06mm, 最大体长为18.40mm, 平均为11.56± 0.10mm; 成熟雌性体长最小值为5.00mm, 最大值为14.73mm, 平均体长为9.58±0.13mm; 成熟雄性体长显著大于成熟雌性体长(<0.001, 表2)。雌性抱卵个体体长范围在7.09~14.73mm, 平均为10.71± 0.22mm。幼体体长范围介于1.63~4.96mm。
在半叶马尾藻变种藻丛中, 大角玻璃钩虾成熟雄性最小体长为5.46mm, 最大为16.31mm, 平均为10.04±0.40mm; 成熟雌性最小体长为5.09mm, 最大体长为13.22mm, 平均为8.33±0.28mm; 雌性抱卵个体的体长范围在6.33~12.67mm之间, 平均为9.15±1.83mm。成熟雄性体长明显大于成熟雌性的体长(<0.001, 表2)。幼体最小体长为1.50mm, 最大体长为4.86mm。大角玻璃钩虾成熟个体在两种不同海藻中的体长分布存在显著性的差异(<0.001, 表2)。
石莼藻丛中大角玻璃钩虾成熟个体最小体重为2.0mg, 最大为29.4mg, 平均为11.5±0.5mg, 优势体重范围分布在7.0~15.9mg(表3)。雄性平均体重为12.3±0.6mg, 雌性平均体重为10.9±0.7mg。两性的体重分布在统计学上无显著性差异(>0.05)。在半叶马尾藻变种中, 大角玻璃钩虾成熟个体体重范围在2.3~24.8mg, 平均为9.8±0.5mg, 优势体重范围分布在6.0~12.8mg, 占54.5%。雄性平均体重为11.5± 0.9mg, 雌性为8.7±0.5mg。成熟雌雄个体的体重分布具有显著性差异(<0.05)。大角玻璃钩虾在两种不同海藻中的种群体重分布具有显著性的差异(<0.05)。

表2 两种大型海藻丛的大角玻璃钩虾种群体长分布
注:凡标记相同小写字母的表示差异不显著(>0.05), 不同小写字母的表示差异显著(<0.05)。

表3 两种大型海藻丛的大角玻璃钩虾种群体重分布
注:凡标记相同小写字母的表示差异不显著(>0.05), 不同小写字母的表示差异显著(<0.05)。
2.3 抱卵分布
由表2可知, 在石莼藻丛中分离出大角玻璃钩虾抱卵卵粒1148枚, 卵粒平均数为34.2±1.4枚, 卵粒体积范围在0.011~0.025mm3; 半叶马尾藻变种海藻丛的大角玻璃钩虾抱卵共272枚, 卵粒平均数为18.1±2.8枚, 卵粒大小为0.011~0.027mm3。大角玻璃钩虾在两种海藻丛中的卵粒分布和卵粒大小均无显著性差异(>0.05)。在石莼海藻中, 大角玻璃钩虾成熟雌性单胎孵化出幼体平均为21只, 最多55只;在半叶马尾藻变种藻丛中, 成熟雌性单胎孵化出幼体平均为18只, 最多为39只。图2显示, 石莼藻丛中大角玻璃钩虾抱卵量与雌性体长的相关关系不明显(2=0.174,<0.05, 图2a), 在半叶马尾藻变种海藻丛中呈极显著的正相关关系(r2=0.783,<0.001, 图2b); 但相关性分析结果显示在两种海藻丛中, 大角玻璃钩虾雌性抱卵量和雌性体重均无明显相关性(石莼2=0.206,>0.05; 半叶马尾藻变种,2=0.000,>0.05)。
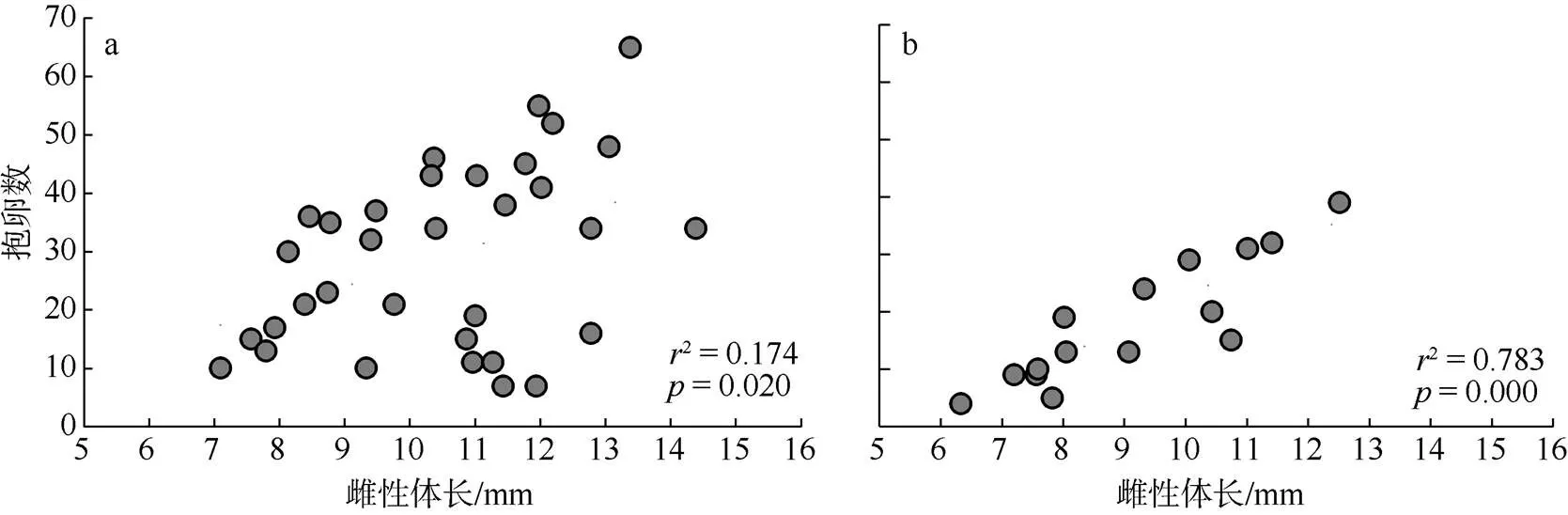
图2 石莼(a)和半叶马尾藻变种(b)海藻丛中大角玻璃钩虾抱卵量与雌性体长的关系
大角玻璃钩虾的卵粒发育时期及分布见图3a。在石莼海藻丛中, 大角玻璃钩虾卵粒发育主要集中在初期的F1期, 占总数的35.7%; 在半叶马尾藻变种海藻中, 钩虾卵粒发育阶段则集中在后期的F3期, 占40.0%。大角玻璃钩虾的卵粒发育分布情况在两种海藻丛中截然不同(<0.05)。图3b显示, 大角玻璃钩虾卵粒发育在两种海藻丛中的变化及差异, 其中在石莼海藻中的卵粒体积均大于在半叶马尾藻变种藻丛中。

图3 两种大型海藻丛的大角玻璃钩虾的卵粒发育分布(a)和不同发育时期的卵粒体积(b)
3 讨论
本研究调查发现大角玻璃钩虾在大亚湾潮间带石莼和半叶马尾藻变种海藻丛中均有分布, 但在不同海藻丛中分布的钩虾个体体长、性比、抱卵率、抱卵量等存在着显著的差异, 表明大型海藻的类型及其栖息环境都有可能影响到钩虾种群分布。郑新庆等(2011)对厦门筼筜湖大型海藻藻栖端足类的种群动态研究, 发现在条浒苔E主导的藻丛, 上野蜾蠃蜚和日本大螯蜚是丰度最高的端足类; 在细基江蓠繁枝变种var.和根枝藻sp.主导的藻丛, 上野蜾蠃蜚是其中的优势种类; 在石莼主导的藻丛中, 端足类主要以上野蜾蠃蜚和强壮藻钩虾为主。据报道, 玻璃钩虾属生物种类广泛分布在全世界海域潮间带的绿藻、褐藻和红藻等海藻丛中, 属于适应性很强的藻栖物种(Lancellotti et al, 1993)。玻璃钩虾在巴西潮间带不同潮区的5种大型海藻丛中均有分布, 但在低潮区的马尾藻海藻丛中分布数量最多(Bueno et al, 2017)。在智利沿岸岩石潮间带, 大角玻璃钩虾在高潮区海藻石莼和纵胞藻的分布多于在低潮区的伊谷藻和石花菜海藻丛中(Buschmann, 1990)。由此可见, 在不同海藻形成的藻丛中, 钩虾等端足类的分布存在着差异的现象。由于钩虾主要以大型海藻和海藻上附生生物为食, 因此钩虾具有选择性摄食的特性, 也会影响到其在不同海藻群落中的种群分布(Das et al, 2014)。研究表明, 海藻的营养成分不是影响钩虾生物种群分布的最重要因素, 比如藻钩虾对13种海藻的摄食选择性均与海藻的某些营养价值(氮、磷和蛋白质含量等)无密切的关联(Cruz-Rivera et al, 2000)。钩虾生物可通过补偿性摄食策略, 如增加摄食次数和摄食量、提高消化率和延长消化时间等策略来补偿所觅食物营养成分的匮乏, 适合生长于不同类型的海藻丛中(Cruz-Rivera et al, 2001)。
在潮间带大型海藻场的生态系统中, 海藻具有丰富的食物资源和高度异质化的空间结构, 为钩虾生物提供了一个理想的栖息地和庇护所, 因此形成数量密集、种类多样的钩虾动物群落(Duffy, 1990;Schreider et al, 2003)。由于钩虾生物个体较小、数量多, 容易成为杂食性鱼类等其他动物的重要捕食对象, 因此钩虾种群在海藻群落中的分布主要受到掠食者的捕食压力和栖息地环境的影响, 寻找逃避掠食者的安全栖所可能是钩虾分布的一个重要选择性因子(Conlan, 1994; Gestoso et al, 2014)。大型海藻具有独特的叶状体结构, 其叶体间存在的空隙越大, 为钩虾生物提供的躲避捕食者的空间和机会就越多, 有助于缓解潮间带的物种竞争(Cruz-Rivera et al, 2013; Das et al, 2014)。半叶马尾藻变种属于褐藻, 具有复杂立体的叶状体结构和更多的空隙微生境, 但在本研究中, 大角玻璃钩虾在半叶马尾藻变种海藻丛中并无分布偏好的现象, 这可能由于半叶马尾藻变种长期浸没在海水中, 会增加鱼类等大型海洋生物对大角玻璃钩虾捕食的压力。石莼属于绿藻种类, 虽然其叶状体结构简单, 但藻丛生长繁茂, 叶状体间堆叠贴合, 具有极好的保湿作用, 同时其处于高潮区所浸没海水的时间较短, 受海水鱼类等捕食者干扰相对较少, 可能更适合于大角玻璃钩虾的栖息, 因此分布的钩虾个体数量相对比半叶马尾藻海藻丛中的多。由此可见, 相对于藻类食物的营养需求, 栖所和环境的安全性对于钩虾生物的种群分布更为重要(Sotka, 2007; Bueno et al, 2017)。因此, 选择栖息在能够提供安全栖所的宿主藻类上, 能减少被其他生物捕食的几率, 有利于钩虾生长生存。
藻栖钩虾的种群分布与海藻生长密切相关, 通常在海藻生长旺盛的季节会伴随着高密度的端足类种群出现(Bueno et al, 2017)。例如, 葡萄牙潮间带泥滩钩虾的生物量与大型海藻尤其是浒苔海藻的生长量有直接关联(Pardal et al, 2000)。在马尾藻等大型海藻主导的群落中, 钩虾的种类组成和丰度等与大型海藻生物量成正相关(Carvalho et al, 2018)。在本研究的大亚湾海域, 石莼和半叶马尾藻变种主要出现在春季的2—5月, 随着两种海藻在潮间带的大量分布, 大角玻璃钩虾种群得以快速增长, 到了夏季(6—8月)海水水温增高, 石莼和马尾藻出现消亡, 而大角玻璃钩虾在潮间带的分布会不断减少。尽管大角玻璃钩虾种群出现的时间不长, 但其在藻场生态系统中扮演着重要的角色, 大角玻璃钩喜欢摄食海藻上的有机碎屑和附生植物, 少量摄取大型海藻, 于是有利于大型海藻在对光和营养盐的竞争中占据优势, 有助于宿主海藻的生长。但一旦钩虾种群过度繁殖, 或出现可供选择的食物有限, 会发生钩虾大量摄食宿主海藻的现象, 甚至对海藻场造成毁灭性的破坏(Valentine et al, 2006; Berthelsen et al, 2014)。
藻栖钩虾的繁殖特征通常是-策略, 表现为雌性性成熟更早, 以更小的卵粒繁殖出幼体, 从而缩短世代的繁殖周期来快速补充种群的数量(Sainte- Marie, 1991; Flynn et al, 2009)。在本研究中, 大角玻璃钩虾也表现出类似的种群繁殖特征。马尾藻海藻丛中的钩虾成熟雌性体长和雌性抱卵个体体长均比石莼海藻丛中的小, 而马尾藻海藻丛中的钩虾抱卵率和幼体比例则高于石莼海藻丛中的钩虾个体, 表明生活在马尾藻海藻丛的大角玻璃钩虾种群偏向于快速性成熟和大量繁殖, 确保在低潮区鱼类捕食压力较大的情况下钩虾种群仍然能有利生存与繁衍。端足目动物的繁殖力指数(抱卵数/雌性体长)是评价钩虾类繁殖能力的重要因子(Sainte-Marie, 1991)。研究发现雌性钩虾的抱卵数与钩虾体长或头胸部长度成正比, 即个体越大的雌性抱卵数相应越多(Ozga et al, 2017)。与之相反, 端足目麦秆虫属动物的繁殖特点是体型较大的抱卵雌性怀卵数量越少, 但其卵粒平均体积更大, 幼体成活率更高(de Paula et al, 2016)。由此可见, 钩虾种群的繁殖力并不是衡量其繁殖能力的唯一因素。本研究结果表明石莼藻丛中大角玻璃钩虾雌性体长和抱卵量的相关关系并不明显(2=0.174,<0.05), 而半叶马尾藻丛中钩虾种群则具有显著的正相关关系(2=0.783,<0.001)。综合考虑雌性抱卵个体的体长、卵粒发育分布和卵粒体积等相关因素, 可以推测出半叶马尾藻变种中的钩虾种群处于快速更新迭代过程, 达到性成熟所需时间较短, 产生幼体数量相对更多, 使得种群能快速繁衍以适应复杂多变的环境压力; 而石莼藻丛中钩虾的平均卵粒较少, 但卵粒体积较大, 幼体成活率更高, 雌性抱卵个体的体长更大, 到达性成熟所需时间较长, 整个种群处于相对稳定的状态。因此, 大玻璃钩虾在两种海藻丛中具有不同的种群繁殖特征。
任先秋, 2006. 中国动物志无脊椎动物第四十一卷甲壳动物亚门端足目钩虾亚目(一)[M]. 北京: 科学出版社. REN XIANQIU, 2006. Fauna sinica Vol. 41 Invertebrata Crustacea Amphipoda Gammaridea[M]. Beijing: Science Press (in Chinese).
王友绍, 2014. 大亚湾生态环境与生物资源[M]. 北京: 科学出版社. WANG YOUSHAO, 2014. Ecological environments and biological resources of Daya Bay[M]. Beijing: Science Press (in Chinese).
郑新庆, 黄凌风, 王蕾, 等, 2011. 筼筜湖大型海藻群落的几种藻栖端足类的种群动态研究[J]. 厦门大学学报(自然科学版), 50(5): 928–933. ZHENG XINQING, HUANG LINGFENG, WANG LEI, et al, 2011. Population dynamics of several species of amphipods in the macroalgae canopies in Yudang Lagoon[J]. Journal of Xiamen University (Natural Science), 50(5): 928–933 (in Chinese with English abstract).
郑新庆, 黄凌风, 李元超, 等, 2013. 啃食性端足类强壮藻钩虾对筼筜湖三种大型海藻的摄食选择性[J]. 生态学报, 33(22): 7166–7172. ZHENG Xinqing, HUANG Lingfeng, LI Yuanchao, et al, 2013. The feeding selectivity of an herbivorous amphipodon three dominant macroalgal species of Yundang Lagoon[J]. Acta Ecologica Sinica, 33(22): 7166–7172 (in Chinese with English abstract).
ANDERSSON S, PERSSON M, MOKSNES P O, et al, 2009. The role of the amphipodas a grazer on macroalgae in Swedish seagrass meadows[J]. Marine Biology, 156(5): 969–981.
BA-AKDAH M A, SATHEESH S, AL-SOFYANI A A, 2016. Habitat preference and seasonal variability of epifaunal assemblages associated with macroalgal beds on the Central Red Sea coast, Saudi Arabia[J]. Journal of the Marine Biological Association of the United Kingdom, 96(7): 1457–1467.
BERTHELSEN A K, TAYLOR R B, 2014. Arthropod mesograzers reduce epiphytic overgrowth of subtidal coralline turf[J]. Marine Ecology Progress Series, 515: 123–132.
BUENO M, DIAS G M, LEITE F P P, 2017. The importance of shore height and host identity for amphipod assemblages[J]. Marine Biology Research, 13(8): 870–877.
BUSCHMANN A H, 1990. Intertidal macroalgae as refuge and food for amphipoda in Central Chile[J]. Aquatic Botany, 36(3): 237–245.
CARVALHO N F, GRANDE H, ROSA FILHO J S, et al, 2018. The structure of gammarid Amphipod (Crustacea, Peracarida) assemblages associated with(Phaeophyta, Fucales) and their link with the structural complexity of algae[J]. Hydrobiologia, 820(1): 245–254.
CONLAN K E, 1994. Amphipod crustaceans and environmental disturbance: a review[J]. Journal of Natural History, 28(3): 519–554.
CRUZ-RIVERA E, FRIEDLANDER M, 2013. Effects of algal phenotype on mesograzer feeding[J]. Marine Ecology Progress Series, 490: 69–78.
CRUZ-RIVERA E, HAY M E, 2000. Can quantity replace quality? Food choice, compensatory feeding, and fitness of marine mesograzers[J]. Ecology, 81(1): 201–219.
CRUZ-RIVERA E, HAY M E, 2001. Macroalgal traits and the feeding and fitness of an herbivorous amphipod: the roles of selectivity, mixing, and compensation[J]. Marine Ecology Progress Series, 218: 249–266.
DAS S, DESHMUKHE G, DWIVEDI A, 2014. Grazing of selected genera of green, red and brown macroalgae[J]. Applied Ecology and Environmental Research, 12(3): 717–725.
DAUVIN J C, ANDRADE H, DE-LA-OSSA-CARRETERO J A, et al, 2016. Polychaete/amphipod ratios: an approach to validating simple benthic indicators[J]. Ecological Indicators, 63: 89–99.
DE PAULA D R, ALMEIDA A C, JACOBUCCI G B, 2016. Reproductive features of sympatric species of(Amphipoda) on the southeastern Brazilian coast: a comparative study[J]. Crustaceana, 89(8): 933–947.
DUFFY J E, 1990. Amphipods on seaweeds: partners or pests?[J]. Oecologia, 83(2): 267–276.
FLYNN M N, PEREIRA W R L S, PIRES R C, et al, 2009. Population dynamics of(Haswell, 1879) (Amphipoda, Hyalidae) associated to(J. Agardh) at Peruibe beach, Itanhaém (SP), southeastern Brazil[J]. Nauplius, 17(1): 1–8.
GESTOSO I, OLABARRIA C, TRONCOSO J S, 2014. Selection of habitat by a marine amphipod[J]. Marine Ecology, 35(1): 103–110.
GUIDONE M, THORNBER C S, VAN ALSTYNE K L, 2015. Herbivore impacts on two morphologically similar bloom- formingspecies in a eutrophic bay[J]. Hydrobiologia, 753(1): 175–188.
KRAUFVELIN P, SALOVIUS S, CHRISTIE H, et al, 2006. Eutrophication-induced changes in benthic algae affect the behaviour and fitness of the marine amphipod[J]. Aquatic Botany, 84(3): 199–209.
LANCELLOTTI D A, TRUCCO R G, 1993. Distribution patterns and coexistence of six species of the amphipod genus[J]. Marine Ecology Progress Series, 93: 131–141.
LÖF M, SUNDELIN B, BANDH C, et al, 2016. Embryo aberrations in the amphipodas indicators of toxic pollutants in sediments: a field evaluation[J]. Ecological Indicators, 60: 18–30.
OZGA A V, DA SILVA CASTIGLIONI D, 2017. Reproductive biology of two species ofSmith, 1874 (Crustacea: Amphipoda: Hyalellidae) from southern Brazil[J]. Journal of Natural History, 51(41–42): 2509–2521.
PARDAL M A, MARQUES J C, METELO I, et al, 2000. Impact of eutrophication on the life cycle, population dynamics and production ofa (Amphipoda) along an estuarine spatial gradient (Mondego estuary, Portugal)[J]. Marine Ecology Progress Series, 196: 207–219.
POORE A G B, GALLAGHER K M, 2013. Strong consequences of diet choice in a talitrid amphipod consuming seagrass and algal wrack[J]. Hydrobiologia, 701(1): 117–127.
SAINTE-MARIE B, 1991. A review of the reproductive bionomics of aquatic gammaridean amphipods: variation of life history traits with latitude, depth, salinity and superfamily[J]. Hydrobiologia, 223(1): 189–227.
SCHREIDER M J, GLASBY T M, UNDERWOOD A J, 2003. Effects of height on the shore and complexity of habitat on abundances of amphipods on rocky shores in New South Wales, Australia[J]. Journal of Experimental Marine Biology and Ecology, 293(1): 57–71.
SOTKA E E, 2007. Restricted host use by the herbivorous amphipodis motivated by food quality and abiotic refuge[J]. Marine Biology, 151(5): 1831–1838.
VALENTINE J F, DUFFY J E, 2006. The central role of grazing in seagrass ecology[M]//LARKUM A W D, ORTH R J, DUARTE C M. SEAGRASSES: biology, ecology and conservation. Dordrecht: Springer: 463–501.
The population distribution ofin macroalgae canopies of Daya Bay
WANG Hui1, 2, LI Hengxiang1, LI Lu1, YAN Yan1
1. South China Sea Institute of Oceanology, Chinese Academy of Sciences, CAS Key Laboratory of Tropical Marine Bio-resources and Ecology, Guangdong Provincial Key Laboratory of Applied Marine Biology, Guangzhou 510301, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China
The gammaridis a common crustacean species in macroalgae along the coastline of China, but the correlation betweenand macroalgae is not well known. Two dominant macroalgae species found on coastal rocks of Daya Bay, the green algaeand the brown algaevar.were used in the experiments.samples were found in the bush of two macroalgae canopies. The individual number, body size and weight of gammaridpopulation were higher in the bush ofthan invar.The sex ratio and the proportion of females with eggs and the amount of juvenile of gammarid in bush ofvar.were larger than those inwhereas the body sizes of adults and females with eggs and the volume of eggs were smaller in gammarid fromvar.. Results demonstrate that the population distribution and production of gammaridwere different in the two macroalgae, which may be affected by the algal phenotype and habitat preference.
Daya Bay; gammarid; macroalgae; population distribution; production
date: 2018-11-14;
date: 2019-01-04.
National Key Research and Development Program (2017YFB0903703); Natural Science Foundation of Guangdong Province (2018A030313136); Guangzhou Science and Technology Planning Project (201707010163)
YAN Yan. E-mail: yany@scsio.ac.cn
P735
A
1009-5470(2019)04-0052-7
10.11978/2018119
http://www.jto.ac.cn
2018-11-14;
2019-01-04。
孙淑杰编辑
国家重点研发计划项目(2017YFB0903703); 广东省自然科学基金项目 (2018A030313136); 广州市科技计划项目(201707010163)
王卉(1985—), 女, 河北省石家庄市人, 硕士, 从事海洋环境生态学研究。E-mail: lison0524@qq.com
严岩。E-mail: yany@scsio.ac.cn
Editor: SUN Shujie

