南海鸢乌贼中型群雄性个体肌肉和性腺组织能量积累及其分配
朱凯, 张立川, 陈新军,2,3,4, 姚吉祥, 韩飞, 林东明,2,3,4
南海鸢乌贼中型群雄性个体肌肉和性腺组织能量积累及其分配
朱凯1, 张立川1, 陈新军1,2,3,4, 姚吉祥1, 韩飞1, 林东明1,2,3,4
1. 上海海洋大学海洋科学学院, 上海 201306; 2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306; 3. 国家远洋渔业工程技术研究中心, 上海 201306; 4. 远洋渔业协同创新中心, 上海 201306
利用组织能量密度测定技术和残差指标分析方法, 分析了南海鸢乌贼中型群雄性个体肌肉组织和性腺组织的能量积累及其分配变化过程。结果显示, 胴体、尾鳍、足腕、精荚复合体、精巢等组织的能量密度值分别为21.16±1.44、21.98±1.51、21.44±1.50、20.83±1.70和21.41±1.70kJ•g–1。胴体和精荚复合体两组织的能量密度在不同性腺成熟度之间均存在显著性差异, 而尾鳍、足腕、精巢等3种组织的能量密度则在不同性腺成熟度之间均没有统计学差异。个体总能量积累为299.31±90.81kJ; 随着个体生长, 总能量积累呈现增加的趋势。胴体、足腕和尾鳍等肌肉组织的能量占比为95.31%~98.04%, 随着性腺发育呈现降低的趋势; 精巢和精荚复合体等性腺组织的能量总投入占比为2.63%~5.33%, 随着性腺发育呈增加的趋势, 并在Ⅴ期达到最大值。同时, 残差指标分析显示, 胴体、尾鳍、足腕等肌肉组织能量积累–胴长残差与性腺组织能量积累–胴长残差呈显著的正相关关系, 表明个体性腺发育过程中肌肉组织能量没有转化用于性腺组织的生长发育, 其生殖能量投入倾向于外源性投入。初步掌握了南海鸢乌贼中型群雄性个体肌肉和性腺组织能量的积累变化过程, 为深入了解它们的繁殖策略和为可持续开发利用该种类资源提供了科学基础。
鸢乌贼; 雄性个体; 繁殖策略; 能量投入; 中国南海
鸢乌贼具有复杂的种群结构, 分布在太平洋和印度洋的热带、亚热带海域(Nesis, 1977; 陈新军等, 2009)。南海海域的鸢乌贼主要为中型群和微型群, 其中中型群为典型的鸢乌贼群体, 背部具发光器, 体型较大, 胴长可达266mm, 已知的生命周期可达135d(Nesis, 1977; 张鹏等, 2015; 江艳娥等, 2019)。鸢乌贼在我国南海的海洋食物链中处于中间层级, 既是小型鱼类、甲壳类的捕食者, 也是鲨鱼、金枪鱼等大型鱼类和鲸、海豹、海豚等海洋哺乳类的重要食物来源, 在海洋生态系统中扮演着重要的角色(Jereb et al, 2010; 张宇美, 2014)。同时, 鸢乌贼是重要的海洋经济种类, 在我国南海的蕴藏量巨大, 具有较好的商业开发前景(张俊等, 2014); 已经引起了众多学者对其基础生物学和资源量等相关内容进行研究(范江涛等, 2013; 张宇美等, 2013; 龚玉艳等, 2016; 江艳娥等, 2019)。鸢乌贼性腺成熟时的性腺指数较低(<10%)(颜云榕等, 2012; 张宇美等, 2013; 江艳娥等, 2019), 与澳洲双柔鱼(McGrath et al, 2002)、翼蛸(Laptikhovsky et al, 2014)等种类的性腺指数相近, 但是远低于性腺指数高达40%的强壮桑椹乌贼(Jackson et al, 2004), 一定程度地说明了鸢乌贼用于性腺发育的能量较少。然而, 关于鸢乌贼性腺发育过程中肌肉、性腺等组织能量积累及其组织间投入分配的研究仍鲜有报道。
头足类生长速度快, 寿命相对较短, 繁殖是其生活史的关键阶段,对有限的能量积累在其生长、生殖以及运动等生命活动的分配投入具有重要影响(Wells et al,1996; Takagi et al, 2002)。这些种类的繁殖特性具有高度灵活性, 其潜在繁殖力、配子发生及其成熟式样、生殖投入及产卵策略等具有属种特殊性和环境适变性(Rocha et al, 2001; McGrath et al, 2002)。一般地, 头足类的生殖投入方式可以划分为外源性投入和内源性投入, 倾向于外源性投入方式的种类的能量主要来源于即时的食物摄取, 如澳洲双柔鱼(McGrath et al, 2002)、阿根廷滑柔鱼(林东明等, 2017); 而倾向于内源性投入方式的种类的能量则主要来源于性腺以外其他身体组织所储存的能量, 如强壮桑椹乌贼(Jackson et al, 2004)。肌肉组织是头足类能量积累的最大器官(Navarro et al, 2014), 通过研究生活史过程中的肌肉组织和性腺组织之间的能量分配模式, 有助于掌握这些种类的生殖投入方式(林东明等, 2017; Lin et al, 2017)。为此, 本研究通过测定鸢乌贼中型群雄性个体肌肉和性腺组织的能量密度, 分析其肌肉和性腺组织的能量积累情况, 初步探讨分析性腺发育过程中肌肉和性腺组织能量的积累变化过程, 以深入了解它们的生殖策略, 并为可持续开发利用南海鸢乌贼资源提供科学基础。
1 材料与方法
1.1 样本来源
鸢乌贼样本来自于灯光罩网船渔获物, 采样时间为2017年7—8月, 采样海域为9°11'16"—11°22'55"N、111°15'36"—115°52'12"E(图1)。根据灯光罩网船作业特点, 本研究共进行了8个站点的样本采集, 每个站点随机采集样本30尾, 并置于–20°C冷冻保藏。

图1 鸢乌贼样本采集海域及其采样站点
1.2 生物学测定
实验样本在实验室常温下解冻后, 进行生物学测定, 测定项目包括胴长(mantle length,m)、体重(body weight,b)、胴体腔重(mantle weight,ma)、足腕重(arm weight,ar)、尾鳍重(fin weight,fi)、精荚复合体重(spermatogenic complex weight,sc)、精巢重(testis weight,te)以及性腺成熟度(maturity stage)。长度和重量数据测定分别精确到1mm和0.1g。性腺成熟度判别参照刘必林(2006)等的形态学划分标准, 结合实验观察, 共划分为Ⅰ—Ⅵ期6个等级。Ⅰ期性腺器官为半透明, Ⅱ期性腺器官呈白色、精荚复合体结构明显但未见精荚, 二者为性未成熟期; Ⅲ期性腺器官显著增大并可见少量精荚, Ⅳ期成熟精荚逐步填充精荚囊, 二者为性成熟期; Ⅴ期可见外排精荚, 为繁殖期; Ⅵ期精巢衰败, 精荚复合体没有精荚或精荚不完整,为繁殖后期。本研究未发现Ⅵ期雄性个体, 共测定分析了Ⅰ—Ⅴ期的鸢乌贼中型群雄性个体样本69尾(表1), 并用于随后的组织能量密度测定及能量积累分析。

表1 鸢乌贼中型群雄性个体能量积累及其分配研究的样本组成
注:括号内为平均值±SD。
1.3 组织能量密度测定
鸢乌贼组织能量密度测定的组织样品包括胴体、尾鳍、足腕、精荚复合体和精巢等, 每尾样本每个组织样品独立测定分析。测定分析前, 独立采集每尾样本的胴体、足腕、尾鳍、精荚复合体和精巢等组织样品, 其中胴体组织采自腹部, 约5g左右湿样; 足腕组织采自左第4腕足, 约5g左右湿样; 尾鳍、精荚复合体、精巢则为整个组织摘取采集。每个组织样品称取湿重(wet weight,w)后, 置入冷冻干燥机(Christ Alpha 1-4/LD plus)进行–80°C的冷冻干燥; 称取组织样品干燥后的干重(dry weight,d), 置入研磨机(RetschMM400)中研磨粉碎。随后, 称取一定量的组织干粉, 在Parr6100型氧弹热量仪(Calorimeter Parr6100, Parr Instrument Company, Moline, IL, USA)中测定其组织能量密度(energy density,e)。每个组织样品的湿重和干重测定精确到0.001g, 能量密度值单位为kJ·g–1。
1.4 数据处理
1.4.1 组织的绝对能量积累
胴体、尾鳍、足腕、精巢和精荚复合体等每个组织的绝对能量积累(absolute energy accumulation,a)计算公式(Dunn et al, 2014)为:
a=e×t×d/w
式中,a为计算组织的绝对能量积累, 单位kJ;e为计算组织的能量密度, 单位kJ·g–1;t为计算组织的总湿重, 单位g;d为计算组织用于测定能量密度值样品的干重, 单位g;w为计算组织用于测定能量密度值样品的湿重, 单位g。
1.4.2 组织的相对能量积累
假设鸢乌贼雄性个体的总能量等于每个计算组织的能量之和(total energy,t), 即为胴体、尾鳍、足腕、精巢和精荚复合体等组织的能量积累之和。以此为基准, 计算每个组织在不同性腺发育时期的能量积累占比, 分析肌肉组织、性腺组织随着性腺发育的能量积累变化过程。
每个组织的相对能量积累(relative energy accumulation,r)计算公式(林东明, 2015)为:
ri=ai/ti×100
式中,r为计算组织的相对能量积累, 单位%;a为计算组织的绝对能量积累, 单位kJ;t为计算个体的总能量, 单位kJ;为性腺成熟度等级。
1.4.3 生殖能量投入分析
在R平台利用lmodel2函数(Legendre, 2013), 分别进行胴体、足腕、尾鳍和性腺(合并精荚复合体和精巢组织)等每个组织绝对能量积累与个体胴长(a-m)的Model Ⅱ线性回归分析, 随后根据回归参数计算每个组织绝对能量积累的残差值并进行残差标准化。利用残差指标对个体组织质量特征与生殖投入、能量分配等之间的关系进行分析 (Moltschaniwskyj et al, 2000; Jackson et al, 2004; Pecl et al, 2004; Stevenson et al, 2006; Argüelles et al, 2010; Barakat et al, 2011): 残差的正负性分别代表了组织质量特征的好与坏, 而在性腺组织绝对能量积累-胴长残差与肌肉组织绝对能量积累-胴长残差相关性分析中, 正相关关系说明两个组织之间没有能量的传递, 负相关关系则说明两个组织之间存在能量的传递。
1.5 数据分析
各参数均以平均值±标准差(mean±SD)表示。利用线性函数拟合回归雄性个体的个体总能量与胴长关系, 利用单因素方差分析(One Way-ANOVA)和Tukey HSD检验方法检验各组织能量密度、组织能量积累和组织能量积累-胴长残差等在性腺成熟度水平上的差异性, 利用Pearson相关性检验方法分析各肌肉组织绝对能量积累-胴长残差和性腺组织绝对能量积累-胴长残差的相关性。使用Excel2007和SPSS18.0软件进行数据处理与分析。
2 结果
生物学测定分析显示, 鸢乌贼中型群雄性样本胴长为100~137mm, 平均胴长为120.63±10.57mm; 体重为26~115g, 平均体重为70.31±10.57g。
2.1 组织能量密度
分析显示, 南海鸢乌贼中型群雄性个体胴体、尾鳍、足腕、精荚复合体、精巢等组织的能量密度值分别为21.16±1.44、21.98±1.51、21.44±1.50、20.83±1.70和21.41±1.70kJ·g–1, 以尾鳍的组织能量密度值为最大, 其次为足腕组织, 精荚复合体组织能量密度值最小(图2)。不同性腺成熟等级下, 胴体和精荚复合体两组织的能量密度均存在显著性差异(胴体:=3.02,=0.02; 精荚复合体:=8.50,=0.00)。其中胴体组织在I期时的能量密度显著高于Ⅱ期、Ⅲ期和Ⅳ期(Tukey HSD,<0.05); 精荚复合体的能量密度在性腺发育前期(Ⅰ、Ⅱ、Ⅲ期)逐渐增加, 并在Ⅲ期时达到最大值(Tukey HSD,<0.05)。随着性腺发育, 尾鳍、足腕和精巢等组织的能量密度均不存在显著性差异(尾鳍:=1.11,=0.36; 足腕:=1.08,=0.38; 精巢:=0.86,= 0.48)。
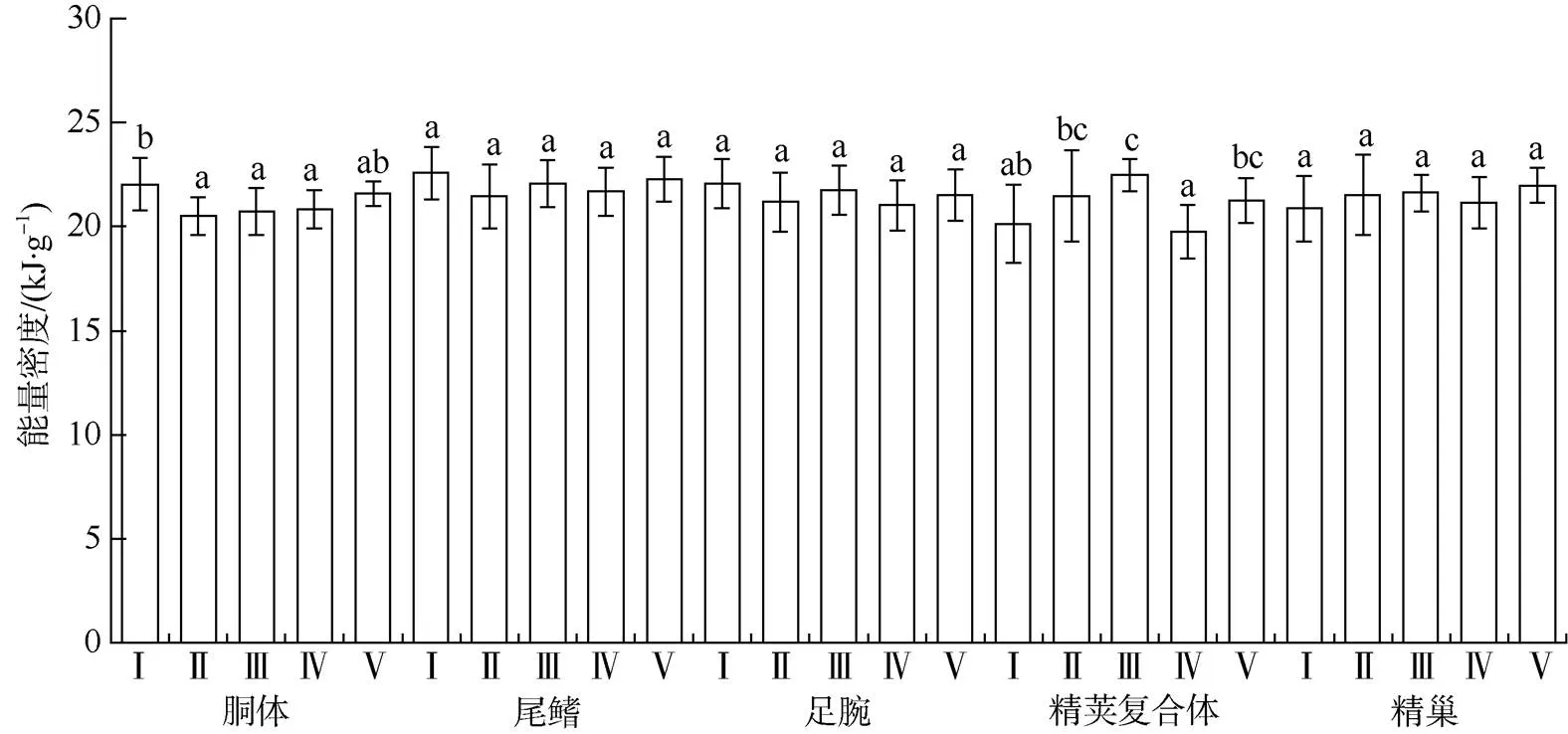
图2 不同性腺成熟度鸢乌贼中型群雄性个体的组织能量密度 各组平均值中标示的不同字母表示Tukey HSD检验差异显著(P<0.05), 下同。样本数69
Fig. 2 The tissue energy density in the medium form of maleaccording to different maturity. Mean values with different scripts are significantly different (<0.05) as determined using Tukey HSD test; the same below. Sample number is 69
2.2 肌肉、性腺组织的绝对能量积累
南海鸢乌贼中型群雄性个体胴体、尾鳍和足腕等肌肉组织的能量积累分别为167.57±43.35、36.54± 12.19和69.06±25.72kJ, 精荚复合体、精巢等性腺组织能量积累分别为4.61±4.04、6.38±3.41kJ。随着性腺发育, 胴体、尾鳍和足腕等肌肉组织能量积累均存在显著性差异(胴体:=12.10,=0.00; 尾鳍:=25.17,=0.00; 足腕:=13.31,=0.00), 性腺发育前期(Ⅰ—Ⅲ期), 肌肉各组织能量积累迅速, 随后较为平缓(图3a)。其中, 胴体组织能量积累在Ⅳ期达到最大值(Tukey HSD,<0.05), 尾鳍、足腕两组织均在Ⅴ期时达到最大值(Tukey HSD,0.05)。不同性腺成熟等级之间, 精荚复合体和精巢等组织能量积累差异性显著(精荚复合体:=12.84,=0.02; 精巢:=10.95,=0.00), 两者均在Ⅰ—Ⅱ期积累缓慢, 在Ⅲ期后积累较为迅速(图3b)。其中, 精荚复合体的能量积累在Ⅴ期时达到最大值(Tukey HSD,0.05); 精巢组织能量积累在Ⅳ期时达到最大值(Tukey HSD,0.05)。
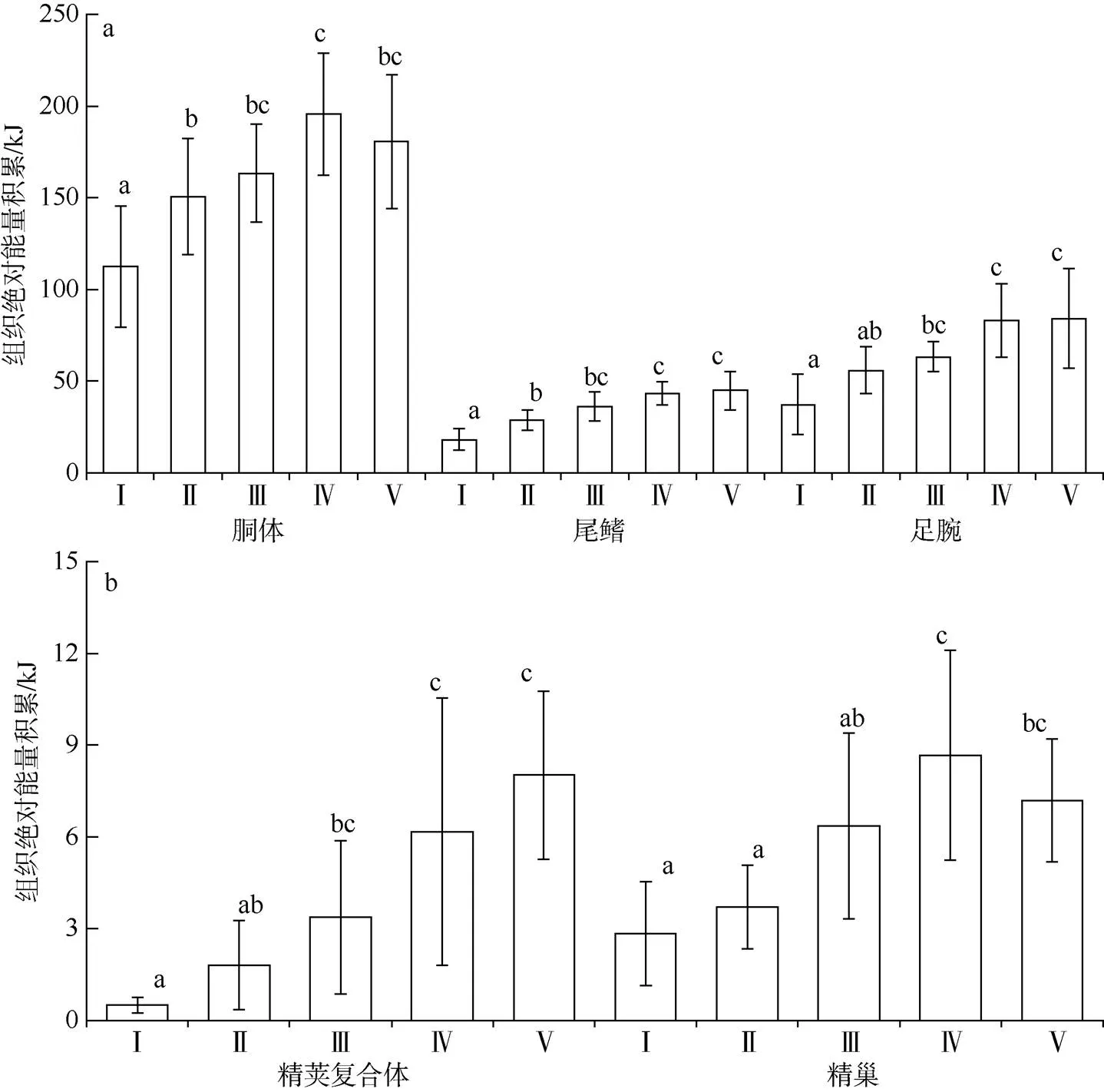
图3 不同性腺成熟度鸢乌贼中型群雄性个体各组织绝对能量积累分布 a. 胴体、尾鳍和足腕组织绝对能量积累; b. 精荚复合体和精巢组织绝对能量积累。样本量为69
鸢乌贼中型群雄性个体样本的总能量为299.31±90.81kJ。个体总能量积累与胴长呈显著的线性关系(t=5.48×m–373.6,R=0.335,=0.00), 随着个体胴长增加, 其总能量不断积累, 在120~130mm处达到最大(图4)。
2.3 肌肉、性腺组织的相对能量积累
随着性腺发育, 肌肉组织(胴体、尾鳍和足腕)的总能量占比呈下降趋势, 占比自Ⅰ期的98.04%下降为Ⅴ期的95.31%(图5a)。其中, 胴体组织的能量占比随着性腺成熟度的增加而下降, 足腕组织的能量占比稳步增加, 尾鳍组织的能量占比也呈增加趋势, 但在Ⅳ期时略有回落, 在Ⅴ期时达到最大值。性腺组织(精巢和精荚复合体)的总能量占比随着性腺发育逐渐增加, 在Ⅴ期时达到最大值, 占比为4.69% (图5b)。其中, 精荚复合体的能量占比随着性腺成熟度逐步增加, 精巢的能量占比在Ⅰ—Ⅲ期时呈平缓状态, 之后逐步上升, 在Ⅳ期达到最大。不同性腺成熟度等级, 各组织的能量占比存在显著性差异(2=52.50,=0.00)。
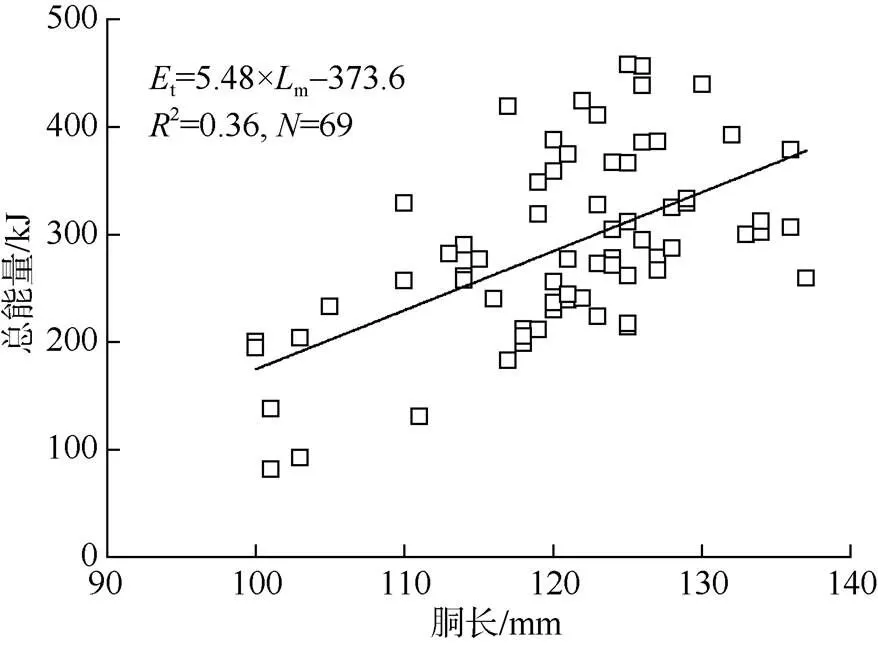
图4 鸢乌贼中型群雄性个体的总能量积累(N为样品数)

图5 不同性腺成熟度鸢乌贼中型群雄性个体肌肉组织和性腺组织的相对能量积累 a. 肌肉组织相对能量积累; b. 性腺组织相对能量积累。样本量为69
2.4 肌肉与性腺组织的能量分配
Model Ⅱ回归分析显示, 南海鸢乌贼中型群雄性个体尾鳍绝对能量积累与胴长的相关系数最大, 性腺组织绝对能量积累与胴长的相关系数次之, 胴体和足腕绝对能量积累与胴长的相关系数均比较小(表2)。随着性腺发育, 胴体绝对能量积累-胴长的残差增加显著(=3.21,=0.02), 在Ⅳ期时达到最大值, 随后在Ⅴ期时略显下降, 但不显著(图6a); 尾鳍绝对能量积累(afi)-胴长残差、足腕绝对能量积累(aar)-胴长残差和性腺绝对能量积累(ago)-胴长残差自Ⅱ期开始呈现增加的趋势(afi-m,=9.03,<0.001;aar-m,=4.96,=0.002;ago-m,=8.25,<0.01), 并均在Ⅴ期达到最大值, 表明这3个组织的质量特征不断改善(图6 b、c、d)。
胴体、尾鳍、足腕、性腺等组织绝对能量积累与胴长Model Ⅱ回归方程的残差拟合分析显示, 胴体绝对能量积累-胴长残差、尾鳍绝对能量积累-胴长残差、足腕绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差均呈显著的正相关关系(<0.05) (表3, 图7)。同时, 不同性腺成熟等级残差分析显示, 尾鳍绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差在每个性腺成熟度时均呈正相关关系, 胴体、足腕两组织的绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差仅在Ⅱ期和Ⅳ期时呈弱的负相关关系(表3)。这显示鸢乌贼中型群雄性个体在性腺发育过程中肌肉组织积累的能量不会转化用于性腺组织的生长发育。

表2 鸢乌贼中型群雄性个体胴体、尾鳍、足腕、性腺等组织绝对能量积累与胴长的Model Ⅱ回归参数表

图6 不同性腺成熟度鸢乌贼中型群雄性个体肌肉和性腺组织绝对能量积累-胴长残差分布 a. 胴体绝对能量积累-胴长残差; b. 尾鳍绝对能量积累-胴长残差; c. 足腕绝对能量积累-胴长残差; d. 性腺绝对能量积累-胴长残差
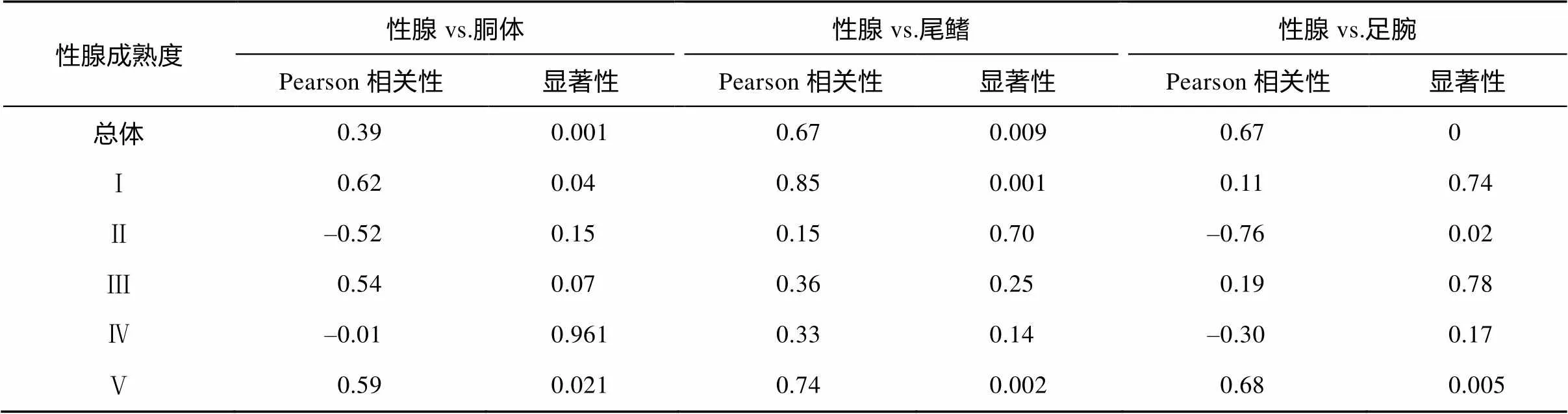
表3 鸢乌贼中型群雄性个体性腺组织绝对能量积累-胴长残差与肌肉组织绝对能量积累-胴长残差的Pearson相关性
3 讨论
3.1 组织能量密度的变化
一般地, 水生生物的组织能量密度决定于其脂肪、蛋白质和碳水化合物等营养物质的含量, 并受到诸如个体性腺发育、饵料生物丰度以及栖息水温、水深等的影响与调节(Love, 1980;崔奕波, 1989)。其中在头足类中蛋白质既是能量积累的主要物质基础, 也是在外界饵料不足时优先消耗供给能量的营养物质(Lee, 1995; Navarro et al, 2014)。戴宏杰等(2014)曾报道头足类在能量消耗过程中以蛋白质为主要供能物质。本研究显示, 鸢乌贼中型群雄性个体胴体和精荚复合体组织的能量密度均随着性腺发育而变化显著(图2), 可能与这些组织的营养物质成分的变化密切相关。鸢乌贼的摄食状况(如摄食水平、食物组成等)及其食性均随着性腺发育呈现出一定的变化, 食物组成从浮游动物转向鱼类和其他头足类等(张宇美等, 2013; 龚玉艳等, 2016), 而伴随着食性变化产生的能量消耗也会相应地增加(Seibel et al, 1997)。精荚复合体是主要的生殖器官, 在性腺发育过程中逐渐完善并组装、存储成熟的精荚(陈新军等, 2009)。因此, 这些过程可能导致肌肉、精荚复合体组织的营养物质成分改变, 进而引起组织能量密度的变化。

图7 鸢乌贼中型群雄性个体胴体、尾鳍、足腕、性腺组织绝对能量积累与胴长Model Ⅱ回归拟合的残差关系图 a. 胴体绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差; b. 尾鳍绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差; c. 足腕绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差
此外, 栖息环境的变化也一定影响着生物体的内在生理变化, 并导致有机体营养物质的变化(Seibel et al, 2000)。众所周知, 鸢乌贼随着个体的生长发育具有明显的垂直移动行为(ontogenetic movement), 个体越大栖息水层越深(Sánchez- Velasco et al, 2016)。其中伴随着运动方式、能量消耗及其供给等方式的改变,机体的营养组成也因之而发生了变化(Love, 1980; 崔奕波, 1989)。所以, 不同生长阶段栖息环境的变化也影响着这些个体能量物质的结构组成。但是, 因为这个过程涉及了诸多环境因子, 并且各因子的具体影响机制和权重仍不明确(Sakurai et al, 1995; Staaf et al, 2013), 具体环境诱导性的变化机制仍有待深入研究。
3.2 组织能量积累
头足类的生长过程可以分为两个阶段, 即早期的体型快速生长期和后期的性腺发育期(Jereb et al, 2010)。在这两个阶段中, 其肌肉组织和性腺组织的能量积累变化也表现出相应特性。本研究发现(图3), 鸢乌贼中型群雄性个体肌肉组织绝对能量积累在性腺发育前期增加显著, 最快时段发生在Ⅰ—Ⅱ期, 在Ⅳ期之后趋于平缓甚至降低; 与之相反, 性腺组织能量积累在性腺发育前期增加平缓, 在Ⅲ—Ⅳ期增加速度加快, 说明该时期性腺组织发育比较快。同时, 在组织能量占比角度, 精荚复合体和精巢两个组织的相对能量积累也存在一定的差异性(图5)。性腺成熟度Ⅰ—Ⅳ期时, 精巢组织能量占比大于精荚复合体, 二者的能量积累均呈增加趋势, 且差值逐渐减小; 在Ⅴ期时, 精荚复合体组织能量占比大于精巢组织。这可能与此时精巢成熟后逐渐开始萎缩、而精荚复合体不断积聚成熟精荚的生活史特性密切相关(Rocha et al, 2001)。
同时, 本研究发现鸢乌贼中型群雄性个体的总能量与胴长呈显著的线性关系(图4)。但是, 个体总能量在胴长120~130mm时达到最大值, 随后略呈下降趋势, 表明该胴长范围应该是这些个体能量积累的转折点。张鹏等(2015)研究发现鸢乌贼中型群雄性个体的初次性成熟胴长为125.6mm, 正处于本研究个体总能量最大值的胴长范围之间, 进一步说明鸢乌贼中型群雄性个体的能量积累与其生长发育密切相关, 这可能是头足类终生一次繁殖的生活史策略在能量积累上的表现特征之一(Rocha et al, 2001)。
此外, 头足类组织能量积累通常与其摄食活动、繁殖行为等密切相关(Navarro et al, 2014)。Nesis(1977)曾报道在繁殖期间鸢乌贼雌性个体保持摄食活动, 并且个体有所生长。这样, 鸢乌贼雌性个体在产卵繁殖期可能继续积累能量用于个体的生长及其性腺发育。但是, 本研究发现中型群鸢乌贼雄性个体的组织能量积累在性腺成熟度Ⅳ期时达到最大值, 随后积累趋于平缓或者有所下降。产生这种雌雄个体之间能量积累差异性的原因可能是雌性个体生命周期比雄性长, 产卵期需要更多摄食能量来维持产卵活动(Lee, 1995)。
3.3 生殖能量的投入分配
头足类的繁殖策略具有多样性及其环境适应性等特征, 其产卵类型包括瞬时终端产卵型、多轮产卵型、多次产卵型、间歇终端产卵型和连续产卵型(Rocha et al, 2001), 随之的生殖投入类型也具有一定的种特殊性(林东明, 2015)。一般地, 瞬时终端产卵者倾向于内源性生殖投入, 而多轮产卵者、多次产卵者和连续产卵者等则倾向于外源性生殖投入。前者的生殖能量来源于自身既已存储在肌肉、消化腺等组织的能量, 后者的生殖能量则来源于即时的饵料摄食(McGrath et al, 2002)。本研究显示, 鸢乌贼中型群雄性个体肌肉组织绝对能量积累-胴长残差与性腺组织绝对能量积累-胴长残差呈显著的正相关关系(表2、图6), 显示其肌肉组织的能量积累不被用于性腺组织发育。这表明鸢乌贼的生殖能量投入倾向于外源性投入, 这种投入方式应该与其多次产卵的繁殖策略(Rocha et al, 2001)相吻合。同时, 鸢乌贼的这种生殖能量投入方式与澳洲双柔鱼(McGrath et al, 2002)和茎柔鱼(Nigmatullin et al, 2009)等属种相一致, 即性腺发育过程中的能量需求主要来源于即时的饵料摄食; 但是, 有别于强壮桑椹乌贼的生殖能量投入方式, 后者在性腺发育开始后肌肉组织迅速衰败以转化能量供给配子发生及繁殖活动(Jackson et al, 2004)。此外, 在性腺Ⅱ期和ⅣⅣ期, 胴体、足腕两组织的绝对能量积累-胴长残差与性腺组织绝对能量积累-胴长残差呈弱的负相关关系, 表明这两组织的绝对能量积累在这两个时期时可能转化用于性腺组织的生长发育, 但是这种能量转化应该是有限的。同时, 如果存在这种情况也一定地说明了鸢乌贼生殖能量投入存在一定的灵活性, 肌肉组织能量的使用可能是一种临时且有限的辅助行为(Villegas-Ríos et al, 2014; 林东明等, 2017)。
此外, 鸢乌贼中型群雄性个体肌肉、性腺组织-胴长残差分析结果显示(表3、图7), 这些组织的质量特征随着性腺发育逐步改善; 然而, 在不同性腺成熟度等级之间, 胴体、足腕和尾鳍等肌肉组织绝对能量积累-胴长残差与性腺绝对能量积累-胴长残差的相关关系并不一致。这些结果表明, 在性腺发育过程中个体能量分配具有一定的侧重点, 在Ⅴ期时胴体组织质量体征虽然良好, 但相比Ⅳ期时已经开始出现衰退趋势。相反, 尾鳍、足腕、性腺等组织的质量特征在Ⅱ—Ⅴ期均处于良好状态。这可能与鸢乌贼性腺成熟后胴体组织逐渐停止生长, 而尾鳍、足腕需要保持质量水平以维持正常的繁殖和摄食等活动相关(Rocha et al, 2001)。与此同时, 性腺组织则持续保持良好状态以产生配子并使其繁殖效率最大化(Lee, 1995; Moltschaniwskyj et al, 2000; Jackson et al, 2004)。这种肌肉和性腺组织的质量特征变化类似于与福氏枪乌贼(Collins et al, 1995)和阿根廷滑柔鱼(林东明等, 2017)等种类, 这可能是这些种类对其终生一次繁殖产卵生活史特性的一种适应性(Stearns, 1992)。但是, 本研究没有发现精巢排空后的实验个体, 尚不能确定繁殖后这些个体的能量积累及其变化构成。因此在今后的研究中需要加强实验样本收集, 以完善整个繁殖活动中个体能量积累与分配策略的研究内容。
陈新军, 刘必林, 王尧耕, 2009. 世界头足类[M]. 北京: 海洋出版社: 312–313. CHEN XINJUN, LIU BILIN, WANG YAOGENG, 2009. The world Cephalopods[M]. Beijing: China Ocean Press: 312–313 (in Chinese).
崔奕波, 1989. 鱼类生物能量学的理论与方法[J]. 水生生物学报, 13(4): 369–383. CUI YIBO, 1989. Bioenergetics of fishes: theory and methods[J]. Acta Hydrobiologica Sinica, 13(4): 369–383 (in Chinese with English abstract).
戴宏杰, 陈道海, 2014. 头足类营养研究进展[J]. 动物营养学报, 26(3): 597–604. DAI HONGJIE, CHEN DAOHAI, 2014. Research progresses on nutrition of cephalopods[J]. Chinese Journal of Animal Nutrition, 26(3): 597–604 (in Chinese with English abstract).
范江涛, 冯雪, 邱永松, 等, 2013. 南海鸢乌贼生物学研究进展[J]. 广东农业科学, 40(23): 122–128. FAN JIANGTAO, FENG XUE, QIU YONGSONG, et al, 2013. Review on the biology of purpleback flying squid in South China Sea[J]. Guangdong Agricultural Sciences, 40(23): 122–128 (in Chinese with English abstract).
龚玉艳, 詹凤娉, 杨玉滔, 等, 2016. 南海鸢乌贼摄食习性的初步研究[J]. 南方水产科学, 12(4): 80–87. GONG YUYAN, ZHAN FENGPING, YANG YUTAO, et al, 2016. Feeding habits ofin the South China Sea[J]. South China Fisheries Science, 12(4): 80–87(in Chinese with English abstract).
江艳娥, 陈作志, 林昭进, 等, 2019. 南海海域鸢乌贼中型群与微型群渔业生物学比较[J]. 水产学报, 43(2): 454–466. JIANG YAN'E, CHEN ZUOZHI, LIN ZHAOJIN, et al, 2019. Comparison of fishery biology between medium-form and dwarf-form ofin South China Sea[J]. Journal of Fisheries of China, 43(2): 454–466 (in Chinese with English abstract).
林东明, 2015. 阿根廷滑柔鱼的产卵策略研究[D]. 上海: 上海海洋大学: 1–100. LIN DONGMING, 2015. Spawning strategy of Argentine shortfin squid,(Cephalopoda: Ommastrephidae) in the southwest Atlantic[D]. Shanghai: Shanghai Ocean University: 1–100 (in Chinese).
林东明, 陈新军, 魏嫣然, 等, 2017. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入[J]. 水产学报, 41(1): 70–80. LIN DONGMING, CHEN XINJUN, WEI YANRAN, et al, 2017. Energy accumulation of both somatic and reproductive tissues and its allocation to reproduction in Argentinean short-fin squid ()[J]. Journal of fisheries of China, 41(1): 70–80 (in Chinese with English abstract).
刘必林, 2006. 利用耳石微结构研究印度洋西北海域鸢乌贼的年龄和生长[D]. 上海: 上海水产大学. LIU BILIN, 2006. Studying age and growth of purple back flying squid () in northwest Indian Ocean based on statolith microstructure[D]. Shanghai: Shanghai Ocean University (in Chinese with English abstract).
颜云榕, 冯波, 卢伙胜, 等, 2012. 南沙群岛北部海域鸢乌贼()夏季渔业生物学研究[J]. 海洋与湖沼, 43(6): 1177–1186. YAN YUNRONG, FENG BO, LU HUOSHENG, et al, 2012. Fishery biology of purpleback flying squidin northern sea areas around Nansha islands in summer[J]. Oceanologia et Limnologia Sinica, 43(6): 1177–1186(in Chinese with English abstract).
张俊, 陈国宝, 张鹏, 等, 2014. 基于渔业声学和灯光罩网的南海中南部鸢乌贼资源评估[J]. 中国水产科学, 21(4): 822– 831. ZHANG JUN, CHEN GUOBAO, ZHANG PENG, et al, 2014. Estimation of purpleback flying squid () resource in the central and southern South China Sea based on fisheries acoustics and light-falling net[J]. Journal of Fishery Sciences of China, 21(4): 822–831(in Chinese with English abstract).
张鹏, 晏磊, 杨炳忠, 等, 2015. 春季南沙海域鸢乌贼种群结构特征的研究[J]. 南方水产科学, 11(5): 11–19. ZHANG PENG, YAN LEI, YANG BINGZHONG, et al, 2015. Population structure of purpleback flying squid () in Nansha area in spring[J]. South China Fisheries Science, 11(5): 11–19 (in Chinese with English abstract).
张宇美, 颜云榕, 卢伙胜, 等, 2013. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究[J]. 广东海洋大学学报, 33(3): 56–64. ZHANG YUMEI, YAN YUNRONG, LU HUOSHENG, et al, 2013. Study on feeding and reproduction biology of Purple flying squid,in the Western South China Sea[J]. Journal of Guangdong Ocean University, 33(3): 56–64(in Chinese with English abstract).
张宇美, 2014. 基于碳氮稳定同位素的南海鸢乌贼摄食生态与营养级研究[D]. 湛江: 广东海洋大学: 1–53. ZHANG YUMEI, 2014. Feeding habits and trophic level of purpleback flying squid,based on carbon and nitrogen stable isotope analysis in the South China Sea[D]. Zhanjiang: Guangdong Ocean University: 1–53(in Chinese with English abstract).
ARGÜELLES J, TAFUR R, 2010. New insights on the biology of the jumbo squidin the Northern Humboldt Current System: Size at maturity, somatic and reproductive investment[J]. Fisheries Research, 106(2): 185–192.
BARAKAT A, ROUMIEH R, ABDEL MEGUID N E, et al, 2011. Feed regimen affects growth, condition index, proximate analysis and myocyte ultrastructure of juvenile spinefoot rabbitfish[J]. Aquaculture Nutrition, 17(3): e773–e780.
COLLINS M A, BURNELL G M, RODHOUSE P G, 1995. Reproductive strategies of male and female(Cephalopoda: Loliginidae)[J]. Journal of the Marine Biological Association of the United Kingdom, 75(3): 621–634.
JACKSON G D, SEMMENS J M, PHILLIPS K L, et al, 2004. Reproduction in the deepwater squid, what does it cost?[J]. Marine Biology, 145(5): 905–916.
JEREB P, ROPER C F E, 2010. Cephalopods of the world: An annotated and illustrated catalogue of cephalopod species known to date. Volume 2. Myopsid and Oegopsid Squids[M]. Rome: FAO: 605.
LAPTIKHOVSKY V, SALMAN A, ÖNSOY B, et al, 2014. Reproduction in rare bathyal octopodsand(Cephalopoda: Octopoda) in the east Mediterranean as an apparent response to extremely oligotrophic deep seas[J]Deep Sea Research Part I: Oceanographic Research Papers, 92: 85–92.
LEGENDRE P, 2013. Model II regression user’s guide, R edition[J]. R Vignette, 4: 1-14.
LEE P G, 1995. Nutrition of cephalopods: Fueling the system[J]. Marine and Freshwater Behaviour and Physiology, 25(1–3): 35–51.
LIN DONGMING, CHEN XINJUN, WEI YANRAN, et al, 2017. The energy accumulation of somatic tissue and reproductive organs in post-recruit femaleand the relationship with sea surface oceanography[J]Fisheries Research, 185: 102–114.
LOVE R M, 1980. The chemical biology of fishes. Vol. 2[M]. New York: Academic Press: 1–30.
MCGRATH B, JACKSON G, 2002. Egg production in the arrow squid(Cephalopoda: Ommastrephidae), fast and furious or slow and steady?[J]. Marine Biology, 141(4): 699–706.
MOLTSCHANIWSKYJ N A, SEMMENS J M, 2000. Limited use of stored energy reserves for reproduction by the tropical loliginid squidsp.[J]. Journal of Zoology, 251(3): 307–313.
NAVARRO J C, MONROIG Ó, SYKES A V, 2014. Nutrition as a key factor for cephalopod aquaculture[M]//IGLESIAS J, FUENTES L, VILLANUEVA R. Cephalopod culture. Dordrecht: Springer: 77–95.
NESIS K N, 1977. Population structure in the squid(Lesson, 1830)(Ommastrephidae) in the western tropical Pacific[J]. Proceeding of the Academy of Science Union of Soviet Socialist Republics, ShirschInstitute of Oceanography, 107: 15–29 (in Russian with English abstract).
NIGMATULLIN C M, MARKAIDA U, 2009. Oocyte development, fecundity and spawning strategy of large sized jumbo squid(Oegopsida: Ommastrephinae) [J]. Journal of the Marine Biological Association of the United Kingdom, 89(4): 789–801.
PECL G T, MOLTSCHANIWSKYJ N A, TRACEY S R, et al, 2004. Inter-annual plasticity of squid life history and population structure: Ecological and management implications[J]. Oecologia, 140(2): 380.
ROCHA F, GUERRA Á, GONZÁLEZ A F, 2001. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 76(3): 291–304.
SAKURAI Y, YOUNG R E, HIROTA J, et al, 1995. Artificial fertilization and development through hatching in the oceanic squidsand(Cephalopoda: Ommastrephidae)[J]. The Veliger, 38(3): 185–191.
SÁNCHEZ-VELASCO L, RUVALCABA-AROCHE E D, BEIER E, et al, 2016. Paralarvae of the complex-(Cephalopoda: Ommastrephidae) in the northern limit of the shallow oxygen minimum zone of the Eastern Tropical Pacific Ocean (April 2012)[J].Journal of Geophysical Research: Oceans, 121(3), 1998–2015.
SEIBEL B A, THUESEN E V, CHILDRESS J J, et al, 1997. Decline in pelagic cephalopod metabolism with habitat depth reflects differences in locomotory efficiency[J]. Biological Bulletin, 192(2): 262–278.
SEIBEL B A, THUESEN E V, CHILDRESS J J, 2000. Light-limitation on predator-prey interactions: consequences for metabolism and locomotion of deep-sea cephalopods[J]. Biological Bulletin, 198(2): 284–298.
STAAF D J, REDFERN J V, GILLY W F, et al, 2013. Distribution of ommastrephid paralarvae in the eastern tropical Pacific[J]. Fishery Bulletin, 111(1): 78–89.
STEARNS S C, 1992. The evolution of life histories[M]. Oxford: Oxford University Press: 1–50.
STEVENSON R D, WOODS W A JR, 2006. Condition indices for conservation: new uses for evolving tools[J]. Integrative & Comparative Biology, 46(6): 1169–1190.
TAKAGI K, KITAHARA T, SUZUKI N, et al, 2002. The age and growth of(Cephalopoda: Ommastrephidae) in the Pacific Ocean[J]. Bulletin of Marine Science, 71(2): 1105–1108.
VILLEGAS-RÍOS D, ALONSO-FERNÁNDEZ A, DOMÍNGUEZ- PETIT R, et al, 2014. Energy allocation and reproductive investment in a temperate protogynous hermaphrodite, the ballan wrasse[J]. Journal of Sea Research, 86: 76–85.
WELLS M J, CLARKE A, 1996. Energetics: The costs of living and reproducing for an individual cephalopod[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 351(1343): 1083–1104.
Energy accumulation and allocation of somatic and reproductive tissues in medium form of malein the South China Sea
ZHU Kai1, ZHANG Lichuan1, CHEN Xinjun1,2,3,4, YAO Jixiang1, HAN Fei1, LIN Dongming1,2,3,4
1. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China; 2. Key Laboratory of Sustainable Exploitation of Oceanic Fishery Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China; 3. National Distant-water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China; 4. Collaborative Innovation Center for Distant-water Fisheries, Shanghai 201306, China
The energy accumulation and allocation of somatic and reproductive tissues in the medium form of malewere were analyzed by using the technology of energy density determination combined with residual analysis. The results showed that the energy density of mantle, fins, arms, spermatophoric complex, and testis were 21.16±1.44, 21.98±1.51, 21.44±1.50, 20.83±1.70, and 21.41±1.70kJ·g–1, respectively. The energy density for tissue of mantle or spermatophoric complex varied significantly depending on sexual maturity stages, while there were no significant differences between sexual maturity stages for the tissue of fins, arms, or testis. The total energy accumulation for each individual was estimated at 299.31±90.81 kJ, and showed an increasing trend with body size growth. With regards to relative energy accumulation, the somatic tissues, including mantle, fins and arms, accounted for 95.31%~98.04% of the total energy accumulation, but decreased with maturation. The relative energy accumulation in reproductive tissues, being testis and spermatophoric complex, accounted for 1.96%~4.96% of the total energy accumulation, and increased with maturation, in which the maximum value was reached at stage V. The analysis of residuals of relationship between tissue absolute energy accumulation and mantle length, using Model II regression, showed a significantly positive correlation between somatic and gonadal tissues. This evidence suggests that there was no energy remobilization of somatic tissues to fuel reproduction during sexual maturation, and the mode of reproductive investment is more likely to be income breeding in the medium form of male. In this study, we preliminary established the progress of energy accumulation and its allocation in soma and reproductive organs for medium form of malein the South China Sea. These findings should assist future research on its reproductive strategy, as well as sustainable utilizationof this kind of resource in the area.
; male; reproductive strategy; energy investment; South China Sea
date: 2018-10-01;
date: 2019-02-22.
National Natural Science Foundation of China (NSFC41876144, 41276156); National High TechnologyResearch and Development Program (863 Program) (2012AA092303); Natural Science Foundation of Shanghai (16ZR1415400); Shanghai Ocean University College Students' innovation training program (B1-5002-17-0001-2)
LIN Dongming. E-mail: dmlin@shou.edu.cn
P735
A
1009-5470(2019)04-0041-11
10.11978/2018100
http://www.jto.ac.cn
2018-10-01;
2019-02-22。
孙淑杰编辑
国家自然科学基金(NSFC41276156); 国家“八六三”高技术研究发展计划(2012AA092303); 上海市自然科学基金(16ZR1415400); 上海海洋大学大学生创新活动计划项目(B1-5002-17-0001-2)
朱凯(1991—), 男, 博士研究生, 主要从事头足类繁殖生物学研究。E-mail:zhukaild@126.com
林东明, 主要从事头足类繁殖生物学研究。E-mail: dmlin@shou.edu.cn
Editor: SUN Shujie

