微小RNA-16-5p通过调控AKT3抑制肝癌细胞增殖和迁移*
刘晓龙, 张雅敏△, 许洋
天津市第一中心医院移植中心 1肝胆外科; 2肾移植科(天津 300192); 2天津医科大学一中心临床学院(天津 300000)
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的癌症之一,是世界范围内癌症相关死亡的第三大原因,由于复发和转移而预后较差[1]。虽然过去几十年来HCC的治疗取得了很大进展,但5年生存率仍然很低[2]。因此,研究HCC的分子机制可能为肝癌治疗提供新的靶点。miRNA是小的非编码RNA,其通过结合靶mRNA的3′非翻译区(3′-UTR)来抑制翻译或诱导mRNA降解来调节蛋白质编码基因的表达[3]。研究表明,miRNA的失调参与了多种癌症的发病和进展,如HCC、结直肠癌、乳腺癌、宫颈癌、卵巢癌和非小细胞肺癌[4]。miRNA在肝癌的生物学过程中起重要作用,可以通过多种机制调控肝癌细胞增殖、转移和新生血管生成[5]。多组研究发现,miR-16-5p在乳腺癌、肝癌、软骨肉瘤等多种恶性肿瘤的细胞增殖和转移过程中发挥重要作用[6-8]。miR-16-5p可通过多种调控通路发挥促癌和抑癌的作用[9]。丝氨酸苏氨酸蛋白激酶3(AKT3)与细胞生长、分化、增殖、凋亡等息息相关,是多种肿瘤细胞发生、增殖及侵袭转移过程的重要调节因子[10]。而在当前的研究中,对于miR-16-5p调控AKT3在肝细胞癌中的作用的研究较少,2017年6月至2018年6月,本研究通过在人肝癌组织和肝癌细胞中进行实验研究,我们发现在肝癌细胞中AKT3为miR-16-5p的直接调控靶点,miR-16-5p能靶向调控AKT3,进而抑制肝癌细胞增殖、侵袭和转移。
1 材料与方法
1.1 材料 人肝癌标本和癌旁正常肝组织(38例,37~72岁,男28例,女10例),取材于天津市第一中心医院肝胆外科。血清于美国Gbico公司采购。SMMC-7721肝癌细胞系于上海中科院细胞库采购。qRT-PCR试剂盒购于美国Bio-Rad公司。兔抗鼠AKT3、N-Cadherin、Snail、Vimentin和GAPDH抗体,以及羊抗兔辣根过氧化物酶标记二抗购于英国Abcam公司。miR-16-5p mimic和AKT3干扰RNA购于广州锐博公司。CCK-8试剂盒购于日本同仁公司。Transwell小室购于德国BD公司。
1.2 实验分组 病理组织分为肝癌组织组和癌旁正常肝组织组,肝癌组织又分为miR-16-5p(H)(miR-16-5p高表达组)和miR-16-5p(L)(miR-16-5p低表达组);将SMMC-7721肝癌细胞分为3组,分别为NC组(空白对照)、mimic组(转染miR-16-5p激动剂mimic)和mimic+SiRNA组(转染miR-16-5p mimic后转染SiRNA AKT3以敲除AKT3)。
1.3 qRT-PCR测定正常肝和肝癌组织中miR-16-5p含量 对正常和肝癌组织经过Trizol法提总RNA、反转录为cDNA、加入特定的前后引物,经变性、退火、延伸后,对结果使用比较阈值法进行定量分析,其计算方法是:目的基因定量拷贝数=2-ΔΔCt,ΔCt对照组=Ct目的基因-Ct内参,ΔΔCt=ΔCt实验组-ΔCt对照组,对每一分组计算目的基因拷贝数。
1.4 免疫组化染色 肝癌组织脱水后包埋蜡块,切片,常规二甲苯、梯度酒精脱水,H2O2去除内源性过氧化物酶,5%山羊血清封闭1 h,敷一抗4℃冰箱湿盒过夜,敷二抗,DAB显色,苏木染色,封片后显微镜下观察。细胞免疫组化同组织一样进行脱水、去除内源性过氧化物酶、封闭、敷一抗、敷二抗、DAB显色、苏木染色,显微镜下观察,每张切片随机取10个高倍视野,观察并计算阳性细胞比例。
1.5 细胞转染 SMMC-7721肝癌细胞复苏后置于5%培养箱常规培养至细胞密度为70%左右。在6孔板每孔加入10 μL/孔的转染试剂Lipo2000分别与miRNA和siRNA进行整合,然后加入到6孔板中。转染后的细胞继续于37℃、5%CO2培养箱中培养。4~6 h后更换10%新鲜培养基继续培养48 h。
1.6 平板克隆实验检测细胞增殖能力 肝癌细胞培养至密度为80%左右时,胰酶消化、重悬,细胞计数后加入6孔板。培养2周,当有肉眼可见明显的细胞集落时终止培养, 0.5%结晶紫染色后计数每孔的克隆数。
1.7 Transwell实验检测肝癌侵袭和迁移能力 细胞密度培养至80%左右时,消化、重悬,加入到24孔板中。将Transwell小室(分为加Matrigel胶和不加Matrigel胶)放入24孔板内,小室内加入细胞悬液。CO2培养箱中常规培养24~48 h后弃去培养基,取出小室,用0.1%结晶紫染液室温染色,显微镜下观察细胞并计数。
1.8 CCK-8试剂盒检测细胞活力 用CCK-8试剂盒分别检测各组肝癌细胞在0、30、60、90和120 h的活性细胞数量。
1.9 Western blot实验检测蛋白表达情况 各组细胞加入裂解液、取上清,BCA法蛋白定量,蛋白变性后每组取50 μg/孔行凝胶电泳,转至PVDF膜,5%脱脂奶粉室温封闭1 h,敷一抗(兔抗鼠AKT3、N-cadherin、Snail、Vimentin、ZO-1与GAPDH,1∶1 000),4℃摇床过夜,TBST洗3遍后室温下敷羊抗兔辣根过氧化物酶标记二抗(1∶5 000)1 h,均匀加入发光液与PVDF膜反应后曝光,条带使用Image J软件检测灰度值。
1.10 统计学方法 使用SPSS 22.0统计软件,进行t检验、2检验和单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-16-5p与AKT3基因相关性 Targetscan预测显示miR-16-5p(3′-GCGGUUAUAAAUGCACGACGAU-5′)与AKT3(5′-AGGUCUCAUGCUGUUGCUGCUA-3′)部分片段能碱基互补配对,说明具有高度相关性。见图1。
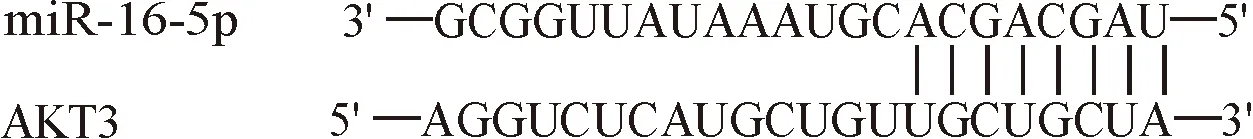
图1 Targetscan预测miR-16-5p与AKT3基因相关性
2.2 miR-16-5p在人肝癌组织中低表达 利用qRT-PCR检测肝癌组织和癌旁正常肝组织中miR-16-5p和AKT3表达量发现:在人肝癌组织(6.45±0.68)中miR-16-5p低表达,而在癌旁正常肝组织(11.48±0.61)中高表达,差异有统计学意义(t=5.496,P<0.05);AKT3在肝癌组织(13.67±0.71)中表达量高,而在癌旁正常肝组织(8.01±0.48)中表达量低,差异有统计学意义(t=6.602,P<0.05);miR-16-5p与AKT3在肝癌组织中表达情况高度负性相关(r=-0.903 8,P<0.05)。见图2-A、B、C。对miR-16-5p高表达和低表达肝癌组织进行免疫组化检测AKT3表达情况可见:miR-16-5p高表达肝癌组织中AKT3表达量低,而miR-16-5p低表达肝癌组织中AKT3表达量高。见图2-D、E。
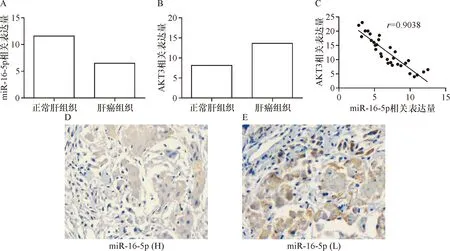
A: miR-16-5p在肝癌组织和正常肝组织中含量;B:AKT3在肝癌组织和正常肝组织中含量;C: miR-16-5p和AKT3之间的相关性;D:免疫组化染色检测miR-16-5p高表达肝癌组织中AKT3表达分布情况(×200);E:免疫组化染色检测miR-16-5p低表达肝癌组织中AKT3表达分布情况(×200)
2.3 miR-16-5p负性调控AKT3 qRT-PCR检测显示mimic组(10.92±0.48)miR-16-5p含量较NC组(4.76±0.49)明显升高,差异有统计学意义(t=8.837,P<0.05);而对于AKT3表达量,mimic组(4.49±0.56)较NC组(8.41±0.60)明显降低,差异有统计学意义(t=4.738,P<0.05)。免疫组化染色结果显示mimic组(0.288±0.027)AKT3表达量较NC组(0.848±0.025)明显降低,差异有统计学意义(t=124.7,P<0.05)。见图3-C。Western blot检测显示AKT3蛋白表达量mimic组(0.40±0.03)较NC组(0.63±0.07)明显降低,差异有统计学意义(t=12.16,P<0.05)。见图3-D。说明miR-16-5p通过负向调控AKT3在肝癌细胞中产生作用。
2.4 miR-16-5p过表达能抑制肝癌细胞侵袭和迁移,抑制肿瘤转移相关蛋白的表达 Transwell结果发现:mimic组(140.5±5.99)使miR-16-5p过表达后可使肝癌细胞的侵袭能力较NC组(191.2±7.79)降低,差异均有统计学意义(t=5.16,P<0.05)(见图4-A、B);mimic组(154.2±7.53)肝癌细胞迁移能力较NC组(264.8±7.04)降低,差异均有统计学意义(t=10.72,P<0.05)。见图4-C、D,说明miR-16-5p过表达可抑制肝癌细胞侵袭和迁移。Western blot结果显示mimic组肿瘤转移相关蛋白表达量较NC组降低,差异有统计学意义(P<0.05)。见图5、表1。
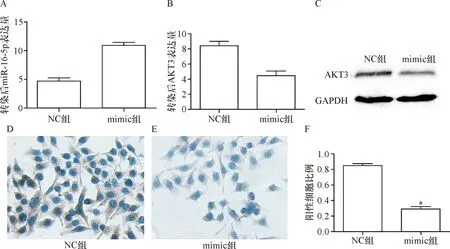
A:qRT-PCR检测细胞转染后miR-16-5p含量;B:qRT-PCR检测细胞转染后AKT3含量;C:Western blot检测AKT3蛋白表达量;D:免疫组化染色检测NC组细胞内AKT3表达分布情况;E:免疫组化染色检测mimic组细胞内AKT3表达分布情况;F:统计分析NC组和mimic组AKT3表达阳性细胞比例
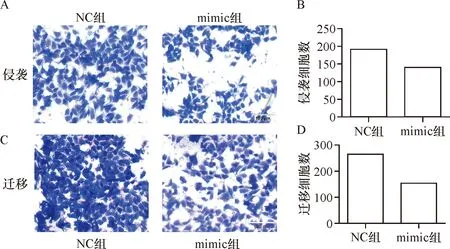
A:Transwell检测肝癌细胞侵袭变化情况;B:肝癌细胞侵袭细胞计数; C:Transwell检测肝癌细胞迁移变化情况;D:肝癌细胞迁移细胞计数
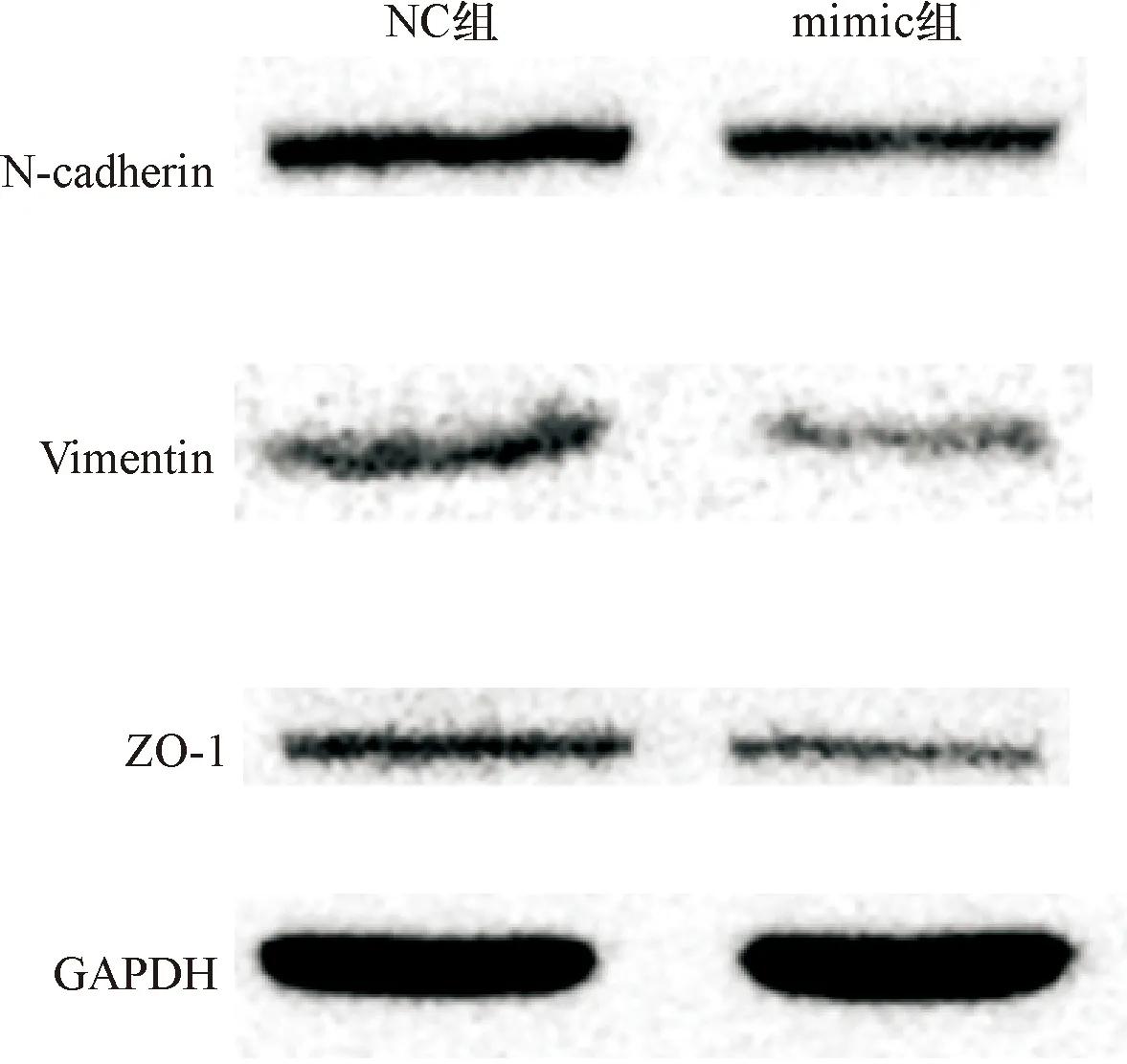
图5 Western blot检测侵袭转移相关蛋白表达情况
表1 Western blot检测侵袭转移相关蛋白表达情况(条带灰度值检测结果)
2.5 miR-16-5p通过靶向调控AKT3抑制肝癌细胞增殖和迁移 平板克隆实验显示mimic组(291.9±8.76)较NC组(481.2±8.32)肝癌细胞增殖能力降低,差异有统计学意义(t=15.66,P<0.05);mimic+siRNA组(65.6±6.10)较mimic组降低,差异均有统计学意义(t=21.18,P<0.05);mimic+siRNA组(65.6±6.10)较NC组降低,差异均有统计学意义(t=40.25,P<0.05)。CCK-8检测显示mimic组较NC组肝癌细胞活性降低(F=205.0,P<0.05),mimic+siRNA组较mimic组和NC组均明显降低(F=152.9,F=76.8,P<0.05)。Western blot检测显示mimic组较NC组肿瘤转移相关蛋白N-Cadherin和Snail表达量较低,mimic+siRNA组N-Cadherin和Snail表达量较mimic组和NC组均明显降低,差异有统计学意义(P<0.05)。见图6-D、表2。说明miR-16-5p通过靶向调控AKT3抑制肝癌细胞的增殖、侵袭和迁移能力。见图6。
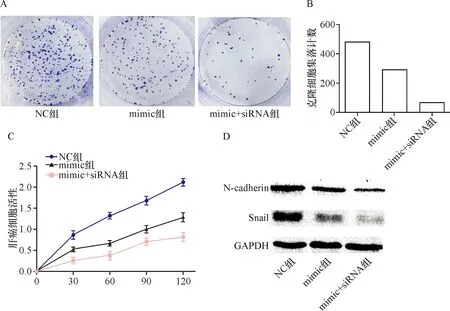
A:平板克隆实验检测肝癌细胞增殖能力;B:平板克隆细胞集落计数(个/孔);C:CCK-8检测肝癌细胞活性变化;D:Western blot检测肿瘤转移相关蛋白表达情况
表2 Western blot检测肿瘤转移相关蛋白表达情况(条带灰度值检测结果)
3 讨论
肝癌是常见的消化系统恶性肿瘤之一,在全球肝癌每年的发病人数超过5 000万,尽管目前医学上对肝癌的研究比较成熟,但肝癌患者5年生存率只有5%~9%[11]。近些年研究发现miRNA是重要的抑癌因子,尤其在调节肝癌细胞增殖、分化、侵袭、转移和凋亡等方面具有重要作用[12]。在本次研究中,我们发现miR-16-5p在肝癌组织中明显下调。越来越多的研究发现miR-16-5p特别是miR-16家族在多种类型的肿瘤组织中表达下调,如胃癌[13]、乳腺癌[14]和宫颈癌[15]。我们通过实验发现,miR-16-5p在肝癌组织中具有与其他类型癌症类似的下调表达谱。
本实验中我们发现miR-16-5p过表达可通过降低肝癌细胞增殖、侵袭和转移以产生抗癌作用。Zhang等[13]研究发现miR-16-5p和miR-19b-3p在胃癌组织中下调,两种miRNA在血浆中的含量能够诊断胃癌,并且能对不同TNM分期和分化程度进行鉴别,尤其适用于早期胃癌。Liang等[14]报道了在乳腺癌、肺癌和肝癌细胞中,miR-16通过FEAT靶向调控以促进癌细胞凋亡。Zubillaga-Guerrero等[15]通过研究发现miR-16-1在宫颈癌细胞中能通过靶向调控CCNE1进而影响细胞周期,最终干预宫颈癌的疾病过程。本研究中,我们通过细胞转染促进miR-16-5p过表达,Transwell实验检测发现miR-16-5p过表达可降低肝癌细胞SMMC-7721的侵袭性和迁移性,但其具体调控方式仍需探索。
在本研究中,我们发现miR-16-5p能靶向调控AKT3产生抑癌作用。研究发现,AKT3在多种类型癌症中参与调控作用。Chin等[16]报道了AKT3表达下调能通过p27对三阴乳腺癌的细胞周期产生抑制作用,靶向下调AKT3及其下游信号可能是抑制三阴乳腺癌生长的有效方法。Joy等[17]研究发现AKT3能延缓恶性胶质瘤细胞的增殖、分化,延缓肿瘤进展。Kim等[18]通过对人膀胱癌细胞和肺癌细胞中AKT进行特异性敲除,探讨了AKT在线粒体功能调节中的作用,发现AKT1和AKT3的敲除诱导了人膀胱癌细胞线粒体的显着增加,AKT3敲除导致最严重的线粒体功能障碍,这表明不同的AKT3在维持人类癌细胞中线粒体功能方面发挥重要作用。在本研究中,我们通过使用特定的干扰RNA敲除AKT3,发现敲除AKT3后肝癌细胞活性、增殖能力明显降低,肿瘤转移相关标记蛋白N-Cadherin和Snail表达降低,说明抑制AKT3表达增强肝癌细胞的抑癌作用。
研究发现多种miRNA参与调控AKT3产生抗肿瘤作用。Yang等[19]报道了miR-424直接靶向调控AKT3和E2F3进而抑制细胞周期和E2F通路,最终抑制肝癌细胞生长。有研究发现miR-144与AKT3的3′-UTR结合,肝癌细胞中miR-144的过度表达降低AKT3表达水平,导致肝癌细胞增殖、侵袭 和迁移受到抑制,说明AKT3的异位过表达能够减弱由miR-144过表达诱导的肿瘤抑制特征,表明miR-144通过靶向调控AKT3介导在肝癌中的抗肿瘤作用[20]。在本研究中,我们发现miR-16-5p能够特异性调控AKT3,抑制肝癌细胞增殖活性、侵袭和迁移能力。miR-16-5p靶向调控AKT3产生的抑癌作用为临床诊断、评估和治疗肝癌提供了新思路。

