血清NE、AngⅡ、ALD和慢性心力衰竭并发肺部感染患者心脏功能的相关性研究
刘镇 丁辉
(西安市第三医院心血管内科,陕西 西安 710016)
心力衰竭(heart failure)简称心衰,是指由于心脏的收缩功能和(或)舒张功能发生障碍,不能将静脉回心血量充分排出心脏,导致静脉系统血液淤积,动脉系统血液灌注不足,从而引起心脏循环障碍症候群,此种障碍症候群集中表现为肺淤血、腔静脉淤血。心力衰竭并不是一个独立的疾病,而是心脏疾病发展的终末阶段。心力衰竭是造成老年人死亡的最为常见病因之一,临床上主要表现为呼吸受限、心悸、乏力、水钠潴留[1-2]。心力衰竭分为急性心力衰竭(Acute Heart Failure, AHF)和慢性心力衰竭(Chronic Heart Failure, CHF),CHF的主要特点是呼吸困难、水肿、乏力。我国CHF发病率呈现出北方高于南方、城市高于农村、女性高于男性的特点[3-4],且发病率随着年龄的增加而迅速升高。CHF总体预后较差,1年病死率超过50%,5年病死率超过66%,10年病死率高达90%[5-7]。选取合适的指标对慢性心力衰竭并发肺部感染患者病情变化进行有效评估具有重要的临床意义。本研究分析了肺部感染对CHF患者肾素—血管紧张素—醛固酮(RAS)系统、相关炎症因子以及心功能的影响,寻找与疾病病情明显相关的指标,为CHF病情诊断评估提供依据。
1 资料与方法
1.1研究对象 选取2016年7月至2018年7月间,我院心血管内科诊治的慢性心力衰竭并发感染患者39例作为A组,同时段内慢性心力衰竭无感染患者39例作为B组。纳入标准:(1)符合CHF相关诊断标准[8];(2)年龄<80岁;(3)无其他严重器质性疾病。排除标准:(1)存在感染性疾病;(2)精神障碍,意识不清;(3)患有自身免疫性疾病;(4)急性心肌梗死发作。另取体检中心中老年健康体检者39例作为C组,已明确无冠心病、心力衰竭、高血压、糖尿病、高血脂等基础疾病。
1.2标本采集及检测 患者及健康志愿者入院后当天清晨采集空腹静脉血4 mL,3 000 rpm低温离心10 min收集血清,立即进行相关指标检测。NE、AngⅡ、ALD采用酶联免疫吸附(ELISA)法测定,试剂盒购自上海金穗生物科技有限公司;BNP采用CHEMCLIN1500型全自动化学发光免疫分析仪(北京科美生物技术有限公司)检测;IL-6采用Smartchem 600型全自动生化分析仪(北京理加联合科技有限公司);TNF-α采用放射免疫法检测;LVEF、LVEDD采用飞利浦EPIQ7型彩色超声多普勒仪进行测定。
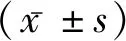
2 结 果
2.1三组一般资料比较 三组性别比例、平均年龄、病程、BMI、合并基础疾病以及心功能NYHA分级等一般资料比较,无明显差异(P>0.05)。见表1。
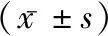
表1 三组患者一般资料比较
2.2三组血清NE、AngⅡ、ALD水平比较 A组血清NE、AngⅡ、ALD水平均显著高于B组和C组(P<0.05),B组以上指标则明显高于C组(P<0.05)。见表2。
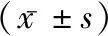
表2 三组血清NE、AngⅡ、ALD水平比较
注:与A组相比,*P<0.05;与B组相比,#P<0.05。
2.3三组炎症因子和心室功能水平比较 A组血清BNP、IL-6、TNF-α、LVEDD指标明显高于B组和C组,而LVEF指标明显低于B组和C组(P<0.05),B组BNP、IL-6、TNF-α、LVEDD指标明显高于C组,而LVEF指标明显低于C组(P<0.05)。见表3。
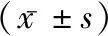
表3 三组炎症因子和心室功能水平比较
注:与A组相比,*P<0.05;与B组相比,#P<0.05。
2.4A组不同心功能分级患者血清NE、AngⅡ、ALD水平比较 心功能NYHA分级Ⅳ级患者血清NE、AngⅡ、ALD水平明显高于Ⅲ级和Ⅱ级患者(P<0.05),而Ⅲ级患者以上指标均明显高于Ⅱ级患者(P<0.05);相关性分析显示A组患者血清NE、AngⅡ、ALD水平与NYHA分级呈正相关(r1=0.73,r2=0.69,r3=0.71,P<0.05)。见表4。
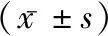
表4 A组不同心功能分级患者血清NE、AngⅡ、ALD水平比较
注:与Ⅱ级相比,*P<0.05;与Ⅲ级相比,#P<0.05。
3 讨 论
心力衰竭是多种心脏疾病的终末期失代偿阶段,由于心室肥厚和后负荷增加,引起心室充盈或射血能力受损,造成心脑肾等重要脏器血流灌注不足,最终导致患者死亡[9-10]。全球每年新发病例超过200万,而患者5年生存率仅与癌症相当[11]。CHF患者心肌收缩力明显下降,射血能力降低,左室舒张受限,造成肺部严重淤血,且患者周围循环不良,长期处于营养不良和免疫功能低下状态,容易合并肺部感染[12]。部分致病菌分泌细菌内毒素会直接损伤心肌细胞,炎症因子使得肺部毛细血管通透性增加,降低氧气交换效率,致使心肌缺氧受损,肺部感染会加重心力衰竭的症状,是心力衰竭急性加重的诱因。肺部感染可增加机体的代谢率,从而提高心肌耗氧量而加重心脏的负荷,同时由于炎症所致的支气管黏膜分泌增多、支气管痉挛及支气管壁炎性改变都能影响气体交换,造成低氧血症,增加肺动脉压,使右心负荷加重。因此CHF与肺部感染相互促进,互为因果,形成恶性循环。
目前关于CHF的病理机制研究较多,有学者提出心室重构机制、神经内分泌紊乱机制、Frank-Starling机制以及能量饥饿机制等等。现已明确神经内分泌长期激活导致心室重塑是充血性心力衰竭的根本原因[16]。RAS系统由NE、ACE组成,最终通过血管紧张素(Ang)发挥作用,Ang Ⅱ是RAS系统最主要的效应分子,既有系统激素(内分泌)作用,又有局部产生因子(旁分泌、自分泌)作用。Ang Ⅱ是目前已知的最强有力的缩血管物质之一,可直接作用于血管平滑肌AT1受体,收缩周围血管,增加心脏后负荷。Ang Ⅱ作用于心肌、肾上腺AT1受体时还会刺激心肌细胞增生产生正性变时变力效应、刺激交感神经分泌儿茶酚胺和血管加压素释放、刺激醛固酮分泌、减少水钠排泄[17]。Ang Ⅱ还可直接作用于心肌细胞核或结合染色体,促进mRNA转录和蛋白合成,致使心肌细胞生长,发生心肌肥厚[18]。RAS系统以上生理功能共同加重了心衰的发生发展,另外炎性应激与血清中NE、AngⅡ、ALD等水平有密切关系[19]。因此,本研究结果显示,心衰患者NE、AngⅡ、ALD等指标明显高于健康人,而心衰合并肺部感染患者NE、AngⅡ、ALD等指标明显高于单纯心衰患者。相关性分析显示A组患者血清NE、AngⅡ、ALD水平与NYHA分级呈正相关,印证了NE、AngⅡ、ALD与心衰病情进展的密切关系。
金卫东等[20]曾报道,心力衰竭合并肺部感染患者BNP、IL-6、TNF-α等炎性指标会明显升高并且影响患者预后[21],本研究结果与之相似。BNP由心室细胞分泌,具有扩管、排钠、排水的效应,能够拮抗RAS系统。心衰患者由于心肌缺血和后负荷过重,反射性引起BNP分泌增加,当合并感染时,肺部缺血、缺氧加重心脏负担,BNP水平进一步升高[22]。TNF-α可损伤血管内皮功能,介导大量炎性因子释放,损伤心肌细胞并激活RAS系统,有报道TNF-α水平与心衰病死率明显相关[23-25]。本研究中,心衰患者TNF-α水平较健康受试者明显增高,提示患者体内存在较为强烈的炎症反应[26-27],而心衰合并肺部感染患者TNF-α达到(31.25±4.89) ng/L,可能是由于细菌内毒素刺激产生所致。IL-6是主要的炎症因子,当机体存在炎症时其表达明显升高,虽然具体机制尚不清楚,但有报道可能与交感神经兴奋性增加有关[28]。本研究中,心衰合并肺部感染患者LVEDD明显高于单纯心衰患者,而LVEF明显低于单纯心衰患者,提示肺部感染进一步加重了心衰病情,并影响到心脏功能。
综上所述,肺部感染引起慢性心力衰竭患者血清NE、AngⅡ、ALD明显升高,且和心功能分级呈正相关,另外会使患者炎症加重、心肌功能受损,监测这些指标有助于疾病诊断和病情评估。

