乙二胺四乙酸对食源性混合病原菌生物被膜的抑制作用
张钰皎,胡炜东,孙子羽,满都拉,黄海英,赵雪平,陈忠军,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018;2.内蒙古农业大学职业技术学院,内蒙古包头014109)
细菌生物被膜(biofilm)是菌体黏附于接触表面后,通过分泌大量多糖、蛋白质和核酸等胞外基质将自身包裹在其中而形成的微生物聚集物[1]。食源性病原菌可以黏附于食品接触表面生长繁殖而形成生物被膜,食源性病原菌生物被膜会对食品安全造成巨大隐患。在自然条件下,大多数生物被膜是由多种病原菌形成的混合病原菌生物被膜[2-3]。金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和沙门氏菌(Salmonella)在食品加工过程中极易联合作用而形成混合菌生物被膜[4]。混合病原菌生物被膜中的微生物相互交叉感染,导致微生物的多样性增加,进而使得其对外界的抵抗能力加强,更难以被抗生素等抑菌剂杀灭清除[5]。
乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)是一种具有强配位能力的有机螯合-络合剂,能和金属离子形成稳定的水溶性络合物[6]。乙二胺四乙酸及其金属盐被广泛应用于各个领域,在工业生产中EDTA 常被用作掩蔽剂以控制金属离子浓度并抑制催化反应;在医学卫生中EDTA 可与人体中放射性金属配位从而起到解毒作用;在食品加工中添加其金属盐不仅可以提高油脂的抗氧化能力,还能起到杀菌作用[7-9]。目前大多研究集中于乙二胺四乙酸及其金属盐对食源性病原菌单一生物被膜的抑制作用,对混合菌生物被膜的研究鲜少。
本文探究乙二胺四乙酸及其金属盐对食源性病原菌(金黄色葡萄球菌、大肠杆菌和沙门氏菌)形成的混合菌生物被膜的抑制作用,为有效控制食品加工环境中的混合菌生物被膜提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
大肠杆菌(Escherichia coli)ATCC 11775-3、金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003-3、沙门氏菌(Salmonella)ATCC 14028、哈维弧菌(V.harveyi BB170):中国普通微生物菌种保藏管理中心。
1.1.2 试剂
结晶紫、氯化钠、氯化钾、磷酸氢二钾、磷酸氢二钠、草酸铵、无水甲醇、33 %冰醋酸、无水乙醇(分析纯):上海国药集团化学试剂有限公司;胰蛋白胨大豆肉汤培养基(tryptone soy broth,TSB):北京陆桥生物技术有限公司;AB 培养基:0.3 mol NaCL,0.05 mol MgSO4,0.2%酸水解酪蛋白用KOH 调节pH7.5,121℃高压灭菌20 min,冷却后每100 mL 培养基中加入以下无菌物质:1 mL 1 mol 磷酸盐缓冲液(phosphate buffer saline,PBS),1 mL 0.1 mol 精氨酸和 2 mL 50%甘油。
1.2 仪器与设备
Synergy H1 全功能微孔板检测仪:美国伯腾仪器有限公司;LDZX 全自动高压灭菌锅:上海申安医疗器械厂;JY 系列电子天平:上海浦春计量仪器有限公司;SW-CJ-2DF 双人单面净化工作台:苏州安泰空气技术有限公司;GHP 隔水式恒温培养箱:上海一恒科学仪器有限公司;XH-C 漩涡混匀器:常州未来仪器制造有限公司;TM4000 plus 扫描电镜:日本株式会社日立高新技术那珂事业所。
1.3 方法
1.3.1 食源性病原菌生物被膜的制备
将活化后的大肠杆菌、金黄色葡萄球菌和沙门氏菌分别接种于TSB 培养基中,于恒温振荡培养箱(37 ℃、120 r/min)培养过夜,将菌悬液稀释至OD600nm=0.1(约为1.5×108cfu/mL)备用。将上述稀释的金黄色葡萄球菌、大肠杆菌和沙门氏菌菌悬液 1 ∶1 ∶1(体积比)混合后,以体积比1%的接种量分别接种于事先装有200 μL TSB 培养基的 96 孔微量板中,37 ℃下培养 24 h 后,微孔板检测仪测其630 nm 下的光密度值A1,空白对照记为A1C。空白对照组只加TSB 培养基,且试验组及对照组均进行3 次平行试验[10]。
1.3.2 结晶紫染色法测定生物被膜的黏附率(B 值)
将96 孔板中培养结束后的培养液弃去,并于每空中加入300 μL 的磷酸盐缓冲液冲洗,反复冲洗3 次以去除未黏附的浮游菌;然后于每孔中添加200 μL 无水甲醇固定15 min,弃去悬浮液后于60 ℃下干燥1 h;随后添加200 μL 的2%结晶紫染液染色20 min,蒸馏水冲洗孔壁至冲洗液无色;干燥后于每孔中添加300 μL的33%冰醋酸静置10 min;微孔板检测仪震荡10 min后测定A2和A2c[11]。生物被膜黏附率(B 值)的计算公式为:

式中:A1、A2为培养和染色后的光密度值;A1c、A2c为空白对照的光密度值。
1.3.3 EDTA 对混合菌生物被膜形成的影响
1.3.3.1 EDTA 浓度对混合菌生物被膜形成的影响
采用二倍稀释法配制不同浓度的乙二胺四乙酸溶液,将其加入到TSB 培养基中使其最终质量浓度为0、0.25、0.5、1、2 mmol/L[12]。96 微量孔板中每孔加入200 uL 含不同EDTA 质量浓度的TSB 培养基,以1%的接种量加入食源性混合菌菌悬液(金黄色葡萄球菌-大肠杆菌-沙门氏菌)后于37 ℃下培养24 后测其黏附率,平行试验3 次,并以不同浓度EDTA 对3 种食源性病原菌单独形成生物被膜的抑制作用进行对比。
1.3.3.2 EDTA 加入时间对混合菌生物被膜形成的影响
96 孔板接种混合菌菌悬液后分别于37 ℃下培养 4、8、12、16、20、24、28、32、36、40、44、48 h 时加入0.25 mmol/L 的EDTA,并以未加EDTA 的不同时间段黏附率作对比,绘制未含EDTA 和含EDTA 的混合菌生物被膜的生长曲线[13]。
1.3.3.3 二价阳离子对混合菌生物被膜形成的影响
在含有 0.25 mmol/L EDTA 的 TSB 中加入 Mg2+、Ca2+、Fe2+,接种1%的混合菌菌悬液并于37 ℃下培养24 h 后测其生物被膜黏附率[14]。
1.3.3.4 不同浓度EDTA 对混合菌AI-2 活性的影响
V.harveyi BB170 活化后于 30 ℃、200 r/min 培养过夜,将菌悬液稀释至OD630nm=0.4 后用新鲜AB 培养基稀释5 000 倍备用。混合菌菌悬液接种于含0、0.25、0.5、1、2 mmol/L EDTA 的 TSB 培养基中 37 ℃下培养24 h 后,于13 000 r/min 下离心5 min 后取其上清液。上清液经0.22 μm 滤膜过滤后,取20 μL 过滤后的上清液加入事先装有200 μLTSB 培养基的96 孔微量板中,并取20 μL TSB 培养基加入事先装有200 μLTSB培养基的96 孔微量板中作为对照。30 ℃、120 r/min 恒温培养,Synergy H1 全功能微孔板检测仪每1 h 测一次发光值,直至5 h,试验结果以相对活性强度表示[15]。
1.3.3.5 扫描电镜观察EDTA 对混合菌生物被膜形成的影响
将经无水乙醇浸泡过夜的0.5 cm×0.5 cm 的铁片灭菌后放于含有 0、0.25、0.5、1、2 mmol/L EDTA 的 TSB培养基试管中,接种1%的混合菌菌悬液后37 ℃下连续培养5 d 后即可形成稳定的生物被膜。将培养后的铁片用镊子取出,用无菌PBS 漂洗以去除浮游菌,放于4 ℃预冷的2.5%戊二醛浸泡4 h 后,依次用50%、60%、70%、80%、90%的乙醇浸泡10 min,再用100%的乙醇中浸泡2 次,每次15 min。醋酸异戊酯置换2 次,每次15 min 后冷冻干燥,喷金后用扫描电镜观察[16]。
2 结果与分析
2.1 EDTA浓度对混合菌生物被膜形成的影响
不同浓度EDTA 对单一食源性病原菌生物被膜和混合菌生物被膜的抑制作用如图1 所示。

图1 EDTA 质量浓度对生物被膜黏附率的影响Fig.1 Effect of EDTA mass concentration on the adhesion rate of biofilm
由图1 可知,随EDTA 质量浓度的增加,金黄色葡萄球菌、大肠杆菌、沙门氏菌分别形成的单一菌生物被膜及混合菌生物被膜的黏附度均逐渐降低。未添加EDTA 时,混合菌的黏附度为0.038 9,当添加0.25 mmol/L 的EDTA 时,其黏附度下降了16.5%,当添加EDTA 的质量浓度逐渐增大时,黏附度下降虽有所减缓,但仍起到了抑制作用;未添加EDTA 时,金黄色葡萄球菌的黏附度为0.097 2、大肠杆菌为0.074 2、沙门氏菌为0.031 1,混合菌生物被膜的黏附度明显低于金黄色葡萄球菌和大肠杆菌单独形成生物被膜的黏附度,但高于沙门氏菌,这是因为在混合菌生物被膜中的三株菌互相存在着竞争作用,尤其是革兰氏阴性菌和革兰氏阳性菌间的竞争力较强,这导致了混合菌生物被膜的黏附度要低于单一菌;当添加不同质量浓度的EDTA 时,对金黄色葡萄球菌、大肠杆菌、沙门氏菌单独形成生物被膜的抑制率明显高于EDTA 对混合菌生物被膜的抑制率,因混合菌生物被膜中的菌种间的相互作用,使得其分泌的胞外多糖等物质复杂多样,从而增强了混合菌生物被膜的抵抗力。这符合Wang 等[17]研究发现,食源性病原菌肠道沙门氏菌(Salmonella enterica) 和血清型鼠伤寒沙门氏菌(Salmonella enterica serovar Typhimurium)形成的混合病原菌生物被膜比单菌株生物膜更具耐药性。
2.2 EDTA加入时间对混合菌生物被膜形成的影响
EDTA 加入时间对生物被膜黏附率的影响见图2。

图2 EDTA 加入时间对生物被膜黏附率的影响Fig.2 Effect of EDTA join time on the adhesion rate of biofilm
从图2 可看出,随着培养时间的增加,混合菌生物被膜的黏附度呈现先增加后减少的趋势,培养24 h 时黏附度高达0.038 6;当阶段性添加EDTA 后,混合菌黏附度同未含EDTA 时的趋势相同;4 h~28 h 间的各个阶段添加0.25 mmol/L EDTA 时,其明显低于未含EDTA 的黏附度,尤其在培养初期时,黏附度下降了53.5%;随着时间的增加,混合菌生物被膜的黏附度逐渐降低,在培养24 h 时黏附度下降率仅为15.3%;但在培养32 h~48 h 的各个阶段加入EDTA 后基本无抑菌作用。因与同种微生物的浮游状态相比,生物被膜的形成是十分复杂的,需历经4 个时期,即黏附期、发展期、成熟期和分离期[18]。当培养32 h 时生物被膜已基本处于成熟期,此阶段的生物被膜耐药性强,会对抗生素和宿主免疫系统产生更强的抵抗力[19-20]。
2.3 二价阳离子对混合菌生物被膜形成的影响
二价金属阳离子对生物被膜黏附率的影响见图3。
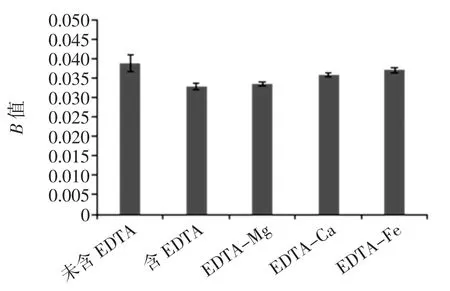
图3 二价金属阳离子对生物被膜黏附率的影响Fig.3 Effect of Divalent metal cation on the adhesion rate of biofilm
如图3 所示,在含EDTA 的培养基中分别添加了Mg2+、Ca2+、Fe2+后,EDTA-Mg、EDTA-Ca、EDTA-Fe 培养基中的混合菌生物被膜黏附度高于未含金属离子的,混合菌生物被膜的黏附度在EDTA-Mg 中的较在只含EDTA 培养基中的增加率为2.4%、EDTA-Ca 为8.1%、EDTA-Fe 为11.4%,说明EDTA 螯合不同二价金属离子对食源性混合菌生物被膜的形成起到了保护作用,且保护作用强度为Fe2+>Ca2+>Mg2+。Banin[21]等研究发现,特定的二价金属阳离子(浓度可完全饱和EDTA)会使得EDTA 具有较低的亲和力,且它们产生的静电作用有助于增强生物被膜的黏性,使得混合菌生物被膜具有较强稳定性。
2.4 不同浓度EDTA对混合菌AI-2活性的影响
添加不同质量浓度的EDTA 对混合菌释放群体感应信号分子AI-2 的影响如图4 所示。

图4 EDTA 质量浓度对AI-2 活性的影响Fig.4 Effect of EDTA mass concentration on AI-2 activity
V.harveyi BB170 的发光强度受到群体感应信号分子AI-2 的调控,细菌活性越强其释放的AI-2 信号分子的活性越强,则其发光值越大。由图4 可知,随着EDTA 质量浓度的增大,其AI-2 相对活性逐渐降低。当仅添加0.25 mmol/L 的EDTA 时,AI-2 相对活性已明显降低。此试验再次证明了EDTA 对混合菌生物被膜有抑制作用,推测其可能是通过减少细菌数量和菌体活性来达到抑制作用。
2.5 扫描电镜观察EDTA对混合菌生物被膜形成的影响
用扫描电镜观察在不同浓度EDTA 影响下混合菌生物被膜形态的变化,结果见图5~图9。

图5 EDTA 浓度 0 mmoL/L(×2 000)Fig.5 EDTA concentration 0 mmoL/L(×2 000)
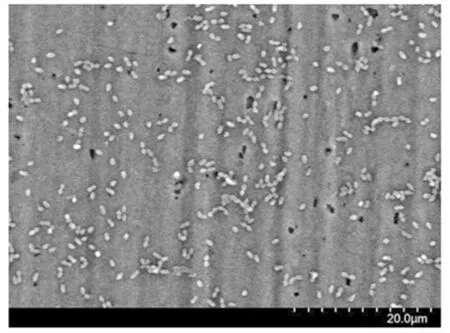
图6 EDTA 浓度 0.25 mmoL/L(×2 000)Fig.6 EDTA concentration 0.25 mmoL/L(×2 000)
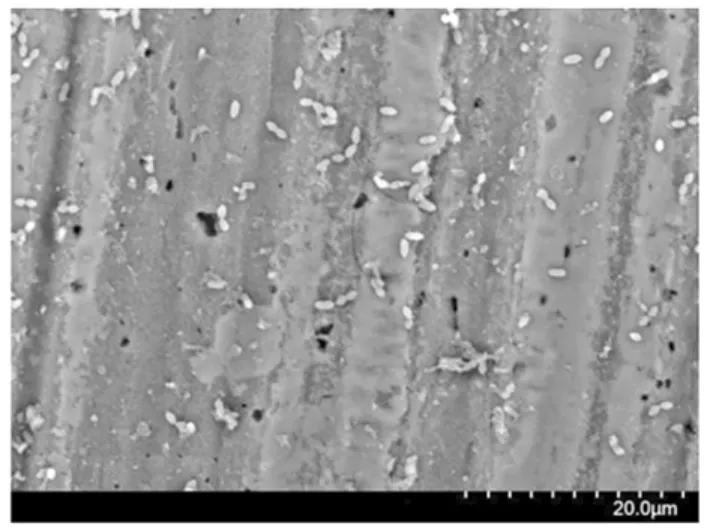
图7 EDTA 浓度 0.5 mmoL/L(×2 000)Fig.7 EDTA concentration 0.5 mmoL/L(×2 000)

图8 EDTA 浓度 1 mmoL/L(×2 000)Fig.8 EDTA concentration 1 mmoL/L(×2 000)

图9 EDTA 浓度 2 mmoL/L(×2 000)Fig.9 EDTA concentration 2 mmoL/L(×2 000)
如图5 所示,混合菌极易在小铁片表面黏附而形成紧密黏连的生物被膜,3 种病原菌通过分泌的胞外多糖及其它有机物质将自身及其余两种菌包裹后在铁片上形成大片紧密的生物被膜。在混合菌生物被膜中,金黄色葡萄球菌呈球状,大肠杆菌和沙门氏菌呈杆状,且球状菌体明显大于杆状菌体数量,这是因为在混合菌生物被膜中,金黄色葡萄球菌为优势菌,其生长过程中分泌的物质抑制了其它两株菌的生长。图6~9 体现了添加不同质量浓度的EDTA 后混合菌生物被膜的生长状态。从图可以看出添加0.25 mmol/L 的EDTA 培养5 d 后,其生物被膜已出现明显的脱落,菌体以单个状态分散,混合菌生物被膜已遭到明显破坏;添加0.5 mmol/L 的EDTA 后混合菌生物被膜不仅生物被膜遭到破坏,且分离出的单个菌数量已明显减少;添加1 mmol/L 的EDTA 后仅有微量浮游的单个病原菌;而添加2 mmol/L 的EDTA 后已看不见病原菌,铁片上仅剩细菌分泌的胞外多糖等物质。这进一步证实了EDTA 对混合菌生物被膜的形成有一定的抑制作用。
3 结论
本研究以96 孔微量板作为单一菌和混合菌生物被膜的黏附载体,通过结晶紫染色法测定了不同质量浓度的EDTA 及添加二价金属阳离子对混合菌生物被膜形成的影响,并通过群体感应信号分子活性的检测和扫描电镜形态的观察进一步证实了EDTA 对混合菌生物被膜形成的影响。结果表明,EDTA 对混合菌生物被膜有抑制作用,且随着EDTA 质量浓度的增加,混合菌生物被膜的黏附度逐渐降低;EDTA 仅对28 h(黏附期)前的混合菌生物被膜有抑制作用,当生物被膜处于32 h(成熟期)后再添加EDTA 时已基本无抑制作用;添加二价金属阳离子Mg2+、Ca2+、Fe2+后对混合菌生物被膜起到了稳定作用;AI-2 信号分子相对活性的检测和扫描电镜观察生物被膜的形态进一步证实了不同质量浓度的EDTA 对混合菌生物被膜有一定的抑制作用。
食品加工环境的不同,形成食源性病原菌生物被膜的结构也会不同,且目前国内外学者主要致力于研究EDTA 对单一菌种生物被膜的抑制作用,对混合菌生物被膜研究鲜少。因此,探究EDTA 对混合菌生物被膜的抑制作用对食品实际生产中防控混合菌生物被膜的污染具有重要意义。根据文献[22]可知,乙二胺四乙酸作为食品添加剂时的国家标准限量为0.075 g/kg,约为0.668 mmol/L,因试验证明在添加0.25 mmol/L 乙二胺四乙酸时对食源性混合菌生物被膜已有明显抑制作用,因此在食品实际生产中,可选用0.25 mmol/L~0.5 mmol/L 的添加量作为对混合菌生物被膜的抑制剂。

