原始森林高产纤维素酶刺器腐霉的筛选鉴定
何海燕,付跃,秦文芳,张玉兰,甘小富,覃拥灵,*
(1.河池学院化学与生物工程学院,广西宜州546300;2.微生物及植物资源开发利用广西高校重点实验室,广西宜州546300)
纤维素是植物纤维的主要成分,约占植物总干重的30%~50%[1],是分布最广的天然碳水化合物,也是地球上最丰富、最廉价的可再生资源。Z˙ywicka 等估计全世界每年通过光合作用产生的纤维素高达1.55×109吨,其中89%尚未被人类利用[2]。利用微生物生产的纤维素酶将其转化为人类急需的能源食物和化工原料,对人类社会的可持续发展具有非常重要的意义。纤维素酶在食品、饲料、纺织和洗涤等行业具有较大的应用潜力。Stevenson 研究认为筛选出产高活性纤维素酶的菌株是开发利用纤维素资源的前提和关键[3]。
本课题以原始森林腐烂木材下的土壤为原料,以羧甲基纤维素钠(carboxyl methyl cellulose,CMC-Na)为唯一碳源进行筛选,纯化并经过刚果红染色鉴定后,得到4 株产透明圈的菌株。对该菌株进行葡聚糖内切酶(endo-glucanase,CMCase)活性鉴定,完成高产纤维素酶菌种筛选鉴定研究,为纤维素酶进一步的研究工作奠定了基础。
1 材料与仪器
1.1 试剂
参照张炜炜方法配置pH 4.8 醋酸-醋酸钠缓冲液[4];3,5-二硝基水酸溶液:上海如吉生物科技发展有限公司;0.9%生理盐水:微生物及植物资源开发利用广西高校重点实验室配置;参照杜健配置3,5-二硝基水杨酸溶液(3,5-dinitrosalicylic acid,DNS)[5];参照陈玉方法配置1%CMC-Na[6],溶液称取0.625 g 羧甲基纤维素钠,加热溶解于pH4.8 醋酸-醋酸钠缓冲液并定容至100 mL。
样品:采自广西罗城小长安水上相思林原始森林腐木下,取腐烂木材地表下5 cm~15 cm,100 g,保鲜膜密封,4 ℃保存备用。
1.2 仪器与设备
BX51 显微镜:奥林巴斯(OLYMPUS)专业公司;GZX-GF101-2S 电热恒温鼓风干燥箱、SPX-150 生化培养箱:上海跃进医疗器械有限公司;UV-2802 紫外可见分光光度计:尤尼柯(上海)仪器有限公司;LDZX-5OFAS 立式压力蒸汽灭菌锅:上海申安医疗器械厂;xMark 酶标仪:BIO-RAD 公司;SW-CJ-2FD 型洁净工作台:苏州安泰空气技术有限公司;YHG-型摇床:上海欣蕊自动设备有限公司。
2 试验方法
2.1 培养基配置
参照Saritha 等的方法配置马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板和斜面培养基[7]:马铃薯200 g,葡萄糖 20 g,琼脂 15 g,蒸馏水 1 000 mL,pH7。
参照张静静方法配置CMC-Na 筛选培养基[8]:CMC-Na 5 g,牛肉浸膏1 g,蛋白胨1 g,MgSO40.5 g,KH2PO31 g,K2HPO31 g,琼脂 20 g,水 1 000 mL,pH7,121 ℃灭菌 20 min。
应用 Biochof 等的产酶培养基[9]:CMC-Na 5 g,酵母膏 2g,MgSO45g,水 1000mL,pH7。每个培养瓶 250mL。
2.2 样品处理
将原始森林腐烂木材下的土壤样品梯度稀释,各取10-4~10-63 个稀释度0.1 mL 涂布以CMC-Na 为唯一碳源的筛选平板,37 ℃倒置培养72 h,分离旺盛生长的菌株。
2.3 刚果红染色鉴定法
采用张炜炜刚果红染色鉴定法[10],将所分离的菌株活化后,点样接种于筛选培养基CMC-Na 平板并做好标记,倒置培养72 h,加入适量1 mg/mL 刚果红溶液,染色3 h 后弃去染液,加入适量1 mol/L NaCl 溶液脱色1 h。根据透明圈大小及透明圈菌落直径比选择产酶菌株。
2.4 接种和产酶培养
将平板上的单菌落挑起,在斜面培养基上划线纯化培养。每天观察,待菌种长后,用10 mL 生理盐水洗下制成孢子液或单细胞菌悬液(部分留作甘油种),取1 mL转入产酶液体培养基,30 ℃培养,100 r/min,培养3 d。
2.5 粗酶液的制备
应用何海燕等的粗酶液的制备方法[11],取1 mL 孢子悬液或单细胞菌悬液转入产酶液体培养基,30 ℃培养,100 r/min,培养3 d,将纤维素酶发酵液用6 层纱布过滤,4 000 r/min,离心10 min,上清液即为粗酶液。
2.6 纤维素酶酶活性检测
参照卢宪芹配制葡萄糖标准液[12]:将葡萄糖放在110 ℃烘箱中烘2 h 至恒重,称取0.108 g 葡萄糖,用蒸馏水溶解定容至100 mL 制成6 μmol/mL 的葡萄糖标准液。
取6 支洗净烘干的20 mL 具塞刻度试管,编号后分别加入 1 mg/mL 的葡萄糖标准溶液 0、0.2、0.4、0.6、0.8、1.0 mL,补加蒸馏水至总体积为2 mL,配制成一系列不同浓度的葡萄糖溶液。充分摇匀后,向各试管中加入2 mL DNS 溶液,摇匀后沸水浴5 min,取出冷至25 ℃后,用蒸馏水定容至20 mL,充分混匀。在540 nm波长下,以1 号试管溶液作为空白对照,调零点,测定其它各管溶液的光密度值并记录结果。以葡萄糖含量(mg)为横坐标,OD 值为纵坐标,绘制标准曲线。计测出其在540 nm 处的吸光度,得出还原糖的量。
参照宋嵘锡的羧甲基纤维素酶活力(CMCase)的测定方法[13]:取4 支洗干净烘干的试管,编号后,取1%的 CMC-Na 溶液 3.8 mL(CMC-Na 溶于 pH 值为 4.8 的醋酸缓冲液)作为底物,同时一号试管加入3.8 mL 蒸馏水作为空白对照组,50 ℃保温酶解反应30 min,加入经稀释10 倍的粗酶液0.2 mL,于50 ℃反应30 min,加入1 mL DNS,1 mL 2 mol/L NaOH,沸水浴10 min,冷却后加水稀释到25 mL,于540 nm 测定还原糖量。以1 号试管溶液为空白对照调零点,在540 nm 波长下测定2、3、4 号试管液的吸光度值并记录结果。根据3 个重复光密度的平均值,在标准曲线上查出对应的葡萄糖含量,计算出CMC 酶活力。
2.7 菌落形态观察
通过对平板生长菌落的形态、大小、颜色、菌丝及孢子的观察对菌落进行初步鉴定。
2.8 显微观察
参照高鸿健插片法[14]:用镊子把灭过菌的盖玻片斜插入涂布接种的PDA 平板培养基上,每块板插3片~5 片,培养3 d~5 d,可以在不同生长期小心取出盖玻片,在显微镜下观察菌丝、分生孢子梗、孢子的形态。
2.9 分子鉴定
菌体总DNA 的提取:新鲜培养的菌丝加入液氮,在研钵中充分研磨变成粉末,总DNA 的提取参照Michaelson 等方法进行[15]。总 DNA 纯化晾干后加 100 μL TE 缓冲液(pH7.4)充分溶解后在-20 ℃下保存备用。
聚合酶链式反应(polymerase chain reaction,PCR)扩展5.8S 核糖体内转录区域DNA 序列(internally transcribed spacer regions and the ribosomal,ITS) 鉴定菌种:PCR 引物按 White 等报道设计[16],引物 ITS1 的序列:5`TCCGTAGGTGAACCTGCGG 3`,引物 ITS4 的序列:5`TCCTCCGCTTATTGATATGC3`。PCR 扩增体系为:10×Ex Taq 缓冲液 5 μL,菌体总 DNA 2 ng,10 mmol/L dNTP 1 μL,20μmol/L ITS1 引物 0.5 μL,20μmol/L ITS4引物0.5μL,TaqTM聚合酶2U,加去离子水补足至50μL。
PCR 反应条件为:95 ℃预变性 5 min,95 ℃ 50 s,52 ℃ 40 s,72 ℃ 50 s,30 个循环后 72 ℃延伸 10 min。PCR 产物用1%琼脂糖凝胶电泳,用PCR 纯化试剂盒回收纯化PCR 产物,对ITS 基因片段测序,利用BLAST 软件在NCBI 进行同源性比较。检索得到的同源性较高的序列用Vector NTI 软件整理排列,用分子进化遗传分析软件MEGA7,neighbor joining method 构建系统发生树。
3 结果与分析
3.1 产纤维素酶细菌的筛选
样品经富集之后,在筛选培养基上共筛选出12 株长势良好的菌株,经筛选培养基原位多次点种刚果红染色鉴定,有4 个菌落周围均有透明圈,2 号菌株产生的透明圈大而清晰,直径可达21 mm,将此菌株命名为H-2。
3.2 菌株的酶活测定结果
根据葡萄糖标准溶液光密度测定结果,绘制葡萄糖标准曲线,见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose concentration
H-2 液体培养3 d,测定粗酶活性,在标准曲线上查出对应的葡萄糖含量,计算出CMC 酶活为130 U/mL。试验结果表明,H-2 菌株分泌CMC 酶的能力较强,有进一步研究开发的价值。
3.3 菌株的形态和显微鉴定
H-2 菌株在PDA 平板上培养4 d 后的生长情况见图2。

图2 H-2 菌株在PDA 平板上培养4 d 后的生长情况Fig.2 Growth of H-2 strain cultured on PDA plate for 4 days
H-2 菌落在PDA 平板上形成由中心向外3 层的菌圈,菌落中心为黄白色油状滴,往外为蓝紫色圈,菌落为丝状菌丝,最外层为较大的白色绒状圈,在PDA培养基生长3 d 直径可达3 cm。
H-2 菌株刚果红染色产生的透明圈见图3。

图3 H-2 菌株刚果红染色产生的透明圈Fig.3 H-2 produced clear hydrolytic zone around its colony on a Congo red dyeing agar plate
H-2 菌在CMC-Na 上培养3 d,经刚果红染色出现较大透明圈,直径达2 cm~3 cm。
H-2 菌株的光学显微镜图见图4。

图4 光学显微镜图Fig.4 Optical microscope
利用插片法在光学显微镜下观察,H-2 菌丝有分枝,且有横隔,分生孢子梗聚集,呈条状,表面光滑,显绿色。
H-2 扫描电子显微镜相片见图5。近端处分枝,孢子丝发育到一定阶段便分化为分生孢子,孢子椭圆形,孢子囊丝状有隔膜,孢子椭圆形。孢子囊相互连接。H-2 菌株菌落形态特征、显微特征都和霉菌属菌株一致,依据魏景超方法初步推断为霉菌属菌株[17]。

图5 H-2 扫描电子显微镜相片Fig.5 The scanning electron micrograph of H-2
3.4 菌种分子鉴定
H-2 系统进化树见图6。
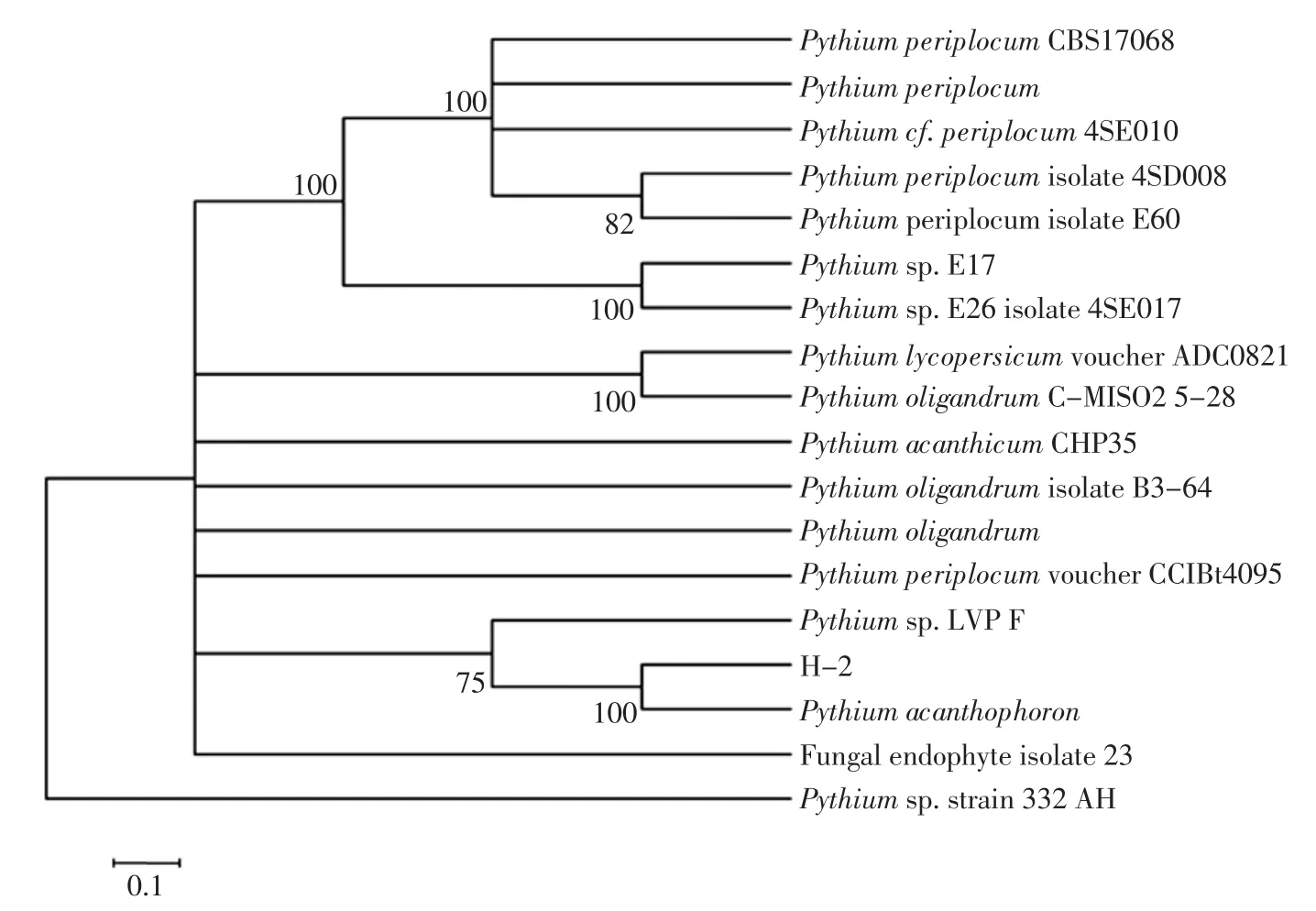
图6 H-2 系统进化树Fig.6 Phylogenetic tree of H-2
依据Bruns 等和Gardes 等方法,ITS 序列在相同物种之间高度同源,是物种鉴定的可信的基因标记[18-19]。PCR 成功扩增得到 02 菌株 ITS 序列 752bp,BLAST 比对,以比对得到的相近ITS 序列建立进化树。02 系统进化树显示,02 菌株和刺器腐霉 (Pythium acanthophoron)处于进化树同一分支上,两者ITS 位点序列有100%的相似性,表明该菌株和刺器腐霉(P.acanthophoron)分类地位很接近,有很近的亲缘关系。
4 结论
原始森林土壤中蕴含丰富微生物菌种资源,从原始森林取样可以筛选得到酶学性质优良的菌种。从广西罗城原始森林取样筛选到4 株产纤维素酶菌株,其中经刚果红染色法证明H-2 在CMC-Na 筛选平板上形成的透明圈和菌落直径最大,产羧甲基纤维素酶的能力强,液体发酵粗酶活测定发现,H-2 菌株液体发酵培养3 d,羧甲基纤维素酶活力达130 U/mL。H-2 菌落形态及显微形态特征鉴定为细菌杆菌属菌株,羧甲基纤维素酶活较高,具有良好的应用前景。
研究表明,腐霉属(Pythium Pringsheim)可以产纤维素酶[20-22],但未见刺器腐霉(P.acanthophoron)产纤维素酶报道。课题计划继续开展刺器腐霉发酵条件优化、纤维素酶纯化及酶学特性研究,为该菌进一步运用打下试验基础。

