抗血管生成靶向药物在胰腺神经内分泌肿瘤治疗中的应用及研究进展
张艺璇,陈洁
(中山大学附属第一医院 消化内科,广东 广州 510080)
神经内分泌肿瘤(neuroend ocrine neoplasms ,NENs)是一类起源于具有胺前体摄取和脱羧能力的神经内分泌细胞的肿瘤,具有高度异质性,主要位于胃肠道及胰腺。其中,胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)的发病率约为0.48/10万人,在美国流行病学研究中居于消化系NENs的第3位[1],而在我国,胰腺是胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors,GEP-NENs)的最常见部位[2]。pNENs可分为非功能性胰腺神经内分泌肿瘤(non-functional pancreatic neuroendocrine neoplasms,NF-pNENs)和功能性胰腺神经内分泌肿瘤(functional pancreatic neuroendocrine neoplasms,F-pNENs),NF-pNENs较多见,占pNENs的60%~90%[3]。
根据2019年第5 版世界卫生组织(WHO)提出的最新的病理分类分级系统,将NENs 分为分化好的神经内分泌瘤(neuroendocrine tumor,NET)、分化差的神经内分泌癌(neuroendocrine carcinoma,NEC)以及混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-nonneuroendocrine neoplasm,MiNEN)。进一步根据Ki-67指数及核分裂象将NET分为3级,即G1、G2、G3[4](表1)。
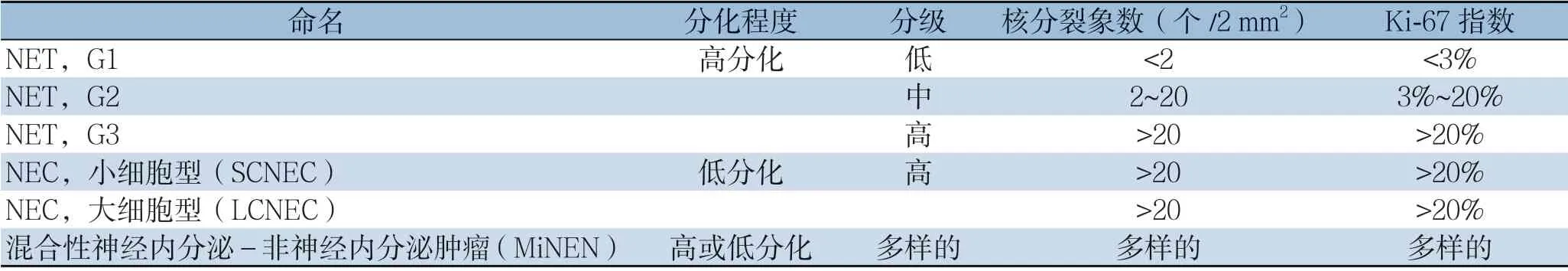
表1 2019年第5 版WHO 胃肠/肝胆胰神经内分泌肿瘤分类及分级标准Table 1 WHO 5th classification and grade of gastrointestinal and hepatopancreatobiliary neuroendocrine neoplasms
pNENs的治疗方式主要包括手术治疗及内科药物治疗。根治性手术是局限性pNENs的首选治疗方式。F-pNENs由于肿瘤细胞过度分泌激素,在早期即可因激素相关临床症状而被发现,但是NF-pNENs早期常无临床症状,相当部分患者在确诊时即已发生不可手术切除的局部或远处转移,从而失去根治性手术机会,对于这部分pNENs患者来说,内科药物治疗尤为重要。目前用于pNENs内科治疗的药物主要包括生长抑素类似物(somatostatin analogs,SSAs)、分子靶向药物和细胞毒化疗药物。分化好的pNETs多数过表达血管内皮细胞生长因子/受体(vascular endothelial growth factor/vascular endothelial growth factor receptor,VEGF/VEGFR)[5-6]、血小板源性生长因子/受体(platelet derived growth factor/ platelet derived growth factor receptor,PDGF/ PDGFR)、干细胞因子受体(stem cell factor receptor,c-kit)[7]等与血管生成密切相关的配体及受体,血供极为丰富,因此抗血管生成靶向药物是pNETs治疗药物研发中最重要的一大类药物。本文旨在对抗血管生成靶向药物在pNETs治疗中的系列研究进行总结及展望。
1 抗血管生成药物种类及其在pNETs 中的研发现状
目前抗血管生成药物主要包括酪氨酸激酶抑制剂(tyrosine kinases inhibitor,TKI)和非TKI两大类。TKI药物主要作用生长因子受体的细胞内酪氨酸激酶域,阻断细胞内信号通路,而非TKI药物主要为单克隆抗体,与相应生长因子结合后,干扰生长因子与受体结合,从而阻止其生物学效应。在pNETs中,已经用于临床和正在研发中的TKI类药物包括舒尼替尼(sunitinib)、帕唑帕尼(pazopanib)、索凡替尼(surufatinib)、仑伐替尼(lenvatinib)、卡博替尼(cabozantinib)、法米替尼(famitinib),非TKI类药物为贝伐单抗(bevacizumab)(表2)。
1.1 TKI 类药物
1.1.1 舒尼替尼 舒尼替尼是第一个研发成功并在国内外获批应用于pNETs 治疗的抗血管生成靶向药物,主要作用靶点为VEGFR、PDGFR、c-kit 及胶质细胞源神经营养因子受体(glial cell line derived neurotropic factor receptor,RET)。2008年发表的II 期临床试验结果发现舒尼替尼在pNETs 中的客观反应率(objective-response rate,ORR)达16.7%[8],初步证实了该药在pNETs 中的疗效,随后开始了III 期临床试验。2011年发表的III 期临床试验结果显示舒尼替尼治疗组的疾病无进展生存期(progression-free survival,PFS)可达安慰剂组的两倍(11.4 个月vs.5.5 个月),客观反应率(objective-response rate,ORR)为9.3%[9]。治疗相关的不良反应(adverse effects,AEs)多为1~2 级,主要的3~4 级AEs 为中性粒细胞减少(12%)及高血压(10%)。2017年发表了对该研究关闭后随访获得的5年总体生存期(overall survival,OS)数据,发现舒尼替尼在pNETs 中的中位OS 可达38.6 个月[10]。随后Raymond 等[11]于2018年发表的IV 期临床试验结果证实舒尼替尼在pNETs 中获得良好疗效的同时(中位PFS 为13.2 个月,ORR 为24.5%),也 发 现 中 位PFS在既往未接受过治疗的患者和接受过治疗[ 包括化疗、免疫治疗或者放射性受体标记的核素治疗(peptide-label receptor radiotherapy,PRRT)]的患者间无明显差异(13.2 个月vs.13.0 个月),说明既往的全身抗肿瘤治疗并不明显影响舒尼替尼的疗效。国内外其他回顾性研究也进一步证实了舒尼替尼的疗效及安全性[12-13]。其中,由我中心发起的多中心回顾性研究发现舒尼替尼在中国pNETs 患者中也有较好的疗效,中位进展时间(time to progression,TTP)达15.3 个月,ORR 为5%,中位OS 为47.5 个月,主要的非血液系统AEs 包括手足综合征和皮肤毒性,且中国患者对25 mg的剂量耐受性更好[12]。
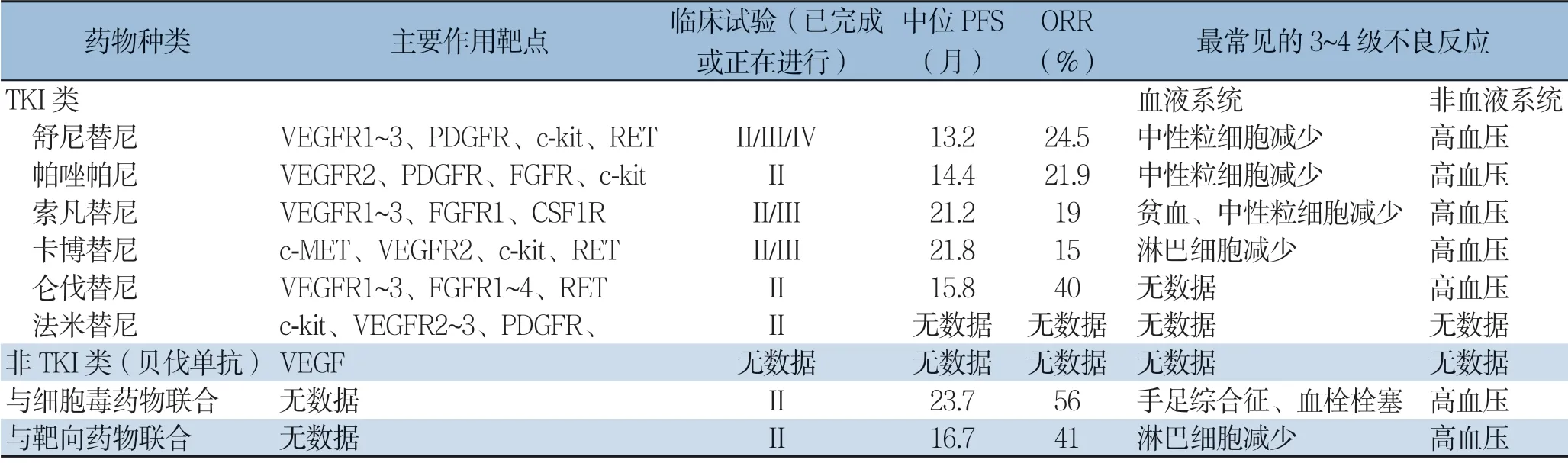
表2 pNETs 中已经用于临床和正在研发中的抗血管生成靶向药物汇总Table 2 Summary of the targeted antiangiogenic drugs for pNENs already in clinical use or under clinical development
注:各药物的中位PFS及ORR均为已有临床试验中取得的较高的数据;Note: The values of the median PFS and ORR for each drug are the superior results obtained from the previous clinical trials
1.1.2 帕唑帕尼 帕唑帕尼是一种新型的多靶点TKI 类药物,主要作用于VEGFR2、PDGFR 及c-kit。2013年发表的II 期临床试验发现其在NETs(胃肠胰及不明原发灶)中的ORR 为18.9%,中位PFS 为9.1 个月,主要的3~4 级AEs 在血液系统为中性粒细胞减少(8%),非血液系统为蛋白尿(11%)[14],但是在pNETs 中的具体疗效未知。2015年发表的II 期PAZONET 研究进行亚组分析时发现帕唑帕尼在胰腺、胃肠道、肺及胸腺NETs中的中位PFS 分别为12.8、10、3.4 个月,且帕唑帕尼与SSA 类药物奥曲肽联合用药的总体中位PFS显著高于帕唑帕尼单药(11.7 个月vs.4.2 个月)。最常见的3~4 级AEs 为肝细胞毒性(8%)、乏力(7%)、腹泻(4%)、高血压(4%)[15]。同年由Phan 等[16]发表的另一项II 期临床研究显示帕 唑 帕 尼 在pNETs 的ORR 为21.9%,中位PFS 为14.4 个月,而在非胰腺部位(胃肠道、肺、肾脏及不明原发灶)中的ORR 为0,中位PFS 为12.2 个月。主要的3~4 级AEs 为转氨酶升高和中性粒细胞减少(6%)。上述系列研究结果表明帕唑帕尼可能在pNETs 更有优势,因此该药在pNETs 中值得进一步深入探索。另外,帕唑帕尼联合替莫唑胺治疗pNENs 的I/II 期临床试验正在进行(NCT 01465659)。
1.1.3 索凡替尼 索凡替尼主要作用于VEGFR、成纤维细胞生长因子受体1(fibroblast growth factor receptor-1,FGFR1)、集落刺激因子1受体(colony stimulating factor-1 receptor,CSF-1R)。该药在分化好的NETs 中Ib/II 期临床研究结果于2019年发表,研究发现索凡替尼在pNETs中的ORR 为19%,中位PFS 为21.2 个月,靶病灶体积缩小超过10% 的患者占61%,且在pNETs中的疗效优于胃肠道、肺等非胰腺部位(中位PFS:21.2 个月vs.13.4 个月)。此外,该药在之前曾使用舒尼替尼或法米替尼治疗失败的NETs 患者中也具有抗肿瘤效应(ORR 为15%,中位PFS为13.8 个月)。而药物安全性方面,索凡替尼主要的3 级以上的AEs 为高血压(33%)、蛋白尿(12%)、高尿酸血症(9%)、高甘油三酯血症及腹泻(6%)、谷丙转氨酶升高(5%),予对症支持治疗或剂量调整后均可控制[17]。索凡替尼III期临床试验(NCT02589821)也即将完成,有望成为pNETs 治疗的又一新药。
1.1.4 卡博替尼 卡博替尼主要作用靶点为肝细胞生长因子受体(hepatocyte growth factor receptor,c-MET)、VEGFR2、c-kit 及RET,2017年发表的II 期临床试验结果发现其在pNETs中的ORR 为15%,中位PFS 为21.8 个月,主要的3 级以上的不良反应为高血压(13%)及低磷血症(11%)[18]。卡博替尼在GEP-NET 的III 期临床试验(NCT 03375320)正在进行。
1.1.5 仑伐替尼 仑伐替尼主要作用于VEGFR1-3、FGFR1-4 及RET。2019年最新公布的TALENT II 期临床研究结果表明仑伐替尼可使pNETs 患者明显获益,在pNETs 中PFS 达15.8 个月,其 ORR 明显高于胃肠 道NETs(40% vs.18.5%),且pNETs的研究对象中还包括了既往经过依维莫司或舒尼替尼治疗失败的患者[19],说明仑伐替尼的疗效可能不会被既往靶向治疗减弱,这些优势可能使仑伐替尼成为pNETs 治疗领域的又一潜在新药。
1.1.6 其他 其他的TKI 类药物也在pNETs 中进行尝试,例如,法米替尼的作用靶点为c-kit、VEGFR2~3、PDGFR,其II期临床试验也正在GEP-NETs 中进行(NCT 01994213)。
1.2 非TKI 类药物
贝伐单抗是重组人IgG1单克隆抗体,可与VEGF特异性结合,竞争性抑制VEGF/VEGFR相互作用,从而起到抗血管生成的作用。目前,贝伐单抗在pNETs中的研究主要为与生物治疗、细胞毒药物治疗或其他靶向药物联合应用的研究。
1.2.1 贝伐单抗与细胞毒药物联合应用在pNETs中的研究 2012年发表的贝伐单抗联合替莫唑胺的II 期临床研究结果中,经治疗后获得PR 的患者(15%)全为pNETs,且在pNENs 中的中位PFS 达14.3 个月,中位OS 远高于非胰腺(小肠、阑尾、支气管及不明原发灶)部位(41.7 个月vs.18.8 个月),主要的3~4 级AEs 为淋巴细胞减少(53%)及血小板减少(18%)[20]。2014年发表的XELBEVOCT 研究发现,贝伐单抗联合卡培他滨、长效奥曲肽方案在pNETs 中的中位PFS为14.3 个月,ORR 高于胃肠道及肺(26.3% vs.11.5%),3 级AEs 主要为手足综合征(11.1%)及蛋白尿(4.4%)[21]。同年发表的BETTER 研究表明,贝伐单抗和氟尿嘧啶及链脲霉素联用方案在晚期分化好的pNETs 中的中位PFS 为23.7 个月,ORR 为56%,主要的3~4 级AEs 为高血压(21%)、腹痛(12%)及血栓形成(9%)[22]。另外,2016年发表的贝伐单抗联合奥沙利铂、左亚叶酸为基础的化疗的II 期临床试验结果发现,贝伐单抗联合FOLFOX-6 方案在pNETs 中经过12 个周期的化疗后取得的部分缓解率为41.7%(5/12),中位PFS为21 个月,而贝伐单抗联合奥沙利铂、卡培他滨在pNETs 中的部分缓解率为18.8%(3/16),中位PFS 为15.7 个月[23]。这些研究结果表明贝伐单抗与化疗药物的联合应用可能也是晚期pNETs 患者的治疗选择之一。
1.2.2 贝伐单抗与生物治疗、其他种类靶向药物联合应用在pNETs 中的研究 CALGB 80701 临床试验(NCT 01229943)初步研究结果显示贝伐单抗与依维莫司联用时 在pNETs 中的OR R 和中位PFS 高于依维莫司单药(ORR:31% vs.12%;PFS:16.7 个月 vs.14 个月),但是3 级以上AEs的发生率也明显增高(42.5 % vs.27%)[24]。2015年发表的II 期临床研究发现贝伐单抗与替西罗莫司联合用药在pNETs 中的ORR 达41%,中位PFS 为13.2 个月,常见的3~4 级AEs 在血液系统为淋巴细胞减少(14%),非血液系统为高血压(21%)。82% 的患者因AEs 而减量应用替西罗莫司,25% 的患者也因AEs 相应调整了贝伐单抗的剂量[25]。由此可见,贝伐单抗与其他靶向药物联合应用的安全性仍待进一步探讨。
2 抗血管生成靶向药物在pNETs 中的疗效预测及评估
2.1 症状及血清学标记物
抗血管生成治疗目前尚未有可靠的分子标记物用于准确筛选出最能获益的患者及疗效预测。初步研究发现与疗效较好相关的因素主要有药物相关性高血压[12]及蛋白尿[21],低基线血清嗜铬粒蛋白A 水平[14],低基线血清成纤维细胞生长因子(fibroblast growth factor,FGF)水平[17],高基线血清sVEGFR2水平[15,17]和治疗后升高的巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)水平[17]。与疗效较差相关的因素主要有:高循环肿瘤细胞(circulating tumor cells,CTC)水平[15]、VEGFR3的两种错义突变(rs307826和rs307821)[15,26],循环白介素6(interleukin-6,IL-6)、白介素8interleukin-8,IL-8)、骨桥蛋白(osteopontin,OPN)及肝细胞生长因子(hepatocyte growth factor,HGF)[26]。但这些结果尚需要进一步大样本前瞻性临床研究验证。
2.2 影像学评估与疗效预测
电子计算机断层扫描(computed tomography,CT)是评估疗效最常用的方式。笔者的研究[27]表明用CT 对舒尼替尼进行疗效评估时,Choi 标准由于同时应用靶病灶体积变化及密度变化两个参数,比传统的RECIST标准更敏感、更准确,可能更加适合用于抗血管生成靶向药物的疗效评估。功能性动态灌注增强(dynamic confusion enhanced,DCE)显像,通过多种与靶病灶血供相关的参数综合评价病灶,不仅可用于疗效评估,还是一种潜在的可用于筛选对抗血管生成靶向药物获益患者的工具[28-29]。由于CT、超声(ultrasound,US)及核磁共振(magnetic resonance imaging,MRI)各具优势,将来都有可能在DCE显像方面进一步发展,应用于抗血管生成靶向药物的疗效评估和预测。
3 抗血管生成靶向药物的研究展望
鉴于在进展期和转移性pNETs 中的良好疗效,抗血管生成靶向药物在将来仍会是pNETs药物研究热点。首先,鉴于其在pNETs中10%~40%不等的ORR,抗血管生成靶向药物可能用于部分pNETs的新辅助治疗[30]。其次,抗血管生成靶向药物与其他机制的抗肿瘤药物联合应用或序贯应用的疗效及安全性仍需进一步探索。此外,目前抗血管生成靶向药物的研究多在G1、G2级pNETs中进行,对G3级pNETs或pNEC是否有作用有待探索。最后,抗血管生成靶向药物的疗效评估与预测标记物研究依然是今后研究的一个重点。

