内生真菌司氏角担子菌B6对尖孢镰刀菌西瓜专化型菌株的拮抗作用
刘付燕,刘连红,郝思静,王兴祥,戴传超*
(1.南京师范大学生命科学学院/江苏省微生物资源产业化工程技术研究中心 江苏省微生物与功能基因组学重点实验室,江苏 南京 210046;2.中国科学院南京土壤研究所 土壤环境与污染修复重点实验室,江苏 南京 210008;3.中国科学院 红壤生态实验站,江西 鹰潭 335211)
西瓜(Citrulluslanatus)是世界十大水果之一,具有清热解毒功效。近年来,西瓜栽培面积不断扩大但产量不高,究其原因是轮作土壤种植西瓜会产生枯萎病害造成其严重减产[1-2]。西瓜枯萎病的病原菌主要是尖孢镰刀菌(Fusariumoxysporumf.sp.Niveum,FON),它的存在形式以菌核、厚垣孢子或菌丝体为主,该菌在土壤或未腐熟的带菌有机肥中存活时限长达8~10年之久,很难根除[3-4]。因此,防治西瓜枯萎病的关键措施是抑制尖孢镰刀菌的生长。目前,防治西瓜枯萎病的方法有化学农药法、西瓜嫁接栽培、间作套作等[5-8]。化学农药方法虽然效果显著,但持续使用易造成病菌产生抗性、农药残留影响环境和人体健康;间作套作相对污染小,但受到的影响因素较多(如当地的种植习惯等),不利于推广。近年来,使用有益微生物与FON发生拮抗作用来抑制其生长和繁殖,从而有效地控制西瓜枯萎病的发生,其生物防治方法得到普遍推广[9-12]。例如,张丽萍等[13]研究T42木霉与枯草芽胞杆菌Bs-6的混合菌剂对FON的拮抗作用,结果显示西瓜的品质得到了很大的提高,病害率降低了75%。但是工业化的木霉制剂多为活孢子,稳定性差不利于投入到田间试验。课题组前期研究发现筛选分离自重阳木茎内皮的内生真菌B6[14]作为生物菌剂具有抗虫、抑菌及降解菲[15-16]等功能,将B6添加到西瓜连作土壤中发现FON病原菌数量减少了29.9%[17],但是内生真菌B6抑制FON的作用机制尚未阐明。本研究以内生真菌B6和FON为材料,采用对峙培养和抑菌实验的方法探究内生真菌B6与FON之间的拮抗作用及其挥发性物质对FON生长和产孢的影响,为进一步探究西瓜枯萎病生物防治技术提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 内生真菌司氏角担子菌(Ceratobasidumstevensii)B6是本课题组自重阳木茎内皮分离得到的,菌种保藏于江苏省微生物与功能基因组学重点实验室。尖孢镰刀菌西瓜专化型菌株(Fusariumoxysporumf.sp.Niveum,FON)分离自1株患枯萎病的西瓜苗,此患病西瓜苗采自中国农业科学院祁阳红壤试验站连作西瓜实验田。
1.1.2 培养基 马铃薯(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g(液体培养基无需添加)。B6和FON菌株使用马铃薯固体或液体培养基(PDB)28 ℃培养3 d进行活化,备用。
1.2 方法
1.2.1 B6和FON的拮抗培养[18]使用打孔器分别打取直径5 mm的B6和FON菌块,再接种到新的PDA平板上,B6和FON间距为3 cm,平板正置于28 ℃培养箱培养7 d。
1.2.2 显微镜下观察B6和FON菌丝之间的相互作用 按照1.2.1方式打取菌块,同时在距离FON 1 cm处铺一张无菌玻璃纸条(1 cm×5 cm),28 ℃培养,当两菌菌丝均长到玻璃纸上且发生相互接触时,揭下玻璃纸,显微镜下观察[19]。选取未放玻璃纸条的平板,培养15 d后,在两菌交界处打取5 mm菌块,组织匀浆器将其破碎,加无菌水混匀澄清后取1 mL上清液平板涂布后倒置培养3 d,观察菌丝的生长状况。
1.2.3 B6无菌发酵液对FON生长和产孢的影响 选取PDB中培养15 d的菌株B6于5 000 r/min离心10 min获得上清液,上清液用3层滤纸抽滤,0.22 μm滤膜过滤除菌。分别取2、5、10 mL发酵原液加入8、5、0 mL无菌水,得到稀释倍数分别为5倍、2倍和原液的10 mL发酵液,再添加90 mL PDB与其混合均匀,然后倒平板冷却凝固后接入5 mm FON菌块,28 ℃培养7 d。先测量菌落直径,再于培养皿中加入3 mL无菌水,用涂棒均匀涂布得孢子悬液,血球计数板测孢子数量。以10 mL无菌水添加90 mL PDB的平板作为对照,每个处理3个重复。
生长抑制率(%)=((对照组菌落直径-处理组菌落直径)/对照组菌落直径)×100
产孢抑制率(%)=((对照组产孢量-处理组产孢量)/对照组产孢量)×100
1.2.4 B6挥发性物质对FON生长、产孢及其菌丝形态的影响 打取1个FON菌块和3个B6菌块,分别接种到2个PDA平板上,一种是直接将2个平板的皿底相扣[20],另一种是在距离FON菌块1 cm处铺一张无菌玻璃纸条(1 cm×5 cm)[19]。两者用封口膜封好后保持FON的皿底向上于28 ℃培养7 d。前者测量FON菌落直径,然后在接种FON的培养皿中加入3 mL无菌水,均匀涂布,得孢子悬液,血球计数板测量孢子数量。后者取出玻璃纸条用于显微镜观察FON菌丝的变化。以未接B6菌块的平板作为对照。
2 结果与分析
2.1 B6和FON的拮抗培养
图1中a~b显示,开始时两种菌独立生长,FON菌落呈紫色,B6菌落呈淡黄色;c~d显示B6生长较快,当培养到第3天时,两菌菌丝接触,接触区域FON停止生长,B6在FON菌丝表面继续生长,直到将FON完全覆盖;e~h显示,从平板底面观察发现B6覆盖区域FON紫色变成淡黄色,后又渐变成白色,当B6将FON完全覆盖后,紫色完全消失。
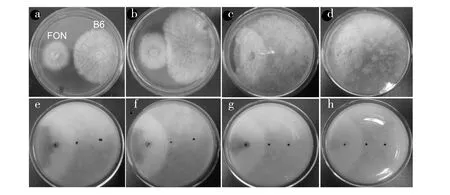
图1 B6和FON的对峙培养Fig.1 The dual culture of B6 and FONa~d:B6和FON培养3 d菌落正面;e~h:菌落反面a-d:the front colony maps of B6 and FON culture for 3 days;e-h:the negative colony maps
2.2 B6菌丝和FON菌丝之间的相互作用
图2b中,可以发现B6菌丝在向外生长的过程中不断分支,且分支与其生长主方向几乎是垂直的,分支与附近的菌丝相接,为其他菌丝的生长提供支架作用,如此继续形成复杂的网络结构。c和d中,箭头指示B6菌丝的分支形成附着胞似的结构附着到FON菌丝上继续向外生长,可见其具有很强的竞争能力。e是B6菌丝顶端部位的放大,可以看到其顶端周围有黑色物质,推测B6可能是通过这种物质识别周围可供其附着的固定点,从而决定其分支生长的方向,利于其竞争生存空间。
将两菌交界处打取的菌块磨碎涂平板,培养3 d后平板上同时长出白色和紫色菌丝,即B6和FON的菌丝,这说明B6将FON完全覆盖后并不会引起其菌丝死亡,只是通过竞争生存空间和营养物质而限制其生长。
2.3 B6无菌发酵液对FON生长和产孢的影响
与对照相比,培养基中加入B6无菌发酵液并没有抑制FON的生长和产孢,反而在一定程度上对其生长和产孢有促进作用(表1)。

图2 对峙培养中B6菌丝和FON菌丝之间的相互作用Fig.2 The interaction of B6 and FON in the dual culturea:FON菌丝;b:B6菌丝;c~d:B6菌丝的分支附着到FON菌丝;e:B6菌丝顶端部位a:FON;b:B6;c-d:B6 attached FON;e:the top part of B6
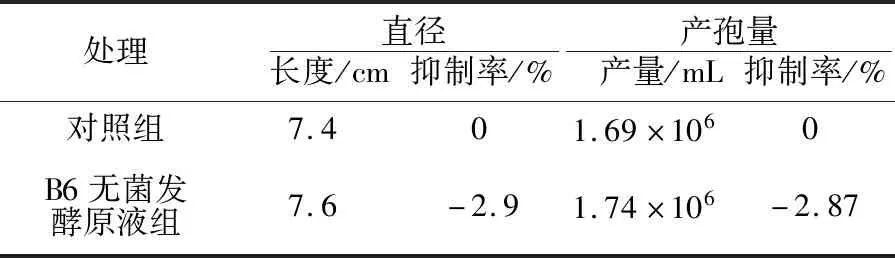
表1 B6无菌发酵液对FON菌落生长和产孢量的影响Table 1 The effect of sterile fermentation broth of B6 on the grow and sporulation of FON
2.4 B6挥发性物质对FON生长和产孢的影响
与单独培养FON相比,对峙培养中B6产生的挥发性物质可以不同程度地抑制FON的生长和产孢,抑制率分别为20.9%和30.9%(表2)。
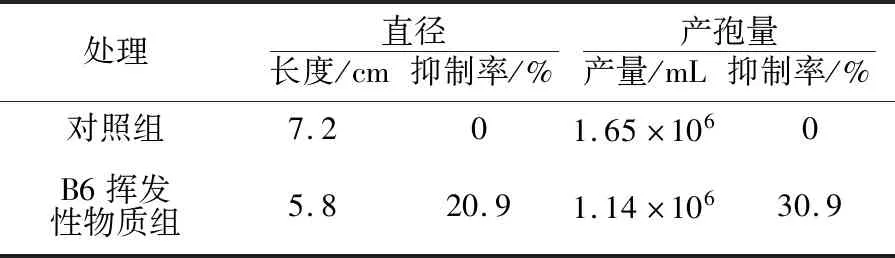
表2 B6挥发性物质对FON菌落生长和产孢量的影响Table 2 The effect of volatile substance of B6 on the grow and sporulation of FON

图3 B6挥发性物质对FON菌丝形态的影响Fig.3 The effect of volatile substance of B6 on mycelial morphology of FON
与单独培养的FON菌丝形态相比,B6和FON对峙培养时,FON菌丝分枝变少(图3)。B6产生的挥发性物质可能正是通过抑制FON的菌丝分支形成和降低FON菌丝生长速率来抑制FON的生长和产孢,这与前面的结果是一致的。
3 讨 论
竞争、抗生和重寄生是内生真菌与病原菌之间的主要作用方式[21]。对峙培养试验表明,B6具有很强的竞争能力,能够在对峙培养中占据培养皿的大部分空间,最终完全覆盖FON。纪明山等[22]在绿色木霉和尖孢镰刀菌的对峙培养试验中也发现相似的现象,绿色木霉菌丝能够紧贴尖孢镰刀菌菌丝平行生长或穿入菌丝生长,从而竞争尖孢镰刀菌的生存空间使其菌丝解体。另外,Audrey等[23]研究了内生真菌Paraconiothyriumvariabile与Fusariumoxysporum的对峙培养,PV也会造成FO细胞的解体死亡。在显微镜下观察B6和FON的菌丝相互作用,发现FON菌丝的外围附着B6菌丝,可能是B6通过分泌某些物质识别FON菌丝来实现的,然而B6菌丝不会造成FON菌丝的断裂和解体。进一步的实验结果也证明虽然B6可以将FON完全覆盖,但并不能导致其完全死亡。这些实验结果表明,内生真菌B6和FON的相互作用机制仅仅是竞争,而不存在重寄生作用。
植物内生真菌与病原菌可在宿主体内进行相互竞争,主要是空间和营养[24-25],前者能够释放各种具有抑菌活性的成分来抵御病原菌。通过对B6次级代谢产物的抑菌活性进行研究,发现B6发酵液并不能抑制FON的生长和产孢,而B6挥发性物质表现出抑菌活性,结果显示其对FON生长抑制率为20.9%,产孢抑制率为30.9%。这表明B6与FON拮抗作用是挥发性代谢产物所致。例如,Angela等[26]发现菠萝的1株内生真菌(Muscodorcrispans)能够产生混合的挥发性物质,这些物质对许多植物和动物病原菌表现出广谱杀菌性[27-28],主要包括酯类、醇类和酸类。推测B6的挥发性物质不是单一存在的,有可能是几种物质的混合,混合物的种类和结构成分的确定还需进一步探究。

