尾加压素II 对大鼠心肌细胞氧化应激/内质网应激及其相关信号通路的影响
支杏敏,张捷,邢明青,卢东,戴红艳
研究发现,尾加压素Ⅱ(urotensin Ⅱ,UⅡ)是目前已知最有效的缩血管活性物质,其缩血管效能可达内皮素-1 的10 倍[1],其分布具有种属普遍性,目前在多种物种(包括人类)中都克隆出了UⅡ[2]。除此之外,UⅡ在多种细胞中均可表现出诱导氧化应激(oxidative stress,OS)、活性氧(reactive oxygen species,ROS)产生的作用,如UⅡ可以通过诱导心脏成纤维细胞、肝卵圆细胞等产生ROS,发挥促增殖作用[3-4]。在心肌细胞里,ROS 已被证实可以引发内质网应激(endoplasmic reticulum stress,ERS)的上游信号分子的产生,从而参与调节并启动细胞凋亡的过程[5-6]。但UⅡ对心肌细胞氧化应激、内质网应激的影响尚不清楚。本研究为体外实验,以UⅡ作为刺激因素,观察其对心肌细胞OS 作用的影响,并探讨其是否通过OS 途径激活心肌细胞ERS 及其相关信号通路。
1 材料与方法
主要试剂和材料:新生1~2 天Wistar 大鼠乳鼠,清洁级(山东鲁抗医药公司提供)。兔抗大鼠3 -磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、兔抗大鼠葡萄糖调节蛋白质78(glucose-regulated protein, GRP78)多克隆抗体、小鼠抗大鼠活化转录因子6(activating transcription factor 6, ATF6)单克隆抗体购自英国Abcam 公司。UⅡ购自美国Sigma 公司,抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)、GAPDH 以及2,7-二氯荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)购自上海碧云天生物技术有限公司。TAKaRa 逆转录试剂盒购自日本TaKaRa 公司。胎牛血清(fatal bovine serun,FBS)、培 养 基(dulbecco's modified eagle medium,DMEM)购自美国Hyclone 公司。
心肌细胞培养:在无菌条件下,取新出生1~2天Wistar 大鼠乳鼠心脏,剪碎,用0.125%胰蛋白酶反复消化至组织全部消化,收集每次消化后的胰蛋白酶,用含20%FBS 的DMEM 低糖培养基终止消化。将收集的细胞悬液用200 母滤网过滤后离心、重悬,通过差速贴壁方法获取心肌细胞,接种到35 cm3培养瓶或六孔板上,于37℃,5% CO2孵箱培养36 h 后进行实验。
实验设计:用低糖DMEM 培养基培养心肌细胞36 h 后,将培养的心肌细胞随机分为4 组:正常对照组:无刺激培养48 h;尾加压素Ⅱ处理组(UⅡ组):UⅡ 100 nmol/L 培养48 h;抗氧化剂NAC 预处理组(NAC 组):NAC 100 μmol/L 预处理组24 h 后,无刺激培养48 h;UⅡ+ NAC 组:NAC 100 μmol/L 预处理24 h 后,UⅡ100 nmol/L 培养48 h。培养完成后收集心肌细胞。
细胞内活性氧水平检测[7]:收集各组心肌细胞,用无血清DMEM 培养基清洗3 次,加入30μmol/L DCFH-DA 37℃下孵育20 min,不发光的DCFH-DA可以自由透过细胞膜, 细胞内的ROS 可将DCFHDA 氧化成具有荧光的DCFH, 其荧光强度与细胞内产生的ROS 的量成正比。再用无血清DMEM 培养基洗涤细胞3 次, 以充分去除未进入细胞内的DCFH-DA。用共聚焦显微镜获得各组细胞图像。采用image-pro plus 6.0 软件进行荧光密度分析。
实时荧光定量PCR 检测:按说明用TRIzol 提取心肌细胞总RNA,并用紫外分光光度计在260 nm下测量并计算RNA 的浓度及纯度。根据TAKaRa逆转录试剂盒说明,将RNA 逆转录为cDNA,并按2 μl 引 物(10 μmol),1 μl cDNA,8 μl 2×Taq PCR Master Mix,12 μl ddH2O,总反应体积25 μl 的反应体系、反应条件95℃,30 s。采用Promega 的SYBR®Green Ⅰ在荧光定量PCR 仪上扩增,建立标准曲线,反应步骤:95℃,10 s,35 个循环,62℃退火10 s;72℃延伸10 s 进行PCR 扩增,在每个循环的延伸期收集荧光信号,并通过熔解曲线分析PCR扩增的特异性。所获数据通过2-ΔΔCt法进行处理。引物序列见表1。
蛋白免疫印迹法(Western Blot)检测:RIPA 细胞裂解液(RIPA lysis buffer)与蛋白酶抑制剂Aprotinin按250:1 比例消化收集的各组心肌细胞,冰上裂解30 min,剧烈震荡3 次,高速离心机离心后取上清,加入适量蛋白上样缓冲液,10 min 煮沸。用二喹啉甲酸(BCA)法[8]测定所得蛋白浓度。用10%SDS-PAGE 进行电泳分离,并转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,室温下5%脱脂奶粉封闭2 h,然后分别用GRP78 单克隆抗体(1:1 000)、ATF 单克隆抗体(1:160)、CHOP 单克隆抗体(1:1 000)和caspase-12 单克隆抗体(1:1 000)、GAPDH 单克隆抗体(1:1 000)4℃摇床孵育过夜,再与相应的辣根过氧化物酶标记的二抗室温孵育1 h,采用化学发光检测法(ECL 显色法)处理蛋白条带。以GAPDH 为内参,用Gelpro32 软件对结果进行半定量分析。
统计学方法:用SPSS 19.0 软件进行统计学处理,并用±s 表示。多组数据间的比较采用单因素方差分析,两组间的数据比较采用成组t 检验,P<0.05 为差异有统计学意义。

表1 引物序列
2 结果
UⅡ对心肌细胞内ROS 水平的影响(图1、2):细胞免疫荧光法检测结果,其中绿色荧光的深度代表ROS 的含量,共聚焦显微镜图像(图1),荧光密度分析值柱形图(图2)。UⅡ组心肌细胞中ROS 表达水平较UⅡ +NAC 组、正常对照组、NAC 组明显增强,差异有统计学意义(P <0.05)。
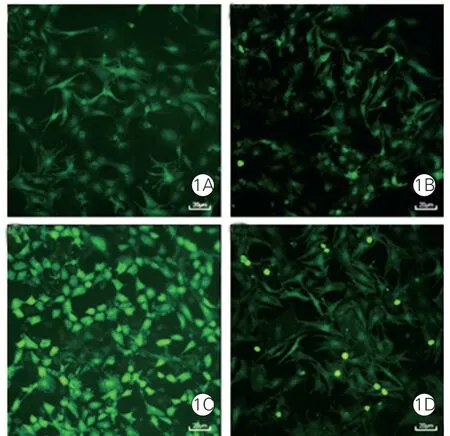
图1 各组心肌细胞内ROS 水平的激光扫描共聚焦显微镜图像
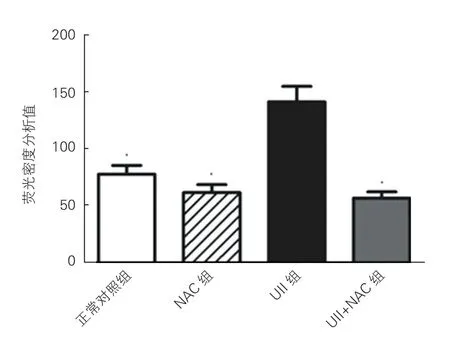
图2 各组心肌细胞内ROS 水平的荧光密度分析值(n=3)
UⅡ对心肌细胞内质网应激及相关信号通路的影响(图3、4):通过qRT-PCR、Western blot 法检测各组中ATF6、GRP78、CHOP 和 caspase-12 的表达变化。UⅡ组中ATF6、GRP78、CHOP 和 caspase-12 的mRNA 相对表达水平及蛋白表达量均较UⅡ +NAC组、正常对照组、NAC 组明显增强,差异均有统计学意义(P 均<0.05)。
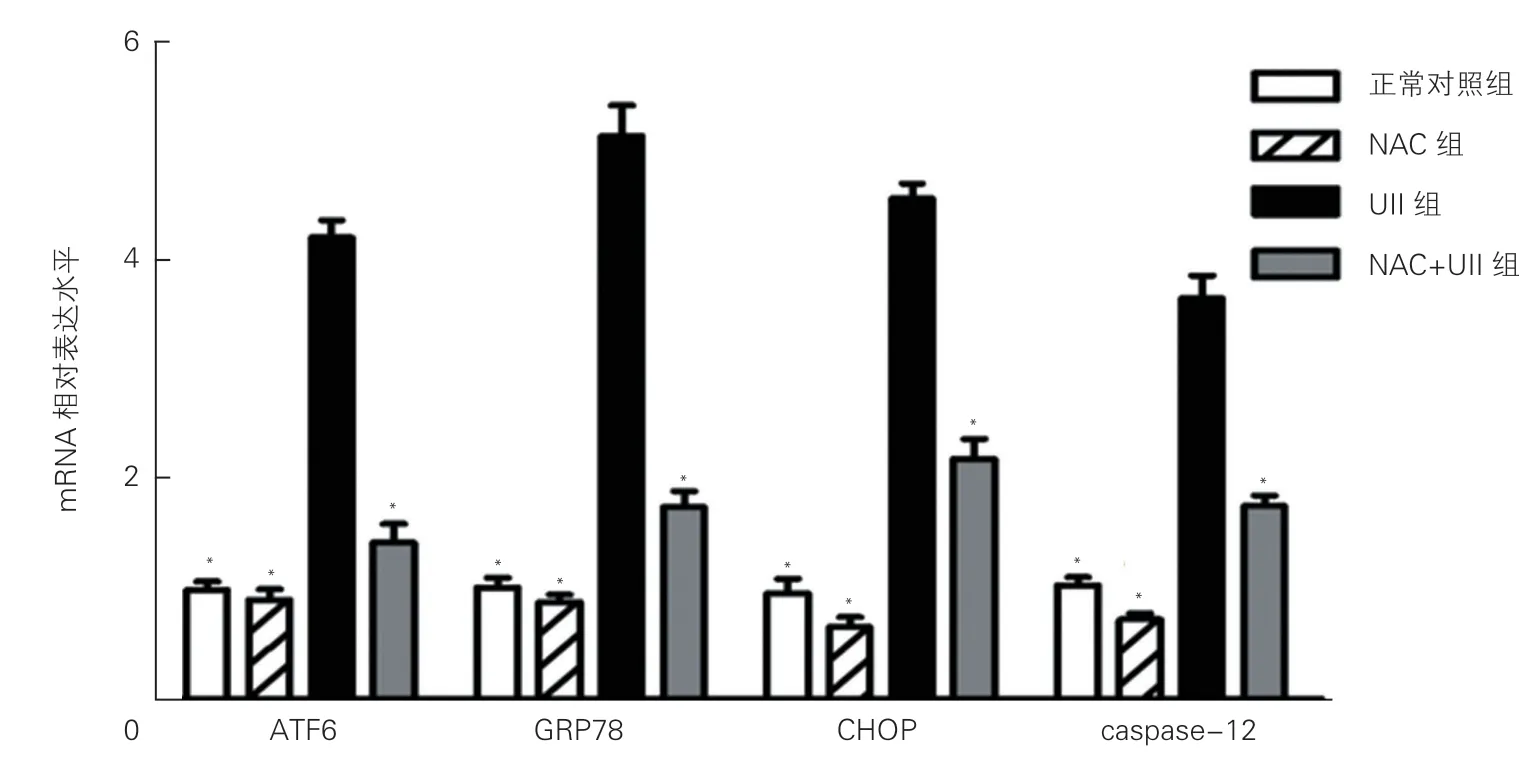
图3 qRT-PCR 法检测UⅡ对各组细胞ATF6、GRP78、CHOP 和 caspase-12 的mRNA 表达的影响 (n=3)

图4 Western blot 法检测UⅡ对各组细胞ATF6、GRP78、CHOP 和 caspase-12 的蛋白表达的影响(n=3)
3 讨论
UⅡ是目前已知最有效的缩血管活性物质,且在多种细胞中均可表现出诱导OS、ROS 产生的作用[9-11]。本研究于体外培养乳鼠心肌细胞,给予UⅡ刺激后,ROS 合成明显增多,且此过程可被抗氧化剂所抑制,证实了UⅡ对心肌细胞具有促进OS 的作用,UⅡ可能通过促进OS 作用,在心肌细胞内发挥重要的致病作用。
内质网是哺乳动物细胞重要的Ca2+贮存器,也是蛋白质合成与翻译后修饰、多肽链正确折叠与装配的重要场所。多种因素如OS、低氧、高血糖、化学毒物等均可使内质网腔内Ca2+耗竭、内质网蛋白质糖基化抑制、二硫键错配、内质网蛋白质向高尔基体转运减少,导致未折叠或错误折叠的蛋白质在内质网腔内积蓄等,从而破坏内质网稳态。内质网通过减少蛋白质翻译、分子伴侣以及相关蛋白表达上调、增加未折叠蛋白质降解等途径力图使内质网恢复稳态,这些变化统称内质网应激[12]。此时内质网的分子伴侣如GRP78、GRP94 和钙网蛋白的产生都会相应的提高[13], 其中GRP78 是内质网应激反应的标志蛋白[14],会与错误折叠的蛋白或未折叠的蛋白相结合,阻止这些蛋白的合成并使它们在内质网中重新排列折叠或进入降解途径,以便能够修复内质网[15]。
当内质网处于应激状态时,内质网通过激活未折叠蛋白反应(unfolded protein response,UPR)以保护由ERS 所引起的细胞损伤,恢复细胞功能,包括暂停早期蛋白质合成、内质网分子伴侣和折叠酶的转录激活。UPR 通常可激活3 种转录因子,引起未折叠的和错误折叠的蛋白在内质网内沉积降解[16-19]。这3 种转录因子分别为:肌醇酶1/内质网核心信号1(IRE1/ERN1)、PEK 样内质网激酶(RERK/PEK)和ATF6。其中ATF6 为内质网上的一种感受蛋白,是ERS 引起的细胞凋亡和自噬途径中的一个重要的调节因子,它不仅能够启动ERS 的生存途径,严重或长时间的ERS 损伤了ER 的功能时,同样能够启动由ERS 所介导的凋亡信号通路,诱导细胞凋亡,以去除受损伤的细胞。ERS 诱导的下游凋亡信号通路包括[20-22]:153 生长停滞及DNA 损伤诱导基因153 (CHOP/GADDl53)、c-Jun 氨基末端激酶(JNK)、caspase 通路。内环境平稳状态下,CHOP和caspase-12 的表达很弱,当稳态失衡,细胞发生ERS,CHOP 和caspase-12 的表达明显升高,过度表达的CHOP 和caspase-12 会促使细胞周期停滞或严重的会导致细胞凋亡。
本研究于体外培养乳鼠心肌细胞,给予UⅡ刺激后,内质网分子伴侣GRP78、UPR 转录因子ATF6、内质网相关凋亡信号分子CHOP、caspase-12的表达均明显升高,提示UⅡ可以激活ERS 及其相关信号通路。目前越来越多的证据表明ROS 的产生和细胞蛋白的折叠有直接的联系[23-24]。OS 和ROS的产生是ERS 过程中不可或缺的部分。在ERS 相关研究中发现,OS 促使内质网中钙的释放并引起线粒体的再摄取[25]。因此,钙的增加会加快新陈代谢及线粒体中ROS 生成[26],Ca2+的迁移或释放与ERS 紧密相连。已有研究证实,OS 是改变内质网稳态或失调一个重要信号[27]。我们的数据表明,UⅡ可以增加ROS 在心肌细胞的表达并可以一定程度上激活ERS 及其相关信号通路,且UⅡ组预处理抗氧化剂NAC 后,UⅡ诱导的 ROS、ERS 及其相关信号通路表达均显著降低。既往研究已经证实,心肌梗死、心力衰竭、糖尿病性心肌病等情况下,心肌细胞UⅡ表达均增加,但其参与心脏重构的机制未完全明了。基于前述结果我们得出,在所有UⅡ表达增高的病理状态下,UⅡ可以先激活OS,进而激活ERS 途径,且此过程有ATF6、CHOP、caspase-12等信号通路分子的参与,这是UⅡ参与心脏重构的一个重要病理生理机制。
总之,UⅡ可能通过OS 途径激活心肌细胞ERS,且此过程有ATF6、CHOP、caspase-12 等信号通路分子的参与,此通路在UⅡ参与的心脏重构中发挥了重要作用,但UⅡ对细胞凋亡的影响还需进一步深入研究。
利益冲突:所有作者均声明不存在利益冲突

