MiR-506-3p靶向TRAF6抑制心肌炎的炎性反应和心肌细胞凋亡
阳慧 苏雨江 钟江华 马添翼
(海口市人民医院心血管内科,海南 海口 570208)
心肌炎临床症状包括心律失常、心源性休克、急性心功能不全等,是一种心肌炎性疾病〔1〕。自身免疫性疾病、感染、物理化学刺激等多种因素均可引起心肌炎,其中肠道病毒引起的病毒性心肌炎(VMC)较为普遍,而柯萨奇B组病毒(CVB)3是引起VMC的常见病毒〔2,3〕。目前,VMC的诊断包括心电图、血清检测、心脏磁共振成像、心内膜心肌活检等,其治疗方式在支持治疗的基础上结合了免疫疗法和抗病毒治疗,为重症VMC患者带来了曙光〔4,5〕。但VMC在临床诊断与治疗中仍面临挑战,探索VMC发生发展机制及临床治疗靶点具有重要意义。
微小RNA(miRNA)是非编码RNA分子,通过干扰内源性RNA而调节多数人类基因功能,参与调控细胞增殖、凋亡、分化、免疫反应等生物过程〔6〕。miRNA在人体多种病灶组织中异常表达,随疾病程度的加深其表达水平也发生变化,是特定疾病诊断的标志物〔7〕。研究表明〔8,9〕,miRNA分子可调节炎性细胞因子水平,参与病毒诱导的免疫反应。目前,关于miR-506-3p的研究相对较少,miR-506-3p与TRAF6在心肌细胞中是否存在靶向关系尚无报道,本文检测了miR-506-3p在正常大鼠和VMC模型大鼠心脏组织中的表达及其对心肌细胞炎性因子水平、细胞凋亡的影响。
1 材料与方法
1.1材料 20只4周龄雄性SD大鼠(合格证号:中科动管007号)购自中国科学院上海实验动物中心;Eagle′s液(批号:GNM-14266)购自上海经科化学科技有限公司;Ⅱ型胶原酶(批号:S10054)购自上海源叶生物科技有限公司;双荧光素酶报告基因检测系统(批号:E1910)购自美国Promega公司;兔抗人肿瘤坏死因子受体相关因子(TRAF)6多克隆抗体(批号:PAB12896)、兔抗人GAPDH多克隆抗体(批号:PAB1187)购自上海煊翎生物科技有限公司;胎牛血清(批号:10099-141)、DMEM培养基(批号:31053028)、胰蛋白酶(批号:20230)购自赛默飞世尔科技有限公司;Lipofectamine 2000转染试剂(批号:11668027)购自美国Invitrogen公司;人肿瘤坏死因子(TNF)α酶联免疫吸附试验(ELISA)试剂盒(批号:K4779)、白细胞介素(IL)-6 ELISA检测试剂盒(批号:583361)、IL-1β ELISA检测试剂盒(批号:583311)购自武汉艾美捷科技有限公司;TaKaRa反转录试剂盒(批号:RR047A)、TaKaRa实时荧光定量-聚合酶链反应(RT-qPCR)试剂盒(批号:RR820A)购自宝生物工程(大连)有限公司;Hoechst 33342染色剂(批号:C0030)、Trizol试剂(批号:15596)、二喹啉甲酸(BCA)试剂盒(批号:PC0020)、聚偏氟乙烯(PVDF)膜(批号:BSP0161)、4% 多聚甲醛(批号:P1110)、放射免疫沉淀法(RIPA)裂解液(批号:R0020)购自北京Solarbio公司;MCO-18AC型CO2培养箱购自日本SANYO公司;流式细胞仪购自美国BD公司;NanoDrop微量核酸测定仪购自上海创萌生物科技有限公司;荧光显微镜购自上海炳宇光学仪器有限公司。
1.2动物模型制备 将20只SD大鼠随机分为健康组、模型(VMC)组各10只。参照蒋娜等〔10〕实验方法,将大鼠培养于无特定病原体环境中,给予普通饲料喂养。模型组大鼠腹腔注射0.1 ml含1×102TCID50 CVB3 Eagle液建立VMC模型,对照组大鼠腹腔仅注射0.1 ml不含病毒的Eagle液,所有大鼠注射频率均为1次/d,共3 w。注射结束后处死大鼠,迅速摘取心脏并放入液氮,用于细胞分离与总RNA提取。
1.3心肌细胞分离培养与分组 取适量VMC组大鼠心脏组织,无菌条件下切成1 mm3左右的组织块,磷酸盐缓冲液(PBS)洗涤3次。加入0.25%胰蛋白酶,37℃恒温孵育20 min,离心弃上清;加入0.2%Ⅱ型胶原酶孵育4 h,120目筛过滤,PBS洗涤。含10%胎牛血清的DMEM培养基于37℃、5% CO2条件下培养心肌细胞,2~3 d更换新鲜培养基。将对数期生长的心肌细胞接种于6孔板,细胞融合度约50 % 时,按照Lipofectamine 2000转染试剂说明书分别将模拟物对照、miR-506-3p模拟物、miR-506-3p抑制剂转染至心肌细胞,依次标记为对照组、miR-506-3p组、anti-miR-506-3p组,常规培养24 h。
1.4RT-qPCR 收集健康组、VMC组大鼠心脏组织和对照组、miR-506-3p组、anti-miR-506-3p组细胞,采用Trizol法提取总RNA,NanoDrop微量核酸测定仪检测RNA纯度和浓度。按照TaKaRa反转录试剂盒说明书将RNA反转录成cDNA,使用TaKaRa RT-qPCR试剂盒配制反应体系,以GAPDH为内参进行PCR扩增。miR-506-3p引物:上游:5′-ACACTCATAAGGCACCCTTC-3′,下游:5′-TCTACTCAGAAGGGGAGTAC-3′;TRAF6引物:上游:5′-CCCAATTCCATGCACATTCAGTA-3′,下游:5′-AACAGCCTGGGCCAACATTC-3′;GAPDH引物:上游:5′-GGTGGTCTCCTCTGACTTCAACA-3′,下游:5′-GTTGCTGTAGCCAAATTCGTTGT-3′。每个RNA样品重复3次,采用2-△△Ct法计算miR-506-3p相对表达量。
1.5心肌TNF-α、IL-6、IL-1β含量测定 收集对照组、miR-506-3p组、anti-miR-506-3p组细胞,胰酶消化并重悬,超声粉碎后离心取上清。分别使用试剂盒检测。
1.6细胞凋亡检测 收集对照组、miR-506-3p组、anti-miR-506-3p组细胞,4℃,12 000 r/min离心10 min,4%多聚甲醛固定20 min;PBS洗涤后加入Hoechst 33342染色剂,室温孵育20 min,PBS洗涤,使用荧光显微镜观察并记录细胞凋亡情况。
1.7双荧光素酶报告基因实验 取分离培养的VMC组大鼠心肌细胞,使用Lipofectamine 2000转染试剂将TRAF6 3′-UTR野生型载体分别与模拟物对照、miR-506-3p抑制剂、模拟物抑制剂、miR-506-3p抑制剂共转染,继续培养48 h;加入细胞裂解液裂解细胞,4℃,12 000 r/min离心10 min取上清,使用双荧光素酶报告基因检测系统检测荧光素酶活性。
1.8Western印迹法 取对照组、miR-506-3p组、anti-miR-506-3p组细胞,加入含蛋白酶抑制剂的RIPA裂解液于冰上裂解细胞,4℃,12 000 r/min离心20 min,收集上清。取50 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后将蛋白样品电转至PVDF膜上,5%脱脂奶粉TBST液室温封闭1 h。分别加入兔抗人TRAF6多克隆抗体(1∶500)和兔抗人GAPDH多克隆抗体(1∶5 000),分别加入相应的一抗(1∶1 000),4℃孵育过夜,洗膜后加入辣根过氧化物酶(HRP)标记的二抗(1∶5 000)室温孵育2 h,洗涤,使用电化学发光试剂盒显示条带,每个蛋白样品重复3次。
1.9统计学分析 采用SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-506-3p在大鼠心肌组织中的表达 VMC组大鼠心脏组织中miR-506-3p相对表达水平(1.00±0.12)显著低于健康组大鼠心脏组织(0.53±0.05,P<0.05)。
2.2miR-506-3p在心肌细胞中的表达 与对照组(1.00±0.08)相比,miR-506-3p模拟物组细胞中miR-506-3p表达(7.78±0.39)显著上调(P<0.05);anti-miR-506-3p组细胞中miR-506-3p表达(0.43±0.06)显著下调(P<0.05)。
2.3miR-506-3p调节TNF-α、IL-6、IL-1β水平 与对照组比较,miR-506-3p模拟物组细胞上清液中TNF-α、IL-6、IL-1β水平降低(P<0.05);anti-miR-506-3p组细胞上清液中TNF-α、IL-6、IL-1β水平升高(P<0.05)。见表1。
2.4miR-506-3p调控心肌细胞凋亡 对比对照组〔(7.43±0.69)%〕,转染miR-506-3p模拟物的VMC组大鼠心肌细胞凋亡率〔(4.66±0.53)%〕明显降低(P<0.05);而转染miR-506-3p抑制剂的VMC组大鼠心肌细胞凋亡率〔(17.31±1.12)%〕明显升高(P<0.05)。
2.5TRAF6是miR-506-3p的潜在靶基因 通过Targetscan在线预测发现,TRAF6 3′-UTR上存在miR-506-3p的结合位点(图1),猜测TRAF6是miR-506-3p的潜在靶基因。进一步使用双荧光素酶报告基因实验进行验证,发现TRAF6 3′-UTR野生型载体与miR-506-3p模拟物共转染的细胞中荧光素酶活性(0.46±0.05)显著降低(P<0.05);而TRAF6 3′-UTR野生型载体与miR-506-3p抑制剂共转染的细胞中荧光素酶活性(1.41±0.12)显著增强(P<0.05)。
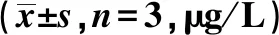
表1 miR-506-3p调节TNF-α、IL-6、IL-1β水平
与对照组比较:1)P<0.05;下表同

图1 TRAF6 3′-UTR与miR-506-3p的互补序列
2.6miR-506-3p可负调控心肌炎细胞中TRAF6表达 在VMC组大鼠心肌细胞中,与对照组比较,miR-506-3p模拟物组TRAF6在mRNA和蛋白水平的表达显著下调(P<0.05),anti-miR-506-3p组TRAF6在mRNA和蛋白水平的表达显著上调(P<0.05)。见图2、表2。
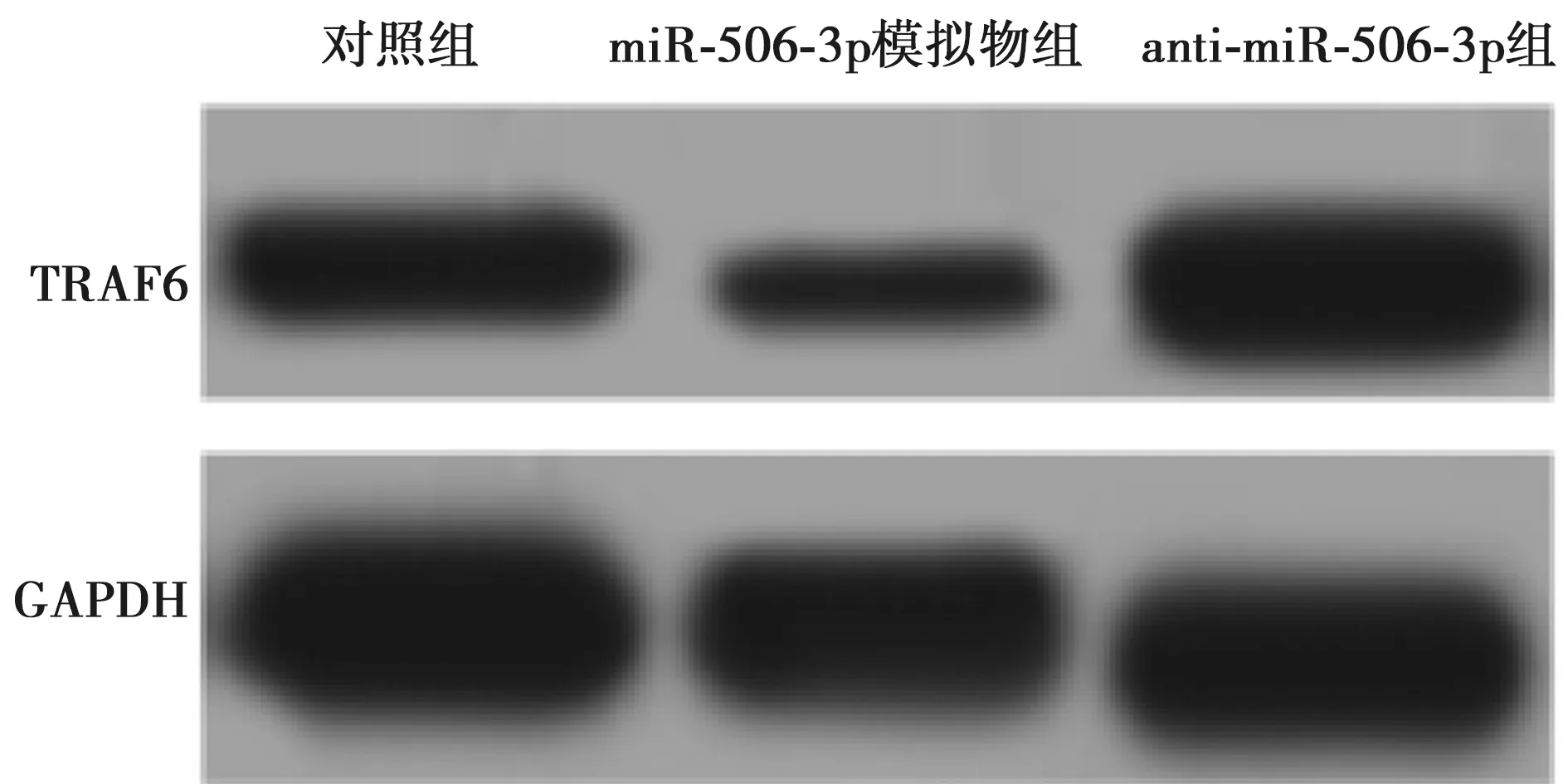
图2 各组细胞中TRAF6蛋白凝胶电泳图

组别TRAF6 mRNATRAF6蛋白对照组1.00±0.070.52±0.04miR-506-3p模拟物组0.56±0.051)0.19±0.031)anti-miR-506-3p组3.48±0.311)0.82±0.071)
3 讨 论
VMC是病毒感染引起的心肌弥漫性或局灶性疾病,目前已知其发病机制主要包括免疫反应、氧化作用、遗传背景、病毒直接作用4个方面〔11〕。CVB与心肌细胞表面特异受体结合,从而感染细胞;宿主识别入侵病毒而产生免疫反应,诱导细胞凋亡并刺激产生TNF-α、IL、转化生长因子等大量细胞因子,促进细胞炎性反应〔12,13〕。TNF-α在炎性反应中起始动作用,可诱导IL-1、IL-6等细胞因子,加速B细胞和T细胞增殖,提高免疫球蛋白水平,是单核巨噬细胞被活化后分泌的一种炎性细胞因子〔14〕。已有研究表明,TNF-α、IL-6、IL-1β水平的降低能够缓解炎性反应〔15〕。
miRNA广泛存在于真核生物中,具有高度保守性,可通过下游靶基因调控多种疾病进展。Rebane等〔16〕研究表明,miR-146a能够抑制TNF-α、IL-1β等多种炎性因子表达,缓解炎性反应。Jiang等〔17〕研究表明,miR-155在丙型肝炎病毒引起的免疫应答和炎性反应中发挥抑制作用,其机制与转化生长因子β、IL-10有关。提示,应深入研究miRNA在免疫应答及炎性反应中的作用机制,可能为miRNA在炎性疾病的诊断和治疗中提供理论基础。miR-506定位于X染色体,是近年来新鉴定的一种RNA分子,有报道称,miR-506在肿瘤发展中发挥抑制作用,miR-506在多种肿瘤组织中表达下调,可调节多个下游靶基因,调控细胞增殖、迁移和侵袭〔18,19〕。其家族成员之一的miR-506-3p已被证实在非小细胞肺癌组织中表达下调,通过抑制细胞迁移、侵袭发挥抑癌功能〔20〕。
TRAF6是TNF受体超家族和IL-1受体信号转导的关键衔接分子,可激活核转录因子(NF)-κB等信号通路,调控胚胎发育、骨代谢、炎性反应、氧化应激、免疫应答等生物学过程〔21〕。Zhu等〔22〕研究表明,TRAF6通过调节IL-1β,IL-8,IL-6,TNF-α等炎性因子水平,参与调控类风湿性关节炎炎性反应;Aarts等〔23〕研究表明,抑制TRAF6后,细胞活性氧、IL-6和TNF水平降低,改善了神经炎性反应。
在心肌炎的相关研究〔24,25〕中,TRAF6已被证实与心肌炎性反应有关,抑制TRAF6可减轻心肌炎的严重程度。本文验证了TRAF6和miR-506-3p的靶向关系,在VMC模型大鼠心肌细胞中转染miR-506-3p模拟物,TRAF6表达下调(P<0.05);转染miR-506-3p抑制剂则TRAF6表达上调(P<0.05)。
综上,miR-506-3p在心肌炎组织中呈低表达,过表达miR-506-3p可减缓心肌细胞炎性反应并抑制细胞凋亡,其机制可能与抑制TRAF6表达从而降低促炎因子TNF-α、IL-6、IL-1β水平有关。这一研究结果为心肌炎的诊断与治疗提供理论基础。

