鲍曼不动杆菌对多黏菌素类抗菌药物耐药现状及机制研究进展
王宇航 蔡 芸
(1 解放军医学院,北京 100853;2 解放军总医院药物临床研究中心,北京 100853)
鲍曼不动杆菌(Acinetobacter baumannii, AB)属于非发酵的革兰阴性菌,广泛存在于自然环境以及人体皮肤、消化系统、泌尿系统等[1]。有研究表明,由于AB可形成生物膜,使之能够抵抗干燥剂和消毒剂,长期存活在医护人员的指尖、各种医疗器械的表面,从而导致机体反复感染、互相传播[2]。近年来,由AB引起的院内感染逐渐增多,特别是由于抗菌药物的大量使用,多重耐药(multidrug resistance, MDR)、广泛耐药(extensive drug resistance, XDR)AB检出率也不断增加,成为临床的棘手问题[3]。
多黏菌素类抗菌药物(polymyxins)是由多黏芽孢杆菌产生的一组有A、B、C、D、E等组分的环肽类抗生素[4]。临床应用上市的产品主要是多黏菌素B(polymyxin B, PMB)和多黏菌素E(colistin)的硫酸盐和甲磺酸盐。Polymyxins是浓度依赖性抗生素,有一定的抗生素后效应,其抗菌活性与浓度-时间曲线下面积和最低抑菌浓度的比例(AUC/MIC)相关[5]。Polymyxins的抗菌机制主要是其Dab(L-Rγ-diaminobutyric acid)残基上游离的氨基发生质子化作用,与存在于细菌外膜(OM)上脂多糖(LPS)的脂质A磷酸根阴离子发生静电吸引,优先占据Mg2+和Ca2+的阳离子结合位点使外膜膨胀;随后借助自促摄取机制(self-promoted uptake mechanism)穿过外膜,与细菌胞浆膜中脂蛋白的游离磷酸根结合,同时polymyxins的六七位疏水部分和N-脂肪酰基链插入到外膜层,使相邻的脂质A的脂肪酰基链的堆积力减弱,破坏细胞膜磷脂双分子层的物理完整性,降低胞浆膜的表面张力,增加其通透性,导致胞浆膜失去屏障作用而使菌体内的嘌呤、嘧啶、核苷酸等外流,细菌死亡[6-7]。膜完整性的破坏会导致细菌对疏水性抗菌药物的敏感性提高(如红霉素),这为联合用药提供了理论依据[8]。另有研究提示[9]产生羟基自由基、抑制Ⅱ型 NADH-泛醌氧化还原酶[10]等也是polymyxins对AB的杀菌作用机制。
起初,严重肾毒性和神经毒性使polymyxins的临床应用受到限制,然而,近年来MDR革兰阴性菌的泛滥,而polymyxins对其仍有较高的敏感性,重新成为临床治疗革兰阴性菌的重要选择。但随着polymyxins的临床应用的增加,AB对polymyxins耐药报道也时有出现,相关耐药机制的研究也成为热点。本文对近年来国内AB对polymyxins耐药报道以及耐药机制进行综述,以期对临床合理应用polymyxins,保持其抗菌活性提供参考。
1 AB对polymyxins耐药现状
1.1 国内耐药现状
总体而言,我国大型耐药监测结果显示AB对polymyxins仍保持低耐药特点。CHINET监测网2011—2017连续对国内主要地区34所医院细菌耐药性监测,2011和2012年不动杆菌属(AB占80%以上)对colistin耐药率分别为6.3%(监测总数6723株)和2.6%(8739株),随后两年的耐药率为0,之后未再报道耐药结果;对PMB的耐药率始终保持在2%以下,仅在2016年上升至6.5%[11-14]。 但MDR AB对PMB耐药率报道并不一致。重医第一附属医院2006—2009年对MDR AB耐药监测发现其对PMB耐药达到11.7%(178株)[15]。而河南驻马店市中心医院2009—2013年共2356株XDR AB结果显示对PMB耐药率均低于2%,与CHINET结果相似[16]。
1.2 其他国家地区现状
其他国家地区AB对polymyxins也总体呈低耐药特点,但某些地区MDR AB对colistin耐药率较高。2013年一项46个国家171个医疗中心的研究显示[17]:美国、欧盟、环太平洋地区AB(共1332株)、MDR AB(共1070株)、XDR AB(共943株)对colistin敏感率均在95%以上。表1显示了近年来部分国家AB对colistin的耐药情况。而AB对PMB的耐药率大部分低于10%,仅伊朗和美国部分年份分别达到了16%和12.8%[18-23]。
2 耐药机制
细菌对polymyxins的耐药性可以通过突变或适应而产生。前者是原发性的,通常表现为低水平耐药。后者需要抗菌活性的持续存在,常为高水平耐药[39]。目前文献报道的AB对polymyxins耐药机制主要包括PmrAB两组份调节系统介导的LPS修饰、脂质A生物合成基因的突变或者缺失、外排泵系统的活化以及生物膜形成。
2.1 PmrAB两组份调节系统介导的LPS修饰
LPS是polymyxins最初作用靶点[40]。双组分调节系统PmrAB的改变能引起LPS重构,形成带负电荷少的脂质A,从而降低了polymyxins与LPS的结合能力[41]。耐药的细菌突变体pmrA表达增加,激活了PmrA,其又能调控pmrCAB启动子[42]。pmrA或pmrB的突变以及过表达能够导致磷酸乙醇胺(pEtN)增加到脂质A上,脂质A随即出现七酞化。这主要与pmrAB基因上游编码pEtN转移酶基因的pmrC基因被激活有关[43]。另外,pmrB的激活突变导致NaxD过度表达,介导具有带正电荷的氨基半乳糖(GalN)的AB脂质A的修饰[39]。LPS被修饰后其所带负电荷减少,在低Mg2+、 Ca2+和低pH值环境下,polymyxins中带正电荷的侧链与脂多糖静电反应减少或无法进行静电反应,从而导致细菌对polymyxins出现耐药。
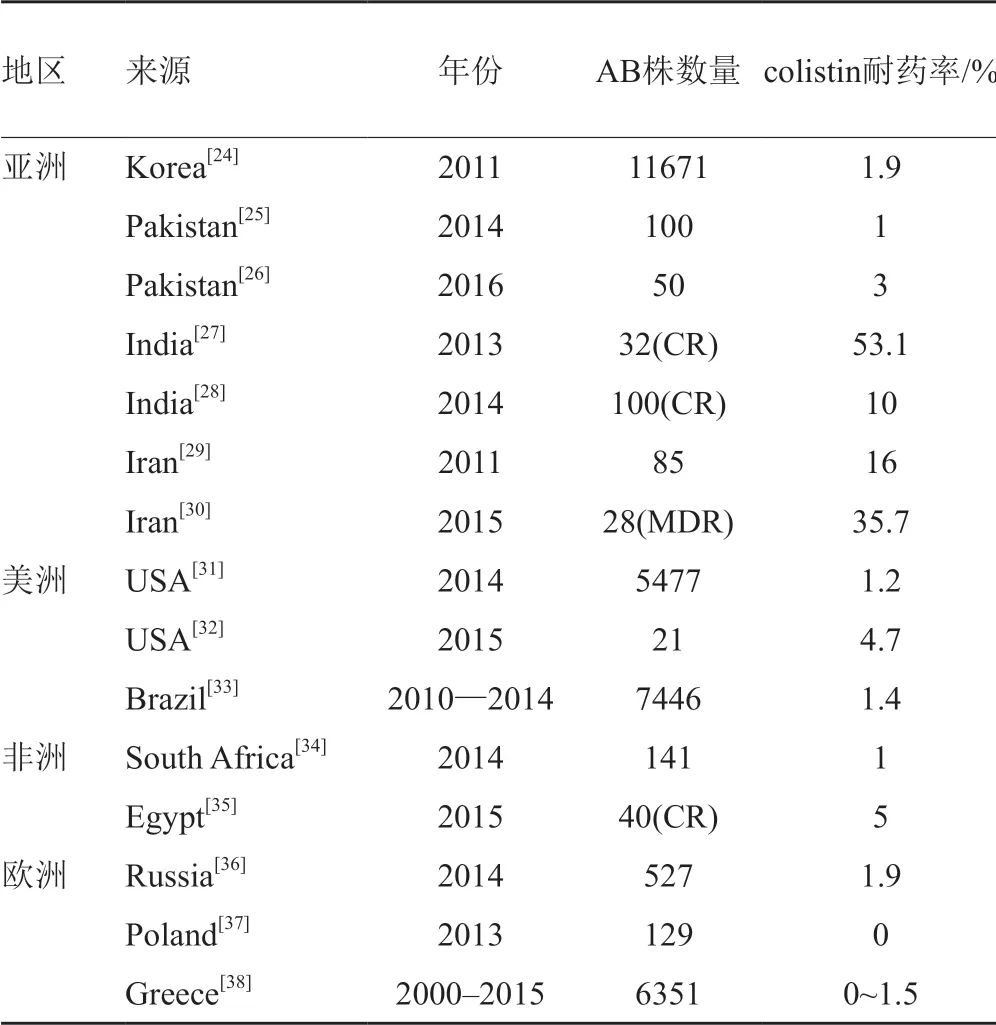
表1 部分国家鲍曼不动杆菌对colistin耐药率Tab.1 Resistance rates of Acinetobacter baumannii to colistin in some countries
2.2 脂质A生物合成、修饰相关基因的突变或者缺失
脂质A生物合成的基因lpxA、lpxC、lpxD突变能导致AB脂质A生物合成途径失活,外膜蛋白产生变化,对polymyxins的亲和力下降,从而造成对polymyxins的高度耐药[44]。ISAba125基因编码H-NS蛋白家族(转录调控因子),当H-NS蛋白被修饰或失活时,AB表现出对colistin更强的抵抗力。H-NS突变体eptA表达增加,eptA能够编码pEtN转移酶,pEtN转移酶的作用是将pEtN 添加到脂质A上[45]。
2.3 广谱外排泵系统的活化
外排泵能将有毒的底物,包括抗生素、代谢物大量泵出,从而调节细胞的内部环境。目前认为RND蛋白家族与非RND蛋白家族广泛存在于AB外排泵上,polymyxins对RND家族中AcrAB-TolC、AdeABC以及非RND家族的NorM有很强的亲和力[46]。有报道称暴露于colistin的菌株,AdeABC、AdeIJK、 macAB-tolC的表达发生了上调,导致相应的外排泵增强[47]。Lin等[48]发现Emr外排泵使AB对colistin产生耐药。
2.4 生物膜的形成
处于生物膜状态的细菌更能抵抗抗菌药物的杀菌效应,表现出耐药性。生物膜可减少药物渗透,吸附抗菌药物钝化酶,使抗菌药物失效,造成免疫逃逸效应,使菌体逃脱机体免疫系统的识别。有报道显示,处于生物膜状态的AB对于colistin的MIC是其游离态至少8倍[49]。还有研究发现亚抑菌浓度(1/2 MIC)的colistin对MDR AB的生物膜形成具有一定的诱导作用[50]。
3 应对策略
由于polymyxins毒性较大,针对其耐药的菌株所致感染不可能无限制提高临床应用剂量。因此,除根据药敏选择相对敏感的药物外,联合用药成为主要应对措施。最常见的是抗菌药物之间的联合应用。体外研究发现colistin与四环素类、喹诺酮类、碳青霉烯类、替加环素以及某些酶抑制剂联用均能产生协同效应[51-53]。一项最新发表的随机对照临床研究显示,对于colistin耐药AB所致的肺部感染,colistin与利福平联用能够获得更佳的微生物清除率,但临床治愈率二者差别不大[54]。2018年一项网络荟萃分析全面比较了MDR和XDR AB感染患者各类抗菌药物联用治疗方案的有效性和安全性。研究发现colistin与舒巴坦的联合治疗在微生物治愈方面表现出优势,其安全性与colistin单一疗法类似。尽管没有统计学差异,但使用colistin、舒巴坦和替加环素的三联疗法显示出了最高的临床治愈率[55]。
4 结语
AB的临床检出率逐年增高,多重耐药情况也日趋严重,多黏菌素类药物以其低耐药率被认为是对抗MDR AB的最后防线。但随着生产生活各方面多黏菌素类药物的广泛使用,多黏菌素类耐药AB的出现需要引起警惕,应合理使用抗菌药物的并密切监控耐药情况,以防止这一最后防线的失效。目前,AB针对多黏菌素类药物的耐药机制研究还相对较少,进一步的深入研究对于克服其耐药性具有重要意义。

