广西茅尾海红树林根围淤泥放线菌多样性及抗菌活性
郑红芸 吴越 叶景静 卢覃培 李飞娜 陈建宏 蒋莲秀 刘少伟 何义 孙承航,* 黄大林,*
(1 桂林医学院基础医学院,桂林 541004;2 中国医学科学院,北京协和医学院 医药生物技术研究所,北京 100050)
临床不断出现的耐药细菌迫切需要新抗生素,抗生素的直接来源为微生物次级代谢产物,如超过40%的次级代谢产物由放线菌产生[1-2]。由于从普通陆地来源微生物中发现新活性次级代谢产物越来越困难,迫使我们从以前研究较少的海洋[3]、热泉[4-5]、红树林[6]、沙漠[7-8]、极地[9]等特殊环境中寻找产生新抗生素的药用微生物资源。
红树林微生物资源丰富且多样新颖,据统计,1998—2017年2月,分离自红树林植物、沉积物及土壤或淤泥内的放线菌新物种数量达73个以上[10],为我们筛选发现活性次级代谢产物提供了丰富新颖的微生物资源。广西红树林资源丰富,占全国红树林面积的25.47%[11]。其中真红树植物有白骨壤、桐花树、秋茄、红海榄、木榄、海漆、老鼠簕、银叶树和无瓣海桑(引种),还包括半红树植物及伴生植物(茅尾海红树林的伴生植物为互花米草[12])。本实验室前期对广西北仑河口国家红树林自然保护区的红树林根围淤泥放线菌[13-14]进行了研究,发现了一些具有抗菌及抗肿瘤活性的放线菌潜在新物种。经文献调研,广西茅尾海红树林保护区植物根围淤泥中放线菌的研究很少,为此,本研究针对广西钦州茅尾海红树林自然保护区中的坚心围与康熙岭片区开展了放线菌多样性、新颖性和抗菌活性的研究。
1 材料与方法
1.1 材料
1.1.1 土壤样品
2017年9月,从广西茅尾海红树林自然保护区(省级)的坚心围与康熙岭片区不同红树植物根围下10cm左右采集8份淤泥样品于保鲜袋内并在一周内带回实验室,在4℃冰箱内保存,样品详细信息见表1。
1.1.2 培养基
(1)10种分离培养基及其配方:M1(棉子糖组氨酸培养基):棉子糖5g,L-组氨酸1g,KNO31g,NaCl 1g,CaCl22g,K2HPO41g,MgSO4·7H2O 1g,琼脂20g,海水600mL,蒸馏水400mL,pH7.2。
M2(ISP2培养基):葡萄糖4g,酵母粉4g,麦芽浸粉10g,琼脂15g,蒸馏水1000mL,pH7.2。
M3(GPT):葡萄糖10g,蛋白胨5g,胰蛋白胨3g,NaCl 5g,琼脂15g,蒸馏水1000mL,pH7.2~7.4。
M4(改良的高氏二号培养基):葡萄糖1g,蛋白胨0.1g,胰蛋白胨0.06g,NaCl 0.5g,海水500mL,蒸馏水500mL,pH7.2。
M5(海藻糖-脯氨酸培养基):海藻糖5g,脯氨酸1g,(NH4)2SO41g,NaCl 1g,CaCl22g,K2HPO41g,MgSO4·7H2O 1g,复合维生素1mL,琼脂18g,土壤浸汁30mL,海水500mL,蒸馏水500mL,pH 7.2。
M6(R2A培养基):BD公司合成培养基18.2g,土壤浸汁30mL,海水500mL,蒸馏水500mL,pH7.2。
M7(ISP7培养基):甘油15g,L-酪氨酸0.5g,L-天冬氨酰1g,K2HPO40.5g,MgSO4·7H2O 0.5g,NaCl 0.5g,FeSO40.01g,微量元素1mL,琼脂15g,海水400mL,蒸馏水600mL,pH7.2。
M8(M9培养基):精氨酸1.0g,甘油6mL,复合维生素1mL,微量盐1mL,琼脂15g,土壤浸汁30mL,海水400mL,蒸馏水600mL,pH7.2。
M9[淀粉酪素培养基(筛选嗜盐或耐盐菌)[15-16]]:可溶性淀粉10g,干酪素0.3g,KNO32g,MgSO4·7H2O 0.05g,NaCl 30g,K2HPO42g,CaCO30.02g,FeSO410mg,琼脂15g,土壤浸汁30mL,蒸馏水1000mL,pH7.2。
M10(ISP5培养基):L-天门冬酰胺1g,甘油10g,K2HPO41g,微量盐1mL,琼脂15g,土壤浸汁30mL,蒸馏水1000mL,pH7.2。
(2)纯化用培养基:ISP2和R2A琼脂培养基。
(3)发酵选择性培养基:ISP2和R2A液体培养基。
(4)检定菌培养基:Mueller-Hinton(M-H)培养基(英国Oxoid)用于培养金黄色葡萄球菌、粪肠球菌、大肠埃希菌、鲍曼不动杆菌、肺炎克雷伯菌和铜绿假单胞菌、白念珠菌和罗伦隐球菌。肠球菌用BHI培养基(英国Oxoid)培养。
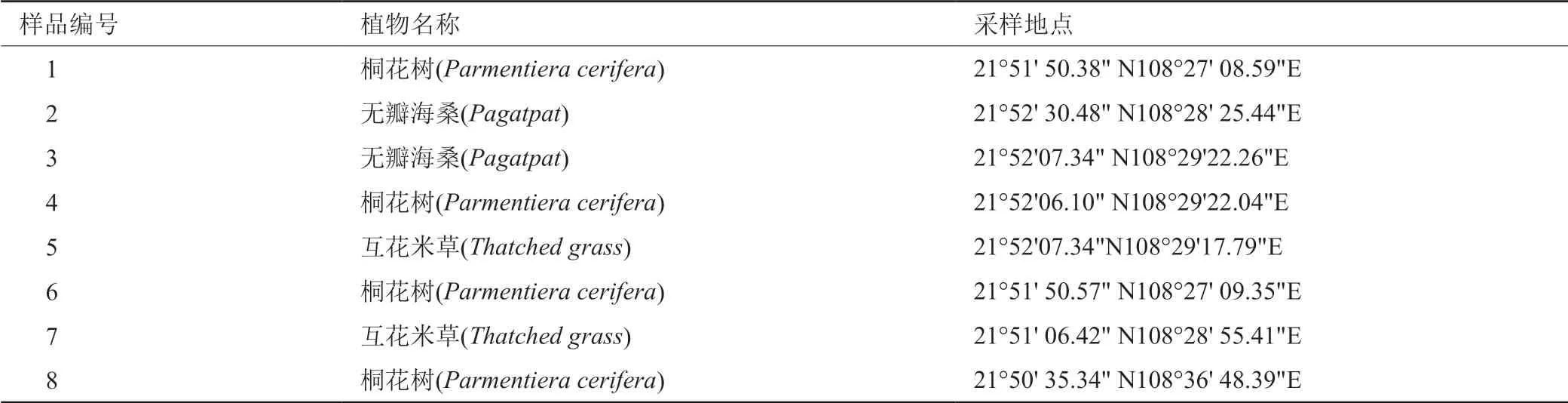
表1 红树林植物根围淤泥样品信息Tab.1 Information of samples collected from mud of mangrove plant rhizophere
1.1.3 抑制剂
杂菌抑制剂选用放线菌酮、重铬酸钾和萘啶酮酸,终浓度分别为50.0、25.0和25.0mg/L。待培养基温度降到50℃左右时滴入并混匀。
1.1.4 检定菌株
敏感菌株与耐药菌株[17]:铜绿假单胞菌敏感株(Pseudomonas aeruginosa)ATCC27853和耐药株2774、金黄色葡萄球菌(Staphyloccocus aureus)敏感株ATCC25923和耐药株ATCC43300、大肠埃希菌(Escherichia coli)敏感株ATCC25922和耐药株2800、肺炎克雷伯菌(Klebsiella pneumoniae)敏感株ATCC10031和耐药株ATCC700603、粪肠球菌(Enterococcus faecalis)敏感株ATCC33186、鲍曼不动杆菌(Acinetobacter baumannii)敏感株ATCC19606和 耐药株2799,以上菌株均为中国医学科学院医药生物技术研究所保藏;肠球菌(Enterococcus faecalis)耐药株VRE310681由广东汕头大学提供;真菌:白色念珠菌(Candida albicans)CCTCC93025和罗伦隐球菌(Cryptococcus laurentii)CCTCC91013购于武汉大学中国典型培养物保藏中心。
1.1.5 仪器及试剂
PCR引物(27F, 1492R)与萘啶酮酸购于上海生工生物工程股份有限公司;DNA提取用Chelex100树脂购于美国BioRad公司;2×EasyTaqSupermix、放线菌酮购于北京全式金生物技术有限公司;其他试剂均为国产分析纯。
Autoclave MLS-3750型高压蒸汽灭菌锅,日本Sanyo公司;ABI Veriti96-well fast thermal cycler PCR扩增仪,美国Applied Biosystems公司;YT-CJ-1ND超净工作台,北京亚泰科隆仪器有限公司;小型离心机Centrifuge1-14,德国Sigma公司;旋转蒸发仪OSB-2100,日本Eyela公司;电泳仪DYY-6C,北京市六一仪器厂;全恒温培养箱ZDP-2120和旋转式摇床ZHWY-211C,上海智城分析仪器制造公司。
1.2 菌株获得及活性检测方法
1.2.1 土壤样品的处理和涂布
参考吴越等[13]样品处理方法,将新鲜根围淤泥放于无菌平皿中并作好标记,室温条件超净台内自然风干后,用无菌研钵处理干泥块成粉末状。分别称取不同地点的土样粉末5g于45mL无菌水中溶解,加入无菌玻璃珠,180r/min,28℃摇床回旋振荡6h;静置后,吸取1mL土样悬液于9mL无菌水中,然后10倍稀释成4个梯度,选择终浓度为10-2、10-3和10-4g/mL的样品,分别吸取0.2mL于10种不同分离培养基平皿内,进行涂布,打包后,置28℃恒温培养箱培养。
1.2.2 菌株的分离纯化与保存
分离菌株:培养1~3周左右并观察菌落的形态以及生长情况,判断形态似放线菌的可见菌落进行标记,然后用竹签挑取单菌落于改良ISP2固体培养基 或R2A培养基内划线纯化,直至得到单菌落。
菌株的保存:纯化菌株转接于牛奶管,冻干后于4℃贮存;转接于20%甘油保存于-20℃。
1.2.3 16S rRNA基因序列的测定和系统发育学分析
(1)Chelex-100法[18]提取基因组DNA,纯化菌株参考Walsh等[19]的方法进行PCR扩增。扩增引物为通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。PCR反应体系:引物量均为1.5μL;底物为1.5μL;2×EasyTaqsupermix 25μL;ddH2O 20.5μL;总体积50μL。PCR反应条件:95℃预变性5min;94℃变性1min,55℃复性1min,72℃延长2min,35个循环完成,72℃后延长10min。
(2)PCR产物经1%琼脂糖凝胶电泳检测验证后,扩增片段在1400~1500bp的扩增产物交由生工生物工程(上海)股份有限公司测序。
(3)登录EzBiocloud和NCBI两个数据库对所获16S rRNA基因序列进行比对。将高相似率且有效发表的菌株的16Sr RNA作为参比对象,然后采用Clustal W[20]进行多序列联配,用MEGA 7.0软件[21]采用邻接法(Neighbor-Joining)进行聚类分析,并构建系统进化树[22],系统进化矩阵根据Kimura-2-parameter[23]模型估计,重复取样1000次进行自展值(bootstrap value)分析以此来评估系统进化树拓扑结构的相对稳定性。
1.2.4 发酵粗提物抗菌活性检测
(1)待测液的制备:筛选出的发酵菌株生长于对数期时接种于装有ISP2液体培养基130mL的500mL锥形瓶中,每株接种3瓶,培养条件为:28℃持续培养6~7d,摇床转速180r/min。高速离心后得到的上清液,使用乙酸乙酯萃取2次,旋蒸浓缩后,适量甲醇溶解回收;水相与菌丝体丙酮浸泡上清液在干燥后用适量的50%甲醇溶液溶解回收备用。
(2)检定菌培养皿的制备:分别接种检定菌于MH和BHI两种液体培养基。培养条件:摇床设36℃、180r/min,持续培养12h。待无菌的MH和BHI琼脂培养基温度降至55℃左右,将生长适宜的菌液按0.8%的比例浓度加入并进行调试,倒入平板后,待其凝固并做标记,置4℃低温贮存备用。
(3)待测液抗菌活性的检测:将有机相、水相和菌丝体丙酮浸泡液3类待测液分别滴加到直径为6mm的无菌滤纸片上,分两次操作完成。10μL左氧氟沙星溶液作为阳性对照,甲醇溶剂作为阴性对照,待加样纸片干燥后贴于检定菌培养皿中,36℃培养箱培养12~24h后观察抑菌效果并使用游标卡尺测量抑菌圈的大小。
2 结果
2.1 广西茅尾海红树林可培养放线菌多样性分析
对361株具有放线菌形态特征的菌株排重后,通过16S rRNA基因测序分析,共筛选获得244株放线菌,分属于5个目14个科29个属,见表2和图1。
8个不同采样地点淤泥来源放线菌的多样性指数、优势度指数与均匀度指数计算结果见表3,采样点S5、S6和S7的Pielou指数、Simpson指数和Shannon-winner指数几乎呈相同的变化趋势;采样点S3、S4、S5、S6、S7和S8之间在多样性上差异较小,多样性指数也较高,说明这6个采样点物种丰富度相对较高,明显优于采样点S1和S2;S6采样点和S7采样点均分离获得了8个属,在多样性指数、优势度指数和均匀度指数上无明显差异。
2.2 广西茅尾海红树林可培养放线菌新颖性分析
经序列比对发现,菌株K7A10-207、S4B6-851、K6A10-57、K7B1-327分别与有效发表菌株Arthrobacter pascensDSM 20545T(X80740)、Amnibacterium kyonggienseKSL51201-037T(FJ527819)、Streptomyces polymachusT258T(KM229363)、Lysinimicrobium pelophilumNBRC 109393T(BBLY01000002)的相似率为97.77%、97.78%、98.30%和98.52%,特别值得注意的是菌株S4B6-851,在邻接法建树中,其与微杆菌科Amnibacterium属中的有效发表菌株聚成一簇,形成独立的进化分支(图2),极可能为一株Amnibacterium属的新物种,该属内目前有Amnibacterium kyonggienseKSL51201-037T(FJ527819)、Amnibacterium endophyticum1T4Z-3T (MG065698)、Amnibacterium soliMB78T(EU432172)3个物种,分别于2011年[24]、2013年[25]和2018年[26]报道,针对该物种,将开展多相分类学工作。

表2 244株放线菌的多样性分布情况Tab.2 Biodiversity and distribution of 244 actinobacteria strain
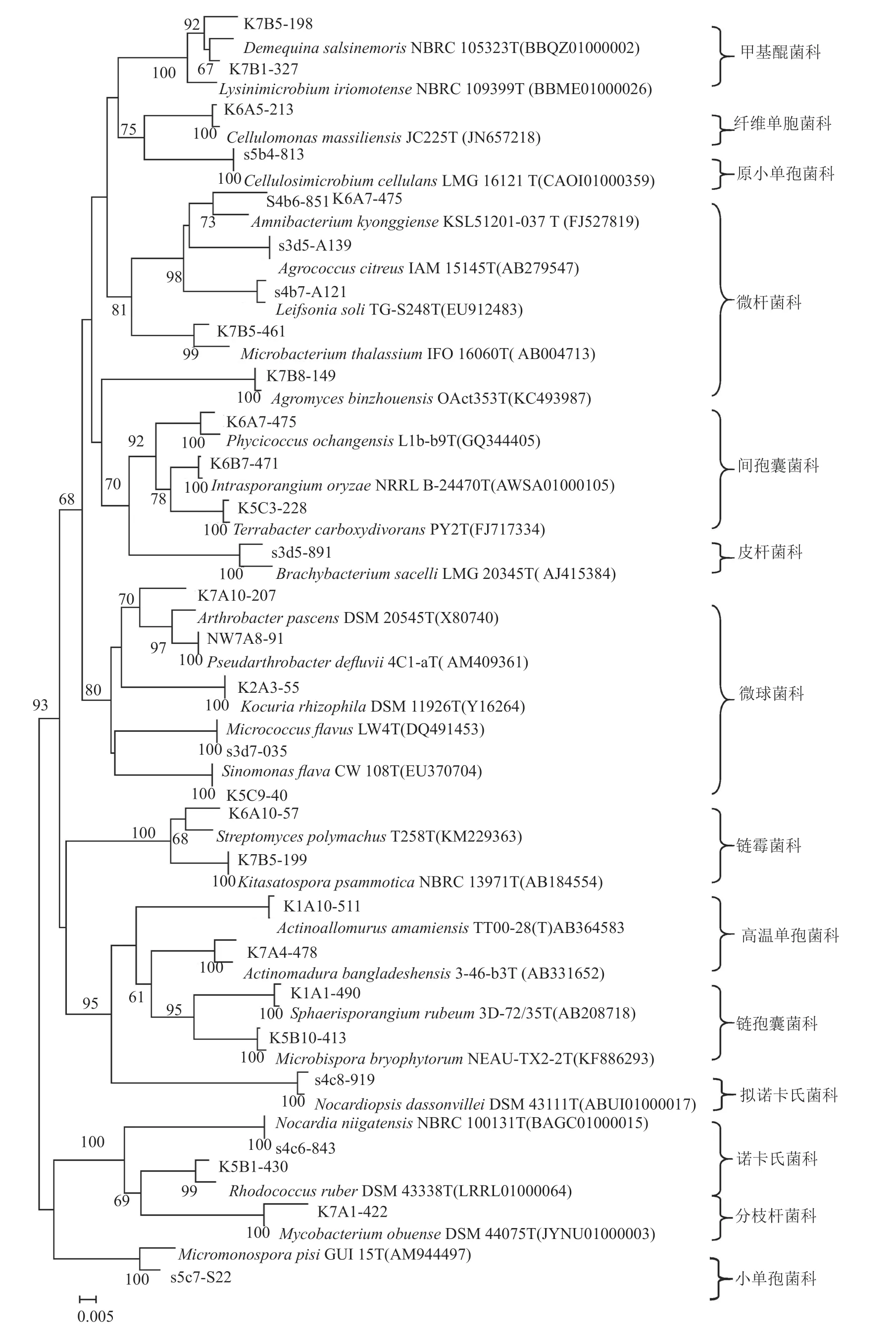
图1 红树林来源部分代表性分离菌株通过16S rRNA基因序列构建的与相近种之间的系统进化树Fig.1 Nerghbour-Joining phylogenetic tree based on 16S rRNA gene sequences, showing the relationships between representative strains and their closely related type strains from mangrove rhizosphere mud
2.3 广西茅尾海红树植物根围土壤样品中放线菌在不同培养基中的分布情况
244株放线菌在不同培养基上的分布情况如图3~4所示。10种选择性培养基中,设计添加土壤浸汁的10号培养基分离到的菌株数最多,其次为添加海水的7号培养基。在8份样品中,坚心围片区内桐花树下的根围土壤8号样品分离出的菌株数最多。其次为康熙岭片区内互花米草下的根围土壤7号样品分离出的菌株数较多,康熙岭片区内无瓣海桑根际下土壤2号样品和互花米草下根围土壤5号样品分离出的菌株数则较少,分别为7株和6株。
2.4 83株放线菌抗菌活性初筛结果
根据培养及形态特征、16S rRNA基因序列比对结果及文献查阅,从244株放线菌中挑选出83株菌进行发酵、萃取,对菌株发酵液的酯相、水相和菌丝丙酮萃取相,共3类样品展开抗菌活性筛选。只要有一类样品抑菌圈直径>0.70cm即计为阳性结果。活性研究结果表明共59株放线菌呈现阳性结果,如图5所示。其中有6株放线菌具有广谱的抗菌活性,抑菌圈直径均大于0.70cm,最大抑菌圈达2.37cm。1株北里孢菌属仅对肠球菌产生了抗菌活性,而且抗菌活性较好,抑菌圈直径达1.33cm。潜在新颖放线菌K7B1-327对铜绿假单胞菌具有抗菌活性,抑菌圈直径为0.86cm。其余活性菌株抗菌活性大部分集中在乙酸乙酯相。
3 结论和讨论

表3 不同采样点放线菌相关多样性指数分析Tab.3 Analysis of actinobacteria diversity index at different sampling points
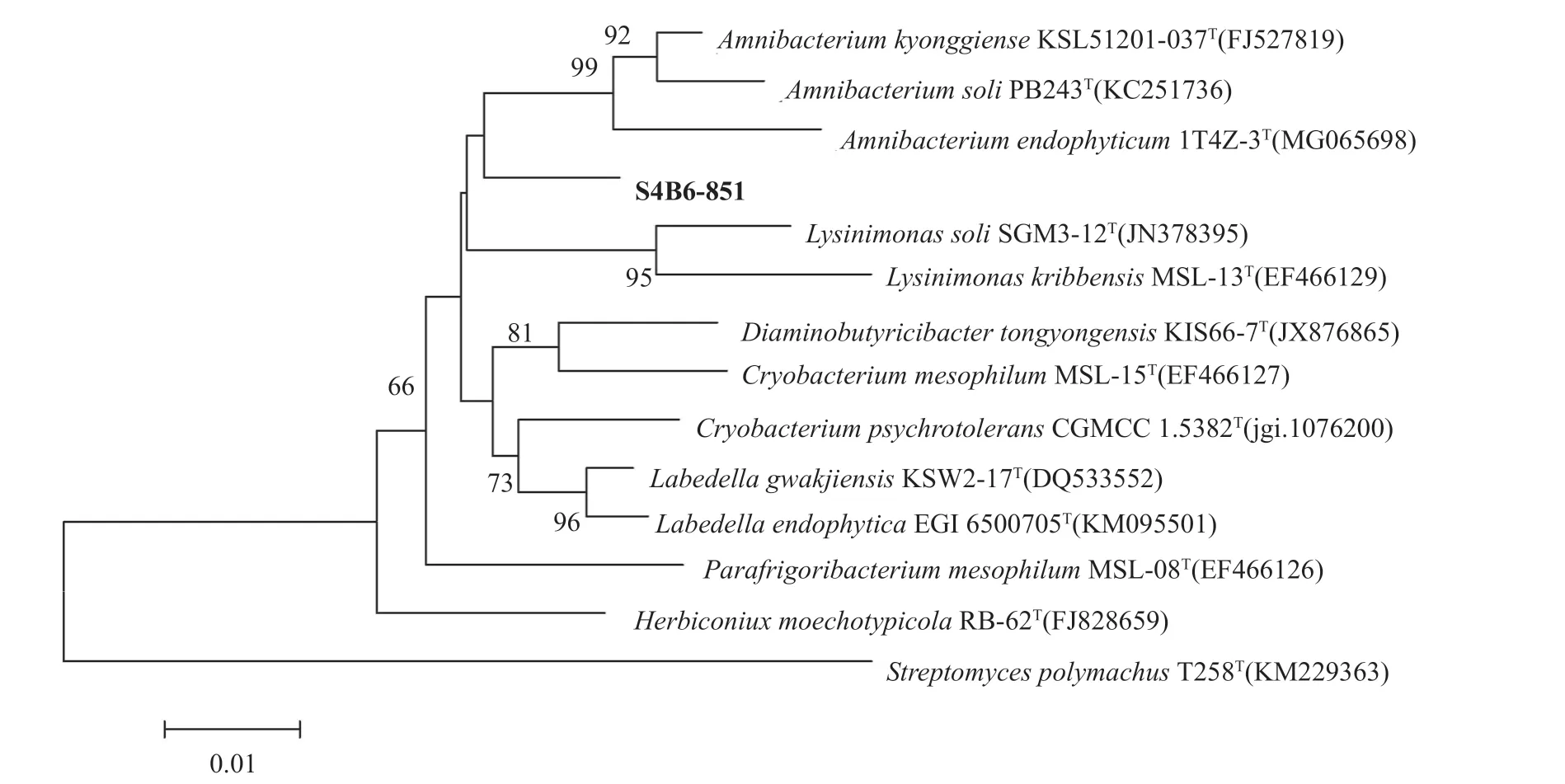
图2 通过16S rRNA基因序列构建的菌株S4B6-851与其相近种的N-J系统进化树Fig.2 Neighbour-Joining tree showing the phylogenetic relationships between strain S4B6-851 and its closely related type strains based on 16S rRNA gene sequences

图3 不同样品和培养基中分离得到的放线菌数量Fig.3 Actinobacterial strains from different samples and different media
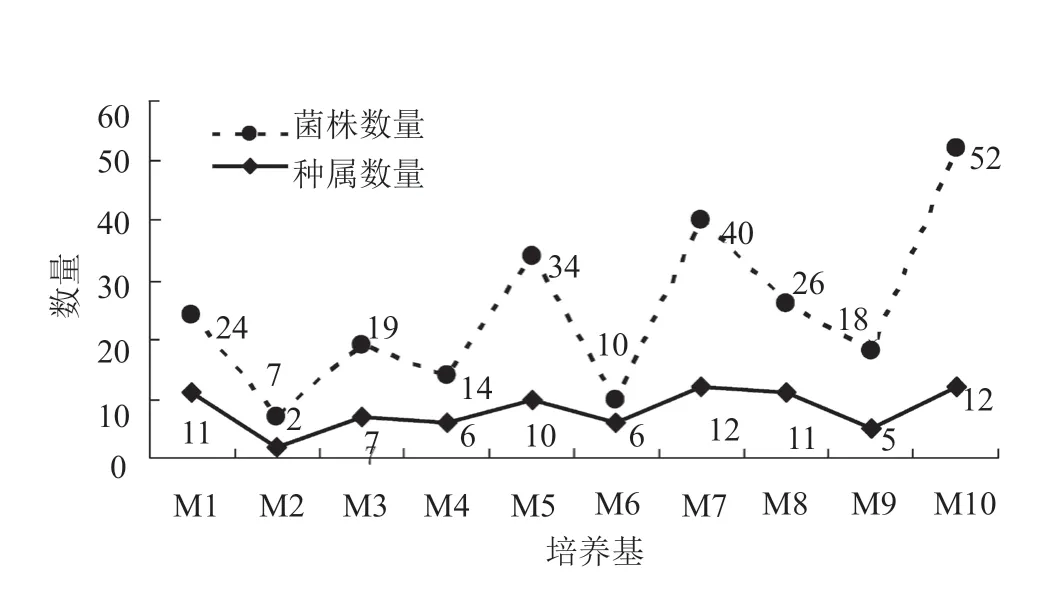
图4 不同培养基分离得到的放线菌属Fig.4 Diversity of actinobacteria isolated from different media
我国广西壮族自治区位于北回归线以南,南濒北部湾、面向东南亚,西南与越南毗邻,红树林分布东起合浦山口,西至东兴北仑河口的整个海岸带。而广西茅尾海红树林位于钦州市的钦南区和钦州港区[27],包括坚心围、康熙岭、七十二泾和大风厂四个片区[28],是我国最大最典型的岛群红树林和岩滩红树林,面积约1892hm2[29]。2005年自治区人民政府为保护南亚热带河口、港湾和海岸滩涂湿地生态系统,特建立了茅尾海红树林自然保护区。其中,样品采集地点康熙岭片区红树林植物群落较为丰富,包括真红树植物无瓣海桑、桐花树及伴生植物互花米草。而在坚心围片区样品采集地点只存在桐花树群落。
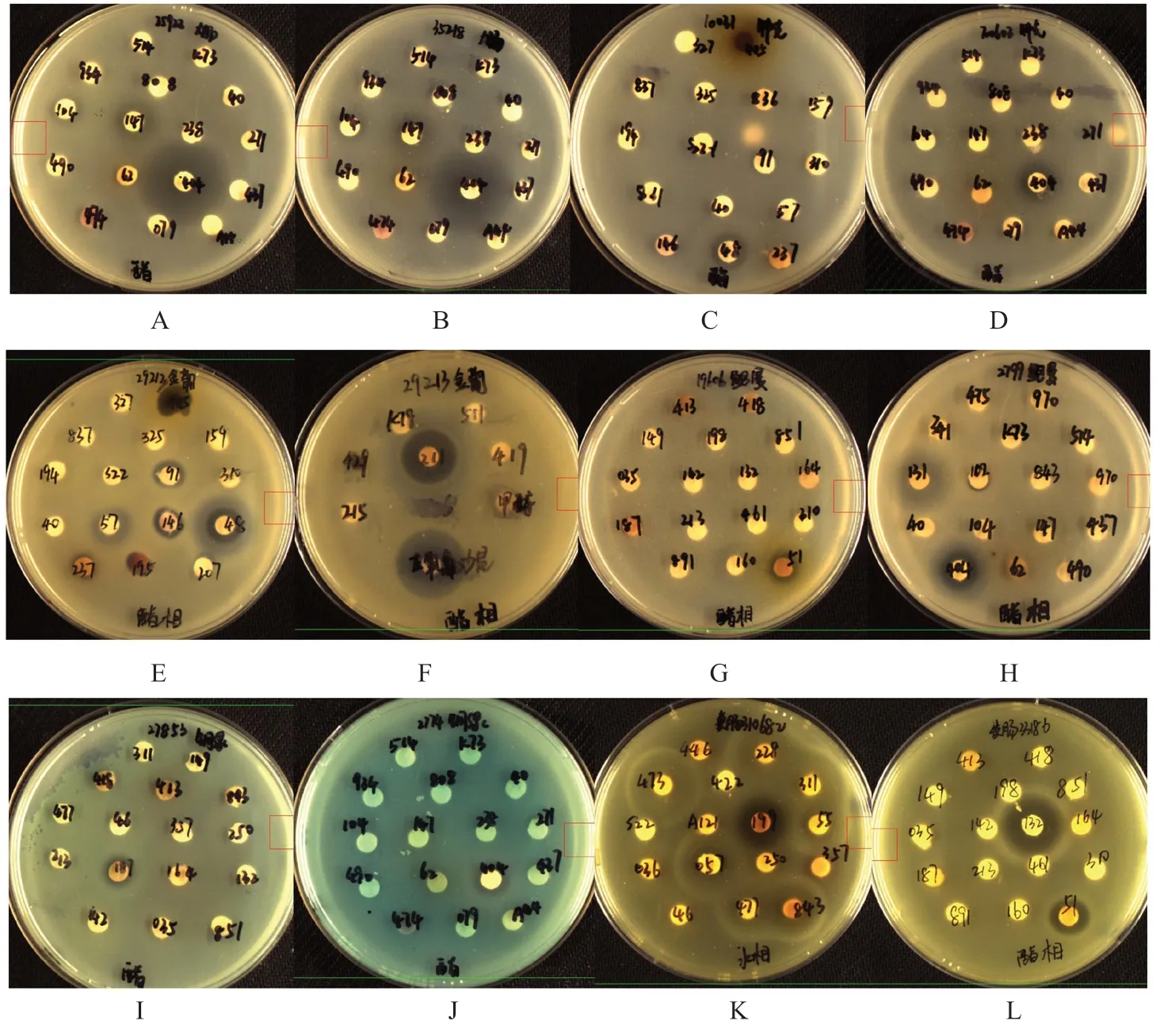
图5 部分发酵菌株对检定菌株抑菌效果Fig.5 The partly important results of antibacterial assay
在多样性方面,吴家法等[30]从茅尾海红树林采集的25份样品中分离出放线菌117株,分布于6个目10个科19个属。本次研究从8份样品中共获得了244株放线菌,分布于5个目13个科29个属。经对比发现本次分离筛选到的放线菌属较之前丰富,获得了之前未分离到的放线菌属18个。由此分析可以得出,茅尾海红树林淤泥中的放线菌资源丰富。同时,不同且大量的放线菌被分离与筛选,不仅丰富了抗菌活性筛选菌株,也为我们挖掘新抗生素类活性物质提供了坚实的基础。
在新颖性方面,进行本次研究之前,通过查阅文献,吴家法、姜明国和龚斌等[30-32]在茅尾海红树林保护区红树林发现链霉菌属、小单孢菌属、分枝杆菌属等属的潜在新菌株。而此次在坚心围和康熙岭片区的研究中,经16S rRNA序列比对和建树后发现了4株潜在的放线菌新物种Arthrobacter(K7A10-207)、Amnibacterium(S4B6-851)、Lysinimicrobium(K7B1-327)和Streptomyces(K6A10-57),相似率都低于98.65%。为此,我们可以对这4株放线菌菌株开展分类学研究。
在稀有放线菌方面[33],除了以上提到的潜在新菌株Amnibacterium(S4B6-851)、Lysinimicrobium(K7B1-327),还包括放线异壁酸菌属(Actinoallomurus)和球状孢囊菌属(Sphaerisporangium)都是本次分离获得的稀有菌属。其中放线异壁酸菌属属于链孢囊菌科,是最近十年内被相继发现的,随后研究者对该属菌株进行了研究,现已获得具有抗菌活性的醌类化合物[34]及聚醚类化合物[35];另外,日本学者从球孢囊菌属菌株Sphaerisporangiumsp.33226中获得了MBJ-0086和MBJ-0087这两种新双环缩肽[36]。本研究获得的稀有放线菌为我们筛选新型抗生素提供了优质菌株。

